患儿女,15岁,因20 d前抽搐1次,发现肺部结节20 d,发热1 d入院。患儿20 d前无明显诱因出现双腿麻木2次,发作时不能走路,意识清醒,伴头痛、视物模糊、胸闷、出汗,每次持续约3~5 min,休息后缓解。无呕吐,无抽搐,无晕厥,无心悸,偶有咳嗽,无咳痰,无喘息,无腹痛、腹泻,无大小便失禁。当日就诊外院,候诊过程中出现抽搐,表现为全身性发作,口唇发绀,双眼上翻,四肢强直,无口吐白沫,无大小便失禁,持续约10~15 min。抽搐后一般情况可,意识清醒。头颅CT及头颅磁共振成像(MRI)+磁共振血管造影(MRA)检查未见明显异常。胸部CT提示双肺渗出性改变,两肺多发小结节影。脑电图检查示双侧顶、枕、后颞区慢波,左侧枕区尖波。于15 d前开始口服奥卡西平,150 mg/次,2次/d,1周后加量为300 mg/次,2次/d。其间患儿未再抽搐发作及肢体麻木。11 d前患儿来我院就诊,复查胸片提示双肺纹理增多,右上肺多发小结节影。肺功能检查提示肺活量稍低,气道阻力高,自身抗体抗SS-A52、抗SS-A/Ro抗体、抗SS-B/La抗体强阳性。1 d前患儿受凉后夜间出现发热,体温最高38℃,偶有鼻塞,无明显咽痛、咳嗽,无皮疹,无关节肿痛,无口腔溃疡,口服布洛芬后体温可降至正常。为进一步明确诊断收入我院。
既往史:入院前10个月曾出现1次双腿发麻,下肢无力并摔倒,伴头痛,持续约10 min后缓解,无胸闷心悸。脑电图等检查未见异常,头颅增强MRI检查示左额叶局部小条形大致与相应部位小血管一致强化信号。之后间断有类似头痛发作,持续10~30 min后可缓解,未再就诊。无其他特殊疾病,无反复鼻衄病史。既往无惊厥病史,无结核接触史,无其他慢性疾病病史。
个人史及家族史:足月剖宫产出生,出生体重3 300 g。智力、体格发育正常。12岁月经初潮,月经周期为35 d,每次持续4~5 d,月经量正常。无癫痫及遗传性疾病家族史。
入院体格检查:体温38℃,心率90次/min,呼吸20次/min,血压127/66 mm Hg,身高165 cm,体重56 kg。经皮血氧饱和度(SpO2)93%。神志清楚,发育正常,精神反应可,无蝶形红斑,口唇无明显发绀,浅表淋巴结无明显肿大,颈软无抵抗,口腔黏膜无溃疡,咽部充血,双侧扁桃体Ⅰ度肿大,无三凹征,双肺呼吸音粗,未闻及干湿啰音,心腹部体查无异常。四肢肌力、肌张力正常,关节无红肿,活动正常,甲床略发绀,无杵状指。布氏征和克氏征阴性,双侧巴氏征阴性。
实验室检查:血常规示WBC 6.5×109/L [参考值:(4.5~10)×109/L],N 73.9%(参考值:40%~ 75%),RBC 5.7×1012/L [参考值:(3.5~5.5)×1012/L],Hb 162 g/L(参考值:120~140 g/L),血小板181×109/L [参考值:(100~300)×109/L],C-反应蛋白6.1 mg/L(参考值:0~10 mg/L),肝肾功能、电解质、心肌酶、凝血功能、肌钙蛋白I定量均正常,N-末端尿钠肽正常。动脉血气分析示pH 7.465(参考值:7.35~7.45),PO2 61.5 mm Hg(参考值:83~108 mm Hg),PaCO2 24.6 mm Hg(参考值:32~48 mm Hg),其余指标正常。自身抗体检查示抗核抗体(ANA)1 : 320,抗SS-A/Ro抗体强阳性,抗SS-B/La抗体强阳性,抗双链DAN抗体(dsDNA)阴性,狼疮抗凝物阴性,抗心磷脂抗体及抗中性粒细胞胞浆抗体阴性,直接Coomb's试验阴性,抗β2糖蛋白抗体及类风湿因子阴性。甲状腺功能、甲状腺微粒体抗体及抗甲状腺球蛋白抗体均阴性。免疫球蛋白IgG 17.2 g/L(参考值:6.94~16.18 g/L),IgA 4.03 g/L(参考值:0.7~3.8 g/L),IgM 0.754 g/L(参考值:0.6~2.63 g/L),IgE 334.8 IU/mL(参考值:≤100 IU/mL),总补体63 U/mL(参考值:23~46 U/mL)。肿瘤标志物神经元特异性烯醇化酶、鳞状上皮细胞癌抗原、癌胚抗原、胃泌素释放肽前体、骨胶素CYFRA21-1、糖链抗原19-9均正常。24 h尿蛋白定量为228 mg(参考值:< 150 mg)。腰椎穿刺脑脊液常规生化检查无异常。骨髓穿刺大致正常。淋巴细胞干扰素试验阴性,真菌G试验和GM试验阴性,结核菌素试验阴性。体液免疫及细胞免疫功能大致正常。口服抗癫痫药物后,复查脑电图及视频脑电图未见异常。心电图未见异常。肺功能无弥散功能障碍。心脏超声提示二尖瓣、主动脉瓣、肺动脉瓣少量反流。眼底检查正常。
2 诊断思维15岁青春期女孩,以下肢麻木、抽搐起病,脑电图异常,血气分析提示低氧血症,肺部发现多发结节影,同时发现多种自身抗体阳性。生长发育正常,甲床略发绀,无杵状指/趾。动脉血气分析提示PaO2 < 80 mm Hg,低氧血症明确。虽然患儿多种自身抗体阳性,但无明确其他器官受累表现,无发热、皮疹、口腔溃疡、关节肿痛表现,很难用一种结缔组织病解释病情,因此将抽搐、低氧血症作为诊断切入点。
青春期女孩无热抽搐的原因,需要考虑以下疾病。(1)神经源性疾病:①癫痫,常表现为慢性、反复发作的惊厥,无明显诱因,2次惊厥发作间隔大于24 h,可伴有脑电图的异常。本例患儿仅无热抽搐1次,依据不足,同时伴有低氧血症,还需除外其他疾病。②颅内病变:患儿有间断发作头痛,伴有抽搐表现,需考虑颅内病变,但患儿头痛呈间断发作,间隔时间长,无发热,神经系统无异常体征,脑脊液检查可除外中枢神经系统感染;头颅MRI平扫及增强未见占位性病变,不支持颅内占位性病变。患儿多种自身抗体阳性,需警惕自身免疫性脑炎,待进一步复查头颅影像学及脑脊液自身抗体检测;患儿增强头颅MRI检查提示可疑血管影,进一步行头颅MRA检查除外颅内血管异常所致惊厥。
(2)心源性疾病:①心律失常:重症心肌炎、先天性长Q-T综合征等可因严重心律失常引起阿斯综合征导致抽搐,患儿多次心电图无明显异常,心肌酶及肌钙蛋白正常,心功能正常,不支持心律失常的诊断;②心脏结构异常:心脏结构异常可引起心脏功能严重异常导致低氧血症引起抽搐,但患儿超声心动图未见异常,因此不考虑心脏结构异常。
(3)自主神经介导性疾病:患儿为青春期女孩,伴有间断发作头痛及无热惊厥,需考虑自主神经介导性疾病,如功能性心血管疾病,但患儿无体位变化诱发症状的特点,自主神经介导性疾病的可能性小。
(4)代谢性疾病:患儿表现为无热惊厥,病史无明显体液丢失证据,血气无酸中毒、电解质紊乱、肝肾功异常、低血糖等,可除外代谢性疾病。
(5)精神因素:患儿为青春期女孩,无热惊厥及间断头痛,神经系统体查无异常体征,需考虑精神因素引起心因性非痫性事件,但患儿无明显情绪诱发症状的病史,惊厥呈强直阵挛性发作,脑电图检查提示异常,因此精神因素所致的可能性小。
引起儿童低氧血症的病因可见于以下几类。(1)低通气的疾病:主要见于中枢神经系统抑制、神经肌肉疾病及气道异常。(2)通气/血流灌注比值失调:常见原因包括阻塞性肺病、肺栓塞和肺水肿等。(3)右向左分流,包括心内分流、肺动静脉畸形和肝肺综合征。(4)弥散受限常由肺泡和/或肺间质炎症和纤维化所致,例如间质性肺疾病,弥散受限的特点为运动诱发或运动加重低氧血症。患儿无中枢神经系统抑制、神经肌肉病变,肺部CT无气道异常,可除外低通气所致低氧血症,患儿无呼吸困难、咯血表现,无活动后气促表现,肺部CT未见肺炎和间质改变,可除外通气血流灌注失衡和弥散障碍所致低氧血症。结合临床,不支持肺结核、卡氏肺囊虫、真菌感染等特殊感染;超声心动图未见明显的结构异常,可排除右向左分流型先天性心脏病,还需注意有无肺动静脉畸形(pulmonary arteriovenous malformation, PAVM)。
患儿进行了直立-仰卧位SpO2试验,为阳性(直立位时SpO2 90%,仰卧位时SpO2 94%,差值大于2%为阳性[1]),考虑诊断PAVM。患儿Hb升高、RBC增多为低氧血症引起的继发性红细胞增多症。
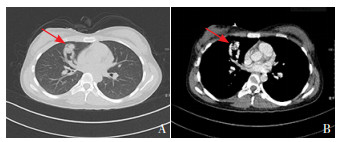
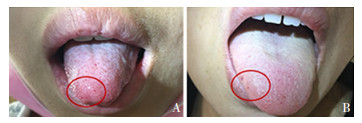
3 进一步检查入院后进一步完善相关检查。肺部CT增强扫描右肺中叶见不规则稍高密度结节,约2.7 cm×2.2 cm,分叶状,其内密度欠均匀,增强扫描可见明显强化,局部见粗大血管影,与肺血管相连(图 1),考虑肺血管畸形可能。因大多数肺血管畸形患者同时患有遗传性出血性毛细血管扩张症(hereditary hemorrhagic telangiectasia, HHT),仔细询问家族史,追问出患儿母亲6年前因肺部肿物在外院做手术切除,诊断为血管病变。患儿母亲在住院期间头颅MRI检查提示左侧颞叶异常强化结节,约5 mm×5 mm,因其无神经系统症状,未再复查。患儿母亲平时经常鼻衄,轻度贫血,舌尖有点状毛细血管扩张表现。检查患儿舌部,有与母亲舌部一致表现(图 2)。患儿鼻前庭部有可疑毛细血管扩张,无鼻衄表现。随后患儿及父母进行了HHT相关基因检测。
|
图 1 胸部CT增强图像 图A、B分别为入院后胸部CT增强扫描的肺窗和对应纵隔窗图像。显示右肺中叶不规则稍高密度结节,约2.7 cm×2.2 cm,分叶状,其内密度欠均匀(箭头所示)。 |
|
图 2 患儿(图A)及其母亲(图B)舌部毛细血管扩张表现 |
复查头颅MRI平扫提示左侧额叶局部可见小片状高信号,与相应部位血管强化影一致。脑脊液常规、生化及培养、病毒PCR检测、24 h鞘内合成率及寡克隆带正常,抗NMDAR抗体阴性,可排除中枢神经系统感染和自身免疫性脑炎。头颅MRI检查提示左额叶局部小条形大致与相应部位小血管一致强化信号,建议动态追踪除外脑血管畸形。头颅MRA未见异常,头颅增强磁共振静脉造影(CEMRV)未见异常。
4 诊断及确诊依据患儿最后被诊断为:(1)PAVM:患儿起病隐匿,有甲床发绀,血气分析提示低氧血症,PaO2下降,SaO2下降,直立-仰卧位SpO2试验阳性,胸部影像学符合PAVM影像学改变。
(2)HHT:根据Curacao诊断标准[2],即①自发的反复性鼻衄;②多发性皮肤黏膜毛细血管扩张;③内脏受累,如胃肠道毛细血管扩张,肺、脑或肝脏动静脉畸形;④存在1例患有HHT的一级亲属。符合以上4条中的3~4条可确诊为HHT[2]。患儿母亲及患儿均符合3条,可明确诊断为HHT。随后进行的遗传学检查也证实患儿和母亲均存在ENG基因的杂合突变。该突变与HHT 1型相关[2]。
(3)考虑偏头痛、缺血性卒中发作:患儿1年来出现发作性头痛,首先出现眼前黑影,并逐渐扩大,随后右侧头痛,严重时可出现呕吐,发作时畏光畏声,睡眠休息后缓解,约1个月发作1次,符合偏头痛发作特点。患儿病程中出现抽搐1次,表现为全身性发作,脑电图检查提示尖波放电,头颅MRI检查提示左额叶局部小条形大致与相应部位小血管一致强化信号,结合脑电图异常,考虑入院20 d前癫痫发作可能与较大栓子脱落所致缺血性卒中发作有关。
(4)未分化型结缔组织病:患儿虽然多种自身抗体阳性,但无明确多器官受累表现,考虑为未分化型结缔组织病,仍需长期随访患儿自身抗体及有无多系统受累表现。
(5)上呼吸道感染:患儿入院时伴有发热,无明显咳嗽流涕,咽充血,双侧扁桃体未见渗出,双肺听诊无异常,上呼吸道感染诊断明确。
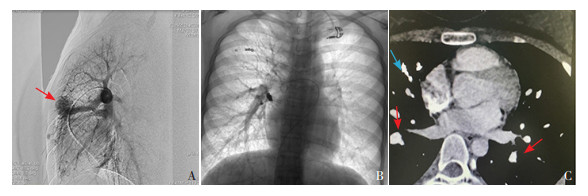
5 临床经过入院后给予鼻导管吸氧,请介入科会诊,因PAVM诊断明确,行肺动静脉造影及肺动脉栓塞术。局麻下经右侧股静脉Seldinger技术进行穿刺,放置4F血管鞘管,以超滑导丝辅助猪尾导管进行双肺动脉造影,见右肺上叶及中叶两处动静脉畸形(图 3A),以微导管辅助,分别进行两处动静脉畸形栓塞,使用微弹簧圈多枚,直至满意,复查造影动静脉畸形未再显影(图 3B)。常规加压包扎,患儿安返病房。术后患儿未吸氧下SpO2可达98%。术后1周复查血气分析:pH 7.382(参考值:7.35~7.45),PaO2 66.8 mm Hg(参考值:83~108 mm Hg),PaCO2 36.7 mm Hg(参考值:32~48 mm Hg)。
|
图 3 肺血管造影检查 A:术中右肺动脉血管造影,显示右肺中叶见动静脉畸形(箭头所示);B:术中封堵术后的右肺血管显影,未见动静脉畸形显影;C:术后3个月复查肺动脉血管造影,纵隔窗显示多发动静脉畸形,蓝色箭头为原右侧封堵器显影,红色箭头所指为动静脉畸形。 |
因明确诊断为HHT,考虑患儿有缺血性卒中表现,给予抗凝治疗(口服华法令3.75 mg/d),并定期检测凝血功能国际标准化比值。
术后随访:患儿无咳嗽、咯血、胸闷、气促等不适,未再出现抽搐。出院后2个月出现头痛发作2次,急性呼吸道感染1次。复查自身抗体较前无变化,在家监测SpO2在95%~97%之间。出院后3个月复查肺CT血管造影,提示右肺上叶、中叶见金属密度影,双肺可见多发异常血管交通,增强扫描呈血管样强化,左肺上叶舌段可见迂曲增强血管影(图 3C)。
6 讨论HHT是一种常染色体显性遗传性血管疾病,发病率约为1/5 000[3]。HHT最常见的表现为复发性鼻衄、特殊部位的皮肤黏膜(唇、口腔、手指、鼻部)毛细血管扩张,常伴有内脏,如肺、肝和脑的动静脉畸形,脊髓或胃肠道的毛细血管扩张(伴或不伴出血)和家族史,尤其是一级亲属患有HHT的家族史(或基因突变)[3]。90% PAVM患者伴有HHT,30%~50% HHT患者伴有PAVM[4]。此例患儿发病时无鼻衄表现,目前其前庭部可疑毛细血管扩张,仍需随访。
HHT是引起PAVM的最常见原因,PAVM可使体循环静脉血绕开正常的肺循环,导致反常栓子性脑卒中、脑脓肿和偏头痛、癫痫[5]。神经系统并发症可出现于各年龄组,来自一项纳入病例最多的HHT研究,其中 < 18岁组神经系统合并症发生率为16.8%,其中惊厥占8.3%,头痛占5.5%,卒中占0.4%,脑动静脉畸形占4.4%[6]。鉴于新生的中枢神经系统血管畸形很少,很多血管畸形在出生后逐渐形成,但出现神经系统症状的时间延迟,有几种可能的解释:(1)患者和医师对HHT的认识和理解不足,导致诊断延迟到成年期;(2)PAVM缺乏标准的筛查方案;(3)对无症状或“小”PAVM在年轻患者中引起栓塞性中枢神经系统疾病的风险认识不足[7]。PAVM主要的相关并发症包括危及生命的出血,以及由反常栓塞引起的脑脓肿(8%)和缺血性卒中(9%~18%)[8-10]。此例患儿神经系统症状突出,出现偏头痛、癫痫症状,考虑与PAVM有关,提示对于无热惊厥起病患儿,除颅内病变外,还需考虑有无PAVM。
基因分型对临床表型有重要提示意义,如ENG基因编码的内皮因子突变引起的HHT 1型更易引起PAVM和脑动静脉畸形,ACVRL1基因编码的ALK1突变引起的HHT 2型可引起肝动静脉畸形、肺动脉高压和脊髓动静脉畸形,MADH4基因编码的SMAD4突变引起毛细血管扩张-幼年型息肉病综合征、动静脉畸形和肺动脉高压。62%的ENG基因突变者发生PAVM,而ACVRL1基因突变者近10%发生PAVM,8%~16%的ENG基因突变者发生脑动静脉畸形,1%~2%的ACVRL1基因突变者发生脑动静脉畸形[8-11]。进行基因型检测,预知临床类型,对今后预防合并症发生及指导随访具有重要意义[12]。本例患儿及父母均进行了基因检测,患儿母亲及患儿均为ENG基因突变引起的HHT 1型。此型患者PAVM和脑动静脉畸形更常见。因患儿和母亲头颅MRI检查均提示有可疑高密度影,不除外颅内血管畸形,仍需密切随访。目前的相关指南建议,在儿童HHT患者中需筛查中枢神经系统动静脉畸形(最好是在首次HHT诊断时),同时进一步强调在HHT确诊时和18岁之前进行PAVM筛查[3, 13]。MRI检测脑微动静脉畸形的灵敏度较差,但加用对比增强剂钆(用于 > 2岁患者)可增加其灵敏度[3]。本例患儿发病时无明显鼻衄表现,但鼻内镜显示有前庭部毛细血管扩张迹象,PAVM诊断明确,表现为发作性头痛、癫痫发作,而神经系统影像提示可疑血管病变,仍需密切随访神经系统影像学尤其血管畸形表现。
HHT患者应注意避免潜水等运动,静脉输液时必须应用除菌滤过器,拔牙、外科手术后预防性应用抗生素,定期行高凝状态评估,适时抗凝抗血小板治疗,存在妊娠高风险[14]。此例患儿为青春期女孩,需向家属交待后期发生上述疾病的风险。
CT血管造影是诊断PAVM的金标准,可确定所有可能的PAMV和滋养血管。确定血管畸形的位置、类型和滋养动脉直径非常重要。PAVM可分为简单型,即只有一条滋养动脉,占80%~90%;复杂型,多节段滋养动脉,占10%~20%,比较罕见的弥漫型 < 5%[15-16]。PAVM如果未经治疗,病死率较高,因此血管内封堵治疗是所有滋养动脉直径 > 3 mm的PAVM的一线治疗。目前建议,对于所有PAVM,如技术手段可行,尤其如果有症状,不管滋养动脉直径如何,都应积极治疗。最近,研究报道巨噬细胞缺乏ENG基因的小鼠表现为免疫系统受损,或许可以解释为何HHT患者有较高几率发生感染性疾病[17]。
PAVM封堵治疗后有高达10%~25%首次成功栓塞治疗的患者因复发需再次栓塞治疗,其可能原因包括:已栓塞供血血管的再通(血流经栓塞的弹簧圈持续灌注)、肺动脉-肺动脉的再灌注(已栓塞血管闭塞,但邻近肺动脉侧支循环形成)、栓塞不全(复杂的PAVM、漏栓或微小供血血管生长增粗)[18]。本例患儿PAVM为弥漫型,封堵治疗后短期改善,但术后监测SpO2由98%降至95%,间断有头痛发作,考虑不除外封堵后再通,复查肺CT血管造影可见多发PAVM,行肺动脉造影术可见右肺动脉造影两处局部动静脉畸形(靠近外周),左肺动脉造影见一处局部动静脉畸形(靠近外周),因导丝无法进入分支动脉,未行封堵治疗,并继续应用华法令抗凝治疗。这提示,本病为基因表达异常所致,涉及多种内脏血管畸形,临床治疗困难,需长期随访。
本例患儿是因抽搐、肺部结节入院,血气分析提示低氧血症,进而考虑为PAVM,并发现舌部毛细血管扩张,最终确诊。由于HHT患者可能首发表现不同,会因鼻衄、低氧血症、胃肠道出血、偏头痛及癫痫等不同症状首诊不同科室,因此,对反复鼻衄、低氧血症、癫痫、偏头痛患者合并其他皮肤黏膜毛细血管扩张表现者,应警惕HHT的可能,临床医师应提高对此类疾病的认识,尤其合并内脏毛细血管扩张者。HHT合并PAVM者如出现症状,需要积极治疗。肺动脉封堵术不能解决所有血管畸形,且有术后复发风险,需长期多学科管理,应推广多学科综合治疗的模式用于患者的治疗过程中,以改善患者的长期生活质量。
| [1] |
Santhirapala V, Chamali B, McKernan H, et al. Orthodeoxia and postural orthostatic tachycardia in patients with pulmonary arteriovenous malformations: a prospective 8-year series[J]. Thorax, 2014, 69(11): 1046-1047. DOI:10.1136/thoraxjnl-2014-205289 (  0) 0) |
| [2] |
Chung MG. Hereditary hemorrhagic telangiectasia[J]. Handb Clin Neurol, 2015, 132: 185-197. (  0) 0) |
| [3] |
Faughnan ME, Palda VA, Garcia-Tsao G, et al. International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia[J]. J Med Genet, 2011, 48(2): 73-87. DOI:10.1136/jmg.2009.069013 (  0) 0) |
| [4] |
Cartin-Ceba R, Swanson KL, Krowka MJ. Pulmonary arteriovenous malformations[J]. Chest, 2013, 144(3): 1033-1044. DOI:10.1378/chest.12-0924 (  0) 0) |
| [5] |
Circo S, Gossage JR. Pulmonary vascular complications of hereditary haemorrhagic telangiectasia[J]. Curr Opin Pulm Med, 2014, 20(5): 421-428. DOI:10.1097/MCP.0000000000000076 (  0) 0) |
| [6] |
Iyer VN, Brinjikji W, Apala D, et al. Impact of age on outcomes in hospitalized patients with hereditary hemorrhagic telangiectasia[J]. Adv Hematol, 2018, 2018: 4798425. (  0) 0) |
| [7] |
Pierucci P, Lenato GM, Suppressa P, et al. A long diagnostic delay in patients with hereditary haemorrhagic telangiectasia: a questionnaire-based retrospective study[J]. Orphanet J Rare Dis, 2012, 7: 33. DOI:10.1186/1750-1172-7-33 (  0) 0) |
| [8] |
Morgan T, McDonald J, Anderson C, et al. Intracranial hemorrhage in infants and children with hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome)[J]. Pediatrics, 2002, 109(1): E12. DOI:10.1542/peds.109.1.e12 (  0) 0) |
| [9] |
Patel T, Elphick A, Jackson JE, et al. Injections of intravenous contrast for computerized tomography scans precipitate migraines in hereditary hemorrhagic telangiectasia subjects at risk of paradoxical emboli: implications for right-to-left shunt risks[J]. Headache, 2016, 56(10): 1659-1663. DOI:10.1111/head.12963 (  0) 0) |
| [10] |
Fatania G, Patel M, Jackson JE, et al. P175 burden of cerebral infarcts identified by screening cerebral mri scans in patients with pulmonary arteriovenous malformations[J]. Thorax, 2017, 72(Suppl 3): A177. (  0) 0) |
| [11] |
de Gussem EM, Edwards CP, Hosman AE, et al. Life expectancy of parents with hereditary haemorrhagic telangiectasia[J]. Orphanet J Rare Dis, 2016, 11: 46. DOI:10.1186/s13023-016-0427-x (  0) 0) |
| [12] |
赵亚丽, 张媛, 王向东, 等. 遗传性出血性毛细血管扩张症临床及基因检测综合诊断的应用[J]. 中国耳鼻咽喉头颈外科, 2018, 25(9): 507-511. (  0) 0) |
| [13] |
van Gent MW, Post MC, Snijder RJ, et al. Real prevalence of pulmonary right-to-left shunt according to genotype in patients with hereditary hemorrhagic telangiectasia: a transthoracic contrast echocardiography study[J]. Chest, 2010, 138(4): 833-839. DOI:10.1378/chest.09-1849 (  0) 0) |
| [14] |
Shovlin CL, Condliffe R, Donaldson JW, et al. British thoracic society clinical statement on pulmonary arteriovenous malformations[J]. Thorax, 2017, 72(12): 1154-1163. DOI:10.1136/thoraxjnl-2017-210764 (  0) 0) |
| [15] |
Chamarthy MR, Park H, Sutphin P, et al. Pulmonary arteriovenous malformations: endovascular therapy[J]. Cardiovasc Diagn Ther, 2018, 8(3): 338-349. DOI:10.21037/cdt.2017.12.08 (  0) 0) |
| [16] |
吴茂兰, 郑湘榕, 朱彦潼, 等. 4岁3月龄女孩发绀4年余[J]. 中国当代儿科杂志, 2020, 22(4): 387-390. (  0) 0) |
| [17] |
Ojeda-Fernández L, Recio-Poveda L, Aristorena M, et al. Mice lacking endoglin in macrophages show an impaired immune response[J]. PLoS Genet, 2016, 12(3): e1005935. DOI:10.1371/journal.pgen.1005935 (  0) 0) |
| [18] |
戚春厚, 宗焕波, 李俊, 等. 肺动静脉畸形经导管弹簧圈栓塞治疗复发类型分析与再治疗[J]. 临床放射学杂志, 2017, 36(2): 279-282. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


