作为一种表观遗传方式,组蛋白乙酰化在脑细胞的发育过程中起到了重要的调控作用。组蛋白乙酰化由组蛋白乙酰转移酶(histone acetyltransferases, HATs)和组蛋白去乙酰化酶(histone deacetylases, HDACs)共同调控[1]。HATs使核小体结构变松弛,各种转录因子和协同转录因子能与DNA位点特异性结合,激活基因的转录。而HDACs使组蛋白氨基末端去掉乙酰基暴露带正电荷的碱性氨基酸,与带负电荷的DNA紧密结合形成致密的染色质结构,抑制下游基因的转录。
哺乳动物HDACs由4类基于结构域不同的超家族构成。第1类中的HDAC1和HDAC2(HDAC1&2)广泛表达于各类细胞的细胞核中,是发育过程中的重要调控因子[2]。HDAC1和HDAC2在功能上具有冗余性,HDAC1或HDAC2单独缺失对脑的发育、脑结构和小鼠寿命无明显影响;而HDAC1和HDAC2共同缺失会导致脑结构严重受损和胚胎期小鼠死亡[3]。在中枢神经系统中,HDAC1&2在早期大脑皮质发育中控制神经中间祖细胞的定位,缺失HDAC1&2导致神经中间祖细胞错误迁移,进而使大脑皮质发育畸形[4];在神经干细胞中敲除HDAC1&2会导致胚胎期小鼠死亡,伴有整个脑的体积缩小和大脑皮质、小脑结构受损[3]。在少突胶质细胞发育中,HDAC1&2通过抑制WNT通路的激活来维持少突胶质细胞的分化,缺失HDAC1&2导致少突胶质细胞无法正常成熟和形成髓鞘[5];此外,在胚胎时期,小鼠小胶质细胞中敲除HDAC1&2会导致小胶质细胞发育不良,存活率下降[6]。在外周神经系统中,HDAC1&2是施旺细胞形成髓鞘的关键转录因子,缺失HDAC1&2导致外周神经脱髓鞘化[7]。
目前HDAC1&2在神经元发育中的作用尚鲜有报道。突触蛋白1(Synapsin1)是突触蛋白家族的成员,编码与突触小泡表面相关联的蛋白,参与突触发生和调节神经递质释放。具有Synapsin1启动子Cre重组酶(Synapsin1-Cre)的小鼠在神经元中特异性表达Cre重组酶[8]。因此我们通过与Synapsin1-Cre小鼠杂交建立了在神经元中特异性敲除HDAC1&2的小鼠模型,用以探索HDAC1&2在神经元发育过程中的作用。
为进一步探索HDAC1&2在神经元发育过程中的作用机制,我们尝试探索敲除HDAC1&2后脑组织不同信号通路的变化。既往研究表明,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是细胞内信号通路转导分子,调节很多重要的生理过程。在中枢神经系统中,mTOR信号通路能够调节神经元形态,调控各类蛋白质合成[9]。此外,mTOR信号通路还对轴突生长发育起正向调节作用[10]。因此,本研究中,我们着重检测了小鼠神经元敲除HDAC1&2后mTOR信号通路的变化。
1 材料与方法 1.1 实验动物Synapsin1-Cre、HDAC1flox/+和HDAC2flox/+小鼠为本实验室饲养。亲本通过杂交得到HDAC1&2flox/flox和Synapsin1-Cre HDAC1&2flox/+基因型小鼠。将HDAC1&2flox/flox小鼠与Synapsin1-Cre HDAC1&2flox/+小鼠再次杂交,获得Synapsin1-Cre HDAC1&2flox/flox基因型小鼠。该小鼠神经元内表达的Cre酶可使HDAC1&2基因内两个loxp位点重组,最终使HDAC1&2被敲除。将该基因型小鼠作为敲除组,同窝出生的HDAC1&2flox/flox、HDAC1flox/+HDAC2flox/flox、HDAC1flox/floxHDAC2flox/+、HDAC1&HDAC2flox/+小鼠作为对照组(图 1)。
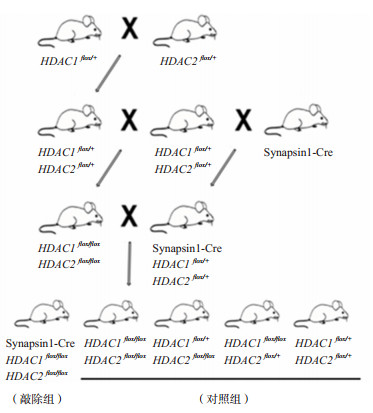
|
图 1 敲除小鼠构建策略 |
兔抗HDAC1抗体(Thermo公司,美国)、HDAC2抗体(Abcam公司,英国);鼠抗神经元核抗原(neuronal nuclear antigen, NeuN)(Millipore公司,美国);鼠抗磷酸化神经丝蛋白重链(phosphorylated neurofilament H, p-NF200)及非磷酸化神经丝蛋白重链(non-phosphorylated neurofilament H, np-NF200)(Covance公司,美国);兔抗磷酸化核糖体S6(p-S6)(CST公司,美国);山羊血清(Millipore公司,美国);脱脂奶粉(上海碧云天生物公司)。
1.3 组织切片制备小鼠用乙醚麻醉后固定于解剖盘内。剪开右心包,从左心室注入预冷的磷酸盐缓冲液(PBS),观察到肝脏变白后注入4%预冷的多聚甲醛(PFA)。此时剪开小鼠颅骨,剔除脑膜取出完整脑组织。
取出的脑组织于4% PFA中固定过夜。梯度酒精依次脱水,二甲苯置换酒精后于融化的石蜡缸中浸蜡过夜。组织块包埋,用LEICA石蜡切片机切成4 μm的切片,常温保存。
取出的脑组织放置于4% PFA中固定过夜。4%PBS琼脂糖包埋,用LEICA振动切片机切成50 μm的切片,浸泡于PBS中4℃保存。
1.4 苏木精-伊红染色石蜡切片脱蜡复水后,苏木素染液室温孵育10 min,流水缓慢冲洗去除多余染色。盐酸酒精分化数秒,流水冲洗。伊红染液室温孵育2 min,梯度酒精脱水、二甲苯透明后封片。
1.5 免疫组化染色石蜡切片脱蜡复水后置于抗原修复液中100℃水浴加热半小时。使用含0.3% TritonX-100的PBS处理15 min,3%过氧化氢处理20 min。封闭液(含5% FBS+0.3% TritonX-100的PBS)室温孵育1 h。一抗溶解于封闭液中,NeuN(1 : 400)、np-NF200(1 : 1 000)、p-NF200(1 : 1 000)、p-S6(1 : 200),4℃孵育过夜。二抗室温孵育1 h,根据抗体特性,DAB显色适当时间。苏木素处理2 min,盐酸酒精分化后流水冲洗,脱水、透明、封片。
1.6 Western blot检测小鼠经乙醚麻醉后灌注,快速取出脑组织。在冰上于PBS中分离出大脑皮质放入标记好的离心管,裂解后离心取上清液。加入等体积2×Loading Buffer,100℃处理15 min。取等体积蛋白样品加样,电泳、转膜。PVDF膜封闭后浸于按比例稀释好的一抗溶液中,4℃过夜,二抗室温孵育2 h。ECL化学发光试剂浸泡2 min,凝胶成像仪曝光成像。
1.7 统计学分析采用Graphpad Prism 5统计软件对数据进行统计学分析。计量资料使用均数±标准差(x±s)表示,两组均数比较采用两样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 神经元特异性敲除HDAC1&2小鼠模型验证Cre重组酶最早于孕12.5 d在神经元中表达,取出生后(P)14 d两组小鼠大脑皮质,经Western blot检测HDAC1及HDAC2蛋白表达量,结果显示敲除组小鼠HDAC1及HDAC2蛋白表达水平明显低于对照组(P < 0.05,图 2、表 1),提示敲除组小鼠HDAC1&2得到敲除。

|
图 2 Western blot检测P14 d两组小鼠HDAC1、HDAC2蛋白表达电泳图 |
| 表 1 两组小鼠HDAC1、HDAC2蛋白相对表达水平比较 (n=3,x±s) |
|
|
敲除组小鼠出生比例符合孟德尔定律,通常在出生后1个月以内死亡,死亡时间多在P13 d~P16 d(图 3A)。对照组小鼠则无明显异常表型,可正常繁殖。在正常饲养环境下,敲除组小鼠在P11 d~P13 d出现全身性震颤,无法平稳行走等运动功能异常现象。提起尾巴时对照组小鼠后肢张开,而敲除组小鼠则紧抱后肢(图 3B)。敲除组小鼠脑组织和体型相较对照组明显减小(图 3C~D)。
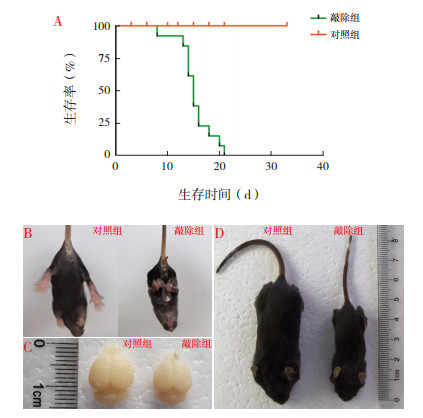
|
图 3 神经元特异性敲除HDAC1&2小鼠一般情况 A:小鼠生存曲线(n=13):敲除组小鼠通常在出生后1个月内死亡,死亡时间多在P13 d~P16 d;B:P14 d小鼠后肢形态:对照组小鼠后肢张开,敲除组小鼠紧抱后肢;C:P14 d小鼠脑组织大小对比:敲除组小鼠脑组织明显小于对照组;D:P14 d小鼠体型对比:敲除组小鼠体型明显小于对照组。 |
为研究敲除HDAC1&2是否对小鼠神经元正常发育产生影响,用成熟神经元标记物NeuN进行免疫组化染色。结果显示敲除组小鼠胼胝体上方大脑皮质NeuN阳性细胞数量明显减少(图 4)。
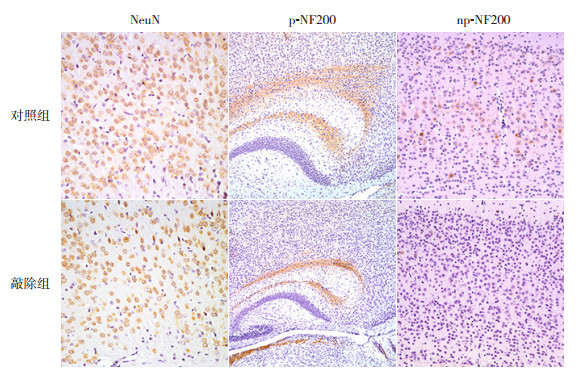
|
图 4 P14 d小鼠神经元和轴突发育标记物检测 小鼠大脑皮质NeuN免疫组化染色(×400):敲除组小鼠大脑皮质NeuN阳性表达与对照组相比明显减少,NeuN阳性表达呈棕黄色。小鼠大脑皮质p-NF200免疫组化染色(×100):敲除组小鼠胼胝体上方神经元轴突纤维萎缩、排布稀疏,而对照组神经元轴突纤维排列致密成网,p-NF200定位于神经元轴突,阳性表达呈棕黄色。小鼠大脑皮质np-NF200免疫组化染色(×200):敲除组小鼠大脑皮质神经元胞浆偶见np-NF200蛋白表达,而对照组神经元胞浆np-NF200蛋白表达较敲除组显著增加,np-NF200阳性表达呈棕黄色。 |
神经丝蛋白(neurofilament, NF)是神经元细胞骨架的主要组成部分,主要作用是为轴突提供结构支持和调节轴突直径[11]。磷酸化过程被认为是调节NF从胞质运输并形成轴突的重要步骤[12]。表达定位于神经元轴突的p-NF200的免疫组化染色结果显示,敲除组小鼠存在明显的轴突丢失及p-NF200水平下降。主要定位于神经元胞浆的np-NF200的免疫组化染色结果显示,敲除组小鼠大脑皮质阳性信号相对于对照组显著减少。见图 4。
Western blot结果也显示敲除组NeuN、p-NF200、np-NF200蛋白表达量均较对照组降低(P < 0.05),见图 5、表 2。

|
图 5 Western blot检测P14 d两组小鼠NeuN、p-NF200、np-NF200蛋白表达电泳图 |
| 表 2 两组小鼠NeuN、p-NF200、np-NF200蛋白相对表达水平比较 (n=3,x±s) |
|
|
已知mTOR在哺乳动物中枢神经系统(CNS)中对轴突生长发育起正向调节作用[10]。mTOR含有两种复合体,分别为mTORC1和mTORC2。mTORC1活性的可靠测量方法是检测下游p-S6的表达情况[13]。研究结果发现,与对照组相比,敲除组小鼠中p-S6的阳性表达相对稀疏和减弱(图 6)。Western blot结果也显示,敲除组p-S6蛋白表达量(0.72±0.10)较对照组降低(0.99±0.06,t=4.189,P=0.014,n=3)(图 7)。提示敲除HDAC1&2导致小鼠mTORC1通路处于抑制状态。

|
图 6 P14 d小鼠大脑皮质p-S6表达情况(免疫组化染色,×100) 敲除组小鼠大脑皮质胞浆p-S6表达明显少于对照组,p-S6阳性表达呈棕黄色。 |
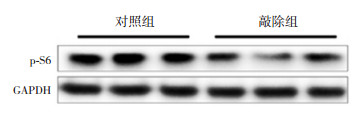
|
图 7 Western blot检测P14 d两组小鼠大脑皮质p-S6表达电泳图 |
研究表明,HDAC1和HDAC2同时缺失会影响不同类型脑细胞的增殖分化和脑组织的正常发育。为避免全部敲除导致的致命性,通常采用条件敲除的方式来研究HDAC1和HDAC2在中枢和外周神经系统发育过程中的作用[14]。Montgomery等[15]使用hGFAP-Cre条件敲除HDAC1&2,缺失HDAC1&2的神经祖细胞无法分化为成熟神经元并死亡,导致大脑皮质无法正常分层,小鼠出生7 d死亡。皮质神经元由两种祖细胞,即径向神经胶质祖细胞(radial glial progenitors, RGPs)和中间祖细胞(intermediate progenitors, IPs)组成。Tang等[4]使用Emx1-Cre在RGPs条件敲除HDAC1&2,小鼠出生不久即死亡;本该迁移到大脑室下区(SVZ)的IPs错误定位到脑室表面并分化为神经元,导致大脑皮质大幅减小且无法正常分层。Hagelkruys等[3]使用Nestin-Cre在神经干细胞中条件敲除HDAC1&2,小鼠胚胎期即死亡,伴有整个脑的体积大幅度缩小和大脑皮质空洞、小脑结构受损。这些研究揭示了HDAC1&2在早期神经细胞中调节细胞分化、定位和促进脑结构形成的作用。但是HDAC1&2对神经元发育的影响尚知之甚少。
本研究通过Synapsin1启动子的Cre重组酶系统建立了在神经元中特异性敲除HDAC1&2的小鼠模型,用于探索HDAC1&2是否参与神经元成熟及轴突形成等过程。相比于其他Cre介导的HDAC1&2缺陷小鼠,Synapsin1-Cre HDAC1&2flox/flox小鼠能够存活较长时间,但通常在1个月内死亡。P11~P13 d开始出现明显的全身震颤,提起尾巴后肢紧抱现象。成熟神经元标记物NeuN蛋白表达量降低,免疫组化结果显示相比对照组,敲除小鼠大脑皮质NeuN+数量有所下降。提示缺失HDAC1&2会导致成熟神经元减少。
神经丝是神经元的主要细胞骨架成分,参与轴突、树突的形成与稳定。未被磷酸化的NF200主要表达于核周胞浆、树突、大的轴突,而磷酸化的NF200主要在神经元轴突中表达。NF200的磷酸化过程也是NF从胞质运输并形成轴突的重要步骤。NF200磷酸化过程异常使神经丝排列紊乱,轴突变性,神经元死亡。本实验中p-NF200及np-NF200表达量均降低,提示缺失HDAC1&2可能影响神经元正常形成细胞骨架,轴突发育不良,进而导致神经元死亡。
通过检测p-S6蛋白水平,Park等[16]发现切除野生型成年小鼠视网膜神经节的轴突会导致mTOR活性被抑制,新蛋白合成受损;而通过敲除mTOR负调控因子PTEN激活该通路可使轴突再生。mTOR还可以通过调节神经元中特定蛋白质的翻译来控制轴突形态形成[9]。因此我们对mTORC1下游的p-S6蛋白水平进行了免疫组化与Western blot检测,发现p-S6表达下降,证明了HDAC1&2敲除鼠的mTOR信号通路被抑制。
综上,我们发现在小鼠神经元中特异性敲除HDAC1&2使小鼠大脑皮质中的mTOR通路被抑制,伴有成熟神经元数量减少,轴突无法正常生长,小鼠死亡的现象,提示HDAC1&2在神经元正常发育与轴突形成过程中发挥重要作用,并推测该过程与mTOR通路有关。以上发现为新生儿脑发育异常的机制提供了参考,可望为临床预防和治疗脑神经发育异常提供更多线索。
| [1] |
Hull EE, Montgomery MR, Leyva KJ. HDAC inhibitors as epigenetic regulators of the immune system: impacts on cancer therapy and inflammatory diseases[J]. Biomed Res Int, 2016, 2016: 8797206. (  0) 0) |
| [2] |
Jaworska J, Ziemka-Nalecz M, Zalewska T. Histone deacetylases 1 and 2 are required for brain development[J]. Int J Dev Biol, 2015, 59(4/6): 171-177. (  0) 0) |
| [3] |
Hagelkruys A, Lagger S, Krahmer J, et al. A single allele of Hdac2 but not Hdac1 is sufficient for normal mouse brain development in the absence of its paralog[J]. Development, 2014, 141(3): 604-616. DOI:10.1242/dev.100487 (  0) 0) |
| [4] |
Tang TX, Zhang YD, Wang YF, et al. HDAC1 and HDAC2 regulate intermediate progenitor positioning to safeguard neocortical development[J]. Neuron, 2019, 101(6): 1117-1133.e5. DOI:10.1016/j.neuron.2019.01.007 (  0) 0) |
| [5] |
Emery B, Lu QR. Transcriptional and epigenetic regulation of oligodendrocyte development and myelination in the central nervous system[J]. Cold Spring Harb Perspect Biol, 2015, 7(9): a020461. DOI:10.1101/cshperspect.a020461 (  0) 0) |
| [6] |
Datta M, Staszewski O, Raschi E, et al. Histone deacetylases 1 and 2 regulate microglia function during development, homeostasis, and neurodegeneration in a context-dependent manner[J]. Immunity, 2018, 48(3): 514-529.e6. DOI:10.1016/j.immuni.2018.02.016 (  0) 0) |
| [7] |
Brügger V, Engler S, Pereira JA, et al. HDAC1/2-dependent P0 expression maintains paranodal and nodal integrity independently of myelin stability through interactions with neurofascins[J]. PLoS Biol, 2015, 13(9): e1002258. DOI:10.1371/journal.pbio.1002258 (  0) 0) |
| [8] |
Trosclair K, Dhaibar HA, Gautier NM, et al. Neuron-specific Kv1.1 deficiency is sufficient to cause epilepsy, premature death, and cardiorespiratory dysregulation[J]. Neurobiol Dis, 2020, 137: 104759. DOI:10.1016/j.nbd.2020.104759 (  0) 0) |
| [9] |
Umegaki Y, Brotons AM, Nakanishi Y, et al. Palladin is a neuron-specific translational target of mTOR signaling that regulates axon morphogenesis[J]. J Neurosci, 2018, 38(21): 4985-4995. DOI:10.1523/JNEUROSCI.2370-17.2018 (  0) 0) |
| [10] |
Al-Ali H, Ding Y, Slepak T, et al. The mTOR substrate S6 kinase 1(S6K1) is a negative regulator of axon regeneration and a potential drug target for central nervous system injury[J]. J Neurosci, 2017, 37(30): 7079-7095. DOI:10.1523/JNEUROSCI.0931-17.2017 (  0) 0) |
| [11] |
Laser-Azogui A, Kornreich M, Malka-Gibor E, et al. Neurofilament assembly and function during neuronal development[J]. Curr Opin Cell Biol, 2015, 32: 92-101. DOI:10.1016/j.ceb.2015.01.003 (  0) 0) |
| [12] |
Dale JM, Garcia ML. Neurofilament phosphorylation during development and disease: which came first, the phosphorylation or the accumulation?[J]. J Amino Acids, 2012, 2012: 382107. (  0) 0) |
| [13] |
Yuskaitis CJ, Jones BM, Wolfson RL, et al. A mouse model of DEPDC5-related epilepsy: neuronal loss of Depdc5 causes dysplastic and ectopic neurons, increased mTOR signaling, and seizure susceptibility[J]. Neurobiol Dis, 2018, 111: 91-101. DOI:10.1016/j.nbd.2017.12.010 (  0) 0) |
| [14] |
Cho Y, Cavalli V. HDAC signaling in neuronal development and axon regeneration[J]. Curr Opin Neurobiol, 2014, 27: 118-126. (  0) 0) |
| [15] |
Montgomery RL, Hsieh J, Barbosa AC, et al. Histone deacetylases 1 and 2 control the progression of neural precursors to neurons during brain development[J]. Proc Natl Acad Sci U S A, 2009, 106(19): 7876-7881. DOI:10.1073/pnas.0902750106 (  0) 0) |
| [16] |
Park KK, Liu K, Hu Y, et al. Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway[J]. Science, 2008, 322(5903): 963-966. DOI:10.1126/science.1161566 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


