缺氧缺血性脑病(hypoxic-ischemic encephalo-pathy, HIE)是新生儿围生期窒息引起的缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD),常可导致脑白质损伤(white matter damage, WMD)[1]。由于脑完整性破坏,脑信息处理速度减慢[2],往往出现学习能力差、记忆力减退等认知障碍的临床症状,是HIBD的重要临床表现。因此,WMD修复程度是评价HIBD疗效的重要指标。研究发现褪黑素(melatonin, Mel)具有抗炎、抗氧化的作用[3],且可促进未成熟脑白质的修复[4],从而减轻WMD,但不同Mel治疗方案对受损脑白质保护作用的差别尚有待于进一步研究[5]。本项目组前期研究发现Mel可促进HIBD新生大鼠脑内神经干细胞的增殖[6],7日连续治疗(7-day continuous treatment, 7DCT)方案优于单次即刻治疗(single- dose immediate treatment, SDIT),但增殖的神经干细胞能否修复WMD,以及不同Mel治疗方案对WMD的作用差别均尚不清楚。因此,本研究采用免疫荧光染色结合行为学实验法检测SDIT与7DCT两种不同Mel治疗方案对HIBD大鼠WMD的影响,以期为Mel治疗方案的选择提供科学依据。
1 材料与方法 1.1 实验动物及分组SPF级7日龄Sprague-Dawley新生大鼠32只[SCXK(鲁)20190003,山东省济南朋悦实验动物繁育有限公司],雌雄不限,平均体重(11.8±1.5)g,采用随机数字表法分为假手术组、HIBD组、SDIT组及7DCT组(n=8)。HIBD后21 d,各组大鼠行Morris水迷宫测试,HIBD后70 d,分别采用神经元核抗原(NeuN)免疫荧光染色法鉴定HIBD模型,并观察Mel治疗对新生大鼠远期脑损伤的影响,碱性髓鞘蛋白(MBP)/神经丝蛋白重链(NF200)免疫荧光双标法观察Mel治疗对大鼠远期WMD的影响。
1.2 HIBD模型的建立及各组处理HIBD组、SDIT组及7DCT组大鼠据经典的Rice-Vannucci法制作HIBD模型[7]。吸入乙醚麻醉,剪开颈部正中皮肤,分离右侧颈总动脉,电凝笔(RS-300,Roboz公司,美国)电凝,消毒并缝合皮肤,置于低氧舱(DYC-Ⅰ,武汉七0一研究所)内连续缺氧(氧舱浓度8%±0.01%)2 h后,放回母鼠笼中喂养。假手术组大鼠仅分离右侧颈总动脉,不予电凝及缺氧处理。SDIT组于造模后30 min内腹腔注射1次Mel,5 mg/kg(美国Sigma公司);7DCT组于造模后30 min内腹腔注射Mel,注射7 d,每次5 mg/kg,每天1次。HIBD组与假手术组于造模后30 min内,腹腔注射等量生理盐水。
1.3 Morris水迷宫测试HIBD后21 d,选用水迷宫大鼠通用型圆桶(深圳市瑞沃德生命科技有限公司),水池直径100 cm,高40 cm。适应阶段,将大鼠置于无平台的装置中,使其自由运动1 min。测试阶段于第三象限正中放置直径8 cm,高23 cm的平台,没入水下2 cm。将大鼠面朝固定位置的桶壁放入平台对侧的象限中,大鼠找到并爬上平台后实验结束,检测时间为60 s。若在规定60 s内大鼠未找到平台,则将大鼠引导到平台上并停留15 s,同时记录该大鼠的逃避潜伏期为60 s。每天每只大鼠测试4次,每次间隔时间1 min,记录大鼠逃避潜伏期时间,连续测试5 d。
1.4 标本的收集HIBD后70 d,10%水合氯醛麻醉,常规心脏灌注后取脑组织,4%多聚甲醛固定24 h,梯度乙醇脱水、二甲苯透明,浸蜡、石蜡包埋,分别取侧脑室至海马层面脑组织行冠状位连续切片,厚度为4 μm,每4~5张脑片取1张,分别行NeuN免疫荧光及MBP/NF200免疫荧光双标染色。
1.5 NeuN免疫荧光染色各组每只大鼠分别取脑组织石蜡切片5~6张,梯度乙醇进行脱蜡至水,采用水浴热修复法进行抗原修复,血清封闭后,弃掉封闭液,加入小鼠抗大鼠NeuN一抗(1 : 100,Chemicon,美国)混合液,4℃冰箱孵育过夜。次日,充分洗涤后,加入Alexa Fluor 594标记的山羊抗小鼠荧光二抗(1 : 100,北京中杉金桥生物技术有限公司),37℃避光孵育1 h后,0.01 mol/L PBS冲洗,含6-二脒基-2-苯基吲哚(DAPI)的荧光封片剂(F6057,Sigma,美国)封片。每张切片随机取5个视野,正置荧光显微镜下观察、拍照,并计数大脑皮质及海马CA1区NeuN+细胞数。
1.6 MBP/NF200免疫荧光双标染色各组每只大鼠分别取脑组织石蜡切片5~6张,同1.5方法处理切片,水浴热修复法修复抗原,37℃血清封闭后,加入小鼠抗大鼠NF200(1 : 500,Cell Signaling Technology,美国)与兔抗大鼠MBP(1 : 75,武汉博士德)一抗混合液,4℃冰箱孵育过夜。次日,充分洗涤后,滴加Alexa Fluor 488标记的山羊抗兔IgG(1 : 100)和山羊抗小鼠IgG(1 : 100)荧光二抗(北京中杉金桥生物技术有限公司)混合液,37℃避光孵育1 h后冲洗,含DAPI荧光封片剂封片。每张切片随机取5个视野,正置荧光显微镜下拍照,并采用Image J软件分析脑组织纹状体区、胼胝体区荧光强度(fluorescense intensity, FI),即FIMBP、FINF200。
1.7 统计学分析采用SPSS 22.0统计学软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组新生大鼠Morris水迷宫测试结果HIBD后21 d,Morris水迷宫测试结果显示各组大鼠逃避潜伏期比较差异有统计学意义(F=97.29,P < 0.001,n=8)。HIBD组大鼠逃避潜伏期[(43.2±3.5)s]较假手术组[(21.3± 2.1)s]显著延长(P < 0.05)。SDIT组[(31.4±2.8)s]和7DCT组[(25.3±2.4)s]大鼠逃避潜伏期均较HIBD组显著缩短(P < 0.05),但仍长于假手术组(P < 0.05);且7DCT组逃避潜伏期短于SDIT组(P < 0.05)。见图 1。
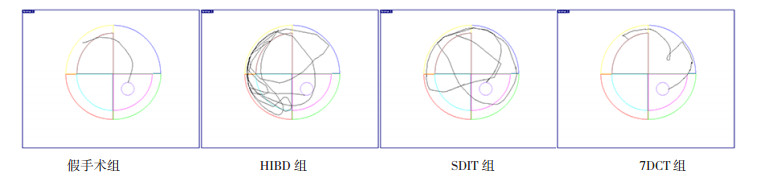
|
图 1 不同褪黑素治疗方案对HIBD新生大鼠Morris水迷宫测试的影响 假手术组大鼠水中活动路径最短最简单,HIBD组大鼠水中活动路径最长最复杂,SDIT组大鼠水中活动路径较长较复杂,7DCT组大鼠水中活动路径较短较简单。 |
NeuN是成熟神经元的标记物,新生大鼠HIBD后,大脑皮质与海马CA1区是神经元易受损伤的脑区。本研究分别观察HIBD后,各组大鼠大脑皮质及海马CA1区NeuN+细胞数的变化。HIBD后70 d(生后77 d),假手术组大鼠大脑皮质及海马CA1区均可见大量NeuN+细胞,细胞分布均匀,排列整齐;HIBD组新生大鼠NeuN+细胞数较假手术组显著减少(P < 0.05),细胞排列不整齐;SDIT组与7DCT组均可见NeuN+细胞多于HIBD组,但仍少于假手术组(P < 0.05);且7DCT组NeuN+细胞数显著多于SDIT组(P < 0.05)。见图 2、表 1。
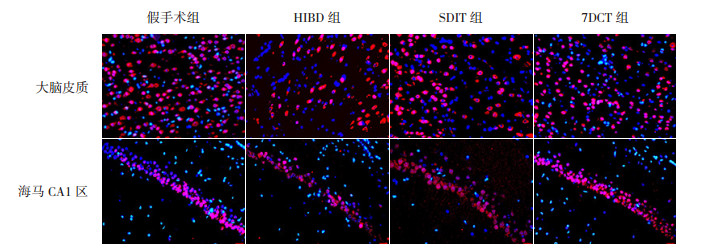
|
图 2 不同褪黑素治疗方案对HIBD新生大鼠NeuN+细胞的影响(免疫荧光染色,×400) NeuN是成熟神经元的标记物,NeuN+细胞核染为红色,DAPI+细胞核染为蓝色。假手术组大脑皮质及海马CA1区均可见大量NeuN+细胞;HIBD组NeuN+细胞明显少于假手术组;SDIT组及7DCT组NeuN+细胞均多于HIBD组,但仍少于假手术组;且7DCT组NeuN+细胞多于SDIT组。 |
| 表 1 各组大鼠大脑皮质及海马CA1区NeuN+细胞数比较 (个/mm2,n=8) |
|
|
MBP包绕在NF200周围构成有髓神经纤维,本研究观察各组大鼠大脑纹状体与胼胝体区MBP及NF200蛋白表达的变化。MBP染为绿色荧光,包绕在NF200(染为红色荧光)的周围。
HIBD后70 d,假手术组大鼠大脑纹状体区可见大量MBP及NF200蛋白表达;与假手术组相比,HIBD组大鼠大脑纹状体区FIMBP、FINF200均降低(P < 0.05);SDIT组和7DCT组大鼠大脑纹状体区FIMBP、FINF200显著高于HIBD组(P < 0.05),但仍低于假手术组(P < 0.05);且7DCT组FIMBP、FINF200显著高于SDIT组(P < 0.05)。见图 3、表 2。
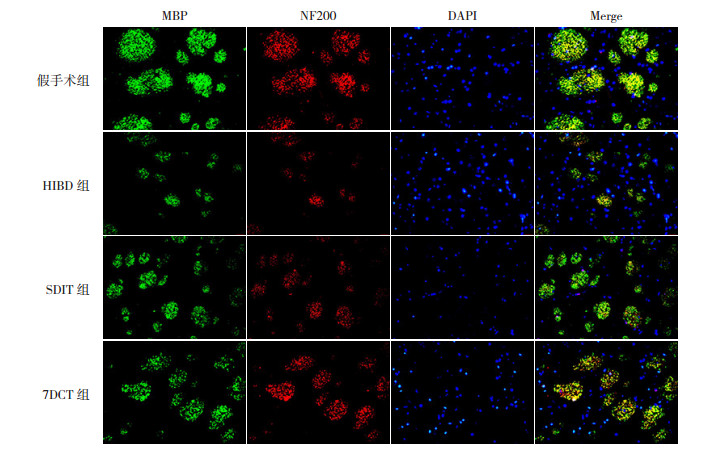
|
图 3 不同褪黑素治疗方案对HIBD新生大鼠大脑纹状体区髓鞘及轴突损伤的影响(MBP/NF200免疫荧光双标染色,×400) MBP标记髓鞘,染为绿色;NF200标记神经纤维丝蛋白,染为红色;DAPI标记细胞核,染为蓝色;MBP+NF200+标记神经纤维束。假手术组可见大量髓鞘蛋白及神经纤维丝蛋白表达,神经纤维束完整;HIBD组仅见少量髓鞘蛋白及神经纤维丝蛋白表达,神经纤维束不完整;SDIT组和7DCT组可见较多髓鞘蛋白及神经纤维丝蛋白表达,且7DCT组神经纤维束较SDIT组更完整。 |
| 表 2 各组大鼠大脑纹状体区FIMBP及FINF200比较 (x±s,n=8) |
|
|
HIBD后70 d,假手术组大鼠大脑胼胝体区可见大量MBP及NF200蛋白表达;与假手术组相比,HIBD组和SDIT组大鼠大脑胼胝体区FIMBP、FINF200均降低(P < 0.05),但HIBD组和SDIT组大鼠大脑胼胝体区FIMBP、FINF200比较差异无统计学意义(P > 0.05);7DCT组大鼠大脑胼胝体区FIMBP、FINF200显著高于SDIT组和HIBD组,但仍低于假手术组(P < 0.05)。见图 4、表 3。
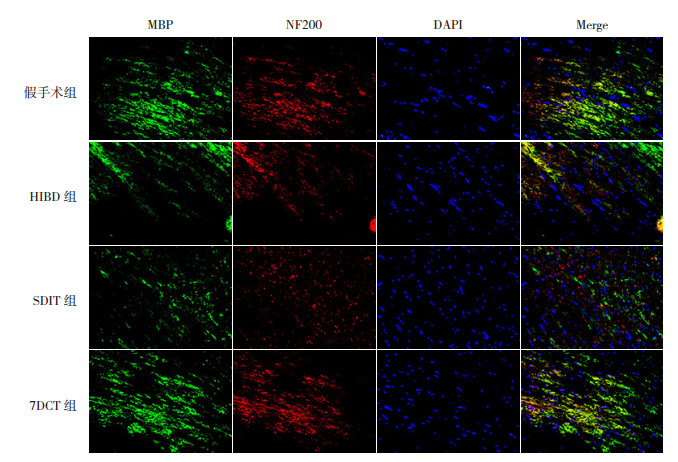
|
图 4 不同褪黑素治疗方案对HIBD新生大鼠大脑胼胝体区髓鞘及轴突损伤的影响(MBP/NF200免疫荧光双标染色,×400) MBP标记髓鞘,染为绿色;NF200标记神经纤维丝蛋白,染为红色;DAPI标记细胞核,染为蓝色;MBP+NF200+标记神经纤维束。假手术组可见大量髓鞘蛋白及神经纤维丝蛋白表达,神经纤维束完整;HIBD组和SDIT组均可见少量髓鞘蛋白及神经纤维丝蛋白表达,神经纤维束不完整;7DCT组可见较多髓鞘蛋白及神经纤维丝蛋白表达,神经纤维束较HIBD组及SDIT组更完整。 |
| 表 3 各组大鼠大脑胼胝体区FIMBP及FINF200比较 (x±s,n=8) |
|
|
围生期窒息可导致癫痫、脑瘫等后遗症,发病症状与WMD密切相关。鉴于新生儿具有较强的再生能力与神经修复潜能,如果早期给予干预治疗可减轻WMD。本课题组前期研究发现Mel的7DCT方案可更易促进脑内源性神经干细胞的增殖,研究还发现Mel可改善脑内微环境,减轻WMD[8],但不同治疗方案对HIBD新生大鼠WMD的影响尚未见报道,本课题组就此科学问题展开研究,以期为较优Mel治疗方案的选择提供科学依据。
NeuN是成熟神经元的常用标记物,本研究采用NeuN免疫荧光染色法分别观察各组大鼠大脑皮质与海马CA1区神经元的变化,结果发现HIBD组神经元数少于假手术组,提示造模成功,这与文献报道一致[9]。SDIT组和7DCT组新生大鼠成熟神经元数多于HIBD组,且7DCT组阳性细胞数多于SDIT组,提示本研究Mel治疗HIBD有效,且7DCT治疗方案的疗效优于SDIT。
行为学检测可反映动物运动机能和精神状态,是观察治疗后WMD修复的可靠手段。Morris测试结果显示,SDIT组和7DCT组大鼠平均逃避潜伏期时间均短于HIBD组,且7DCT组平均逃避潜伏期时间短于SDIT组,提示两种Mel治疗方案均可从行为学水平改善大鼠空间记忆能力,且7DCT组更优,其机制可能与7DCT更易减轻HIBD后脑白质区髓鞘和神经纤维束损伤,有助于改善大鼠运动和空间记忆能力有关[10],但7DCT如何减轻HIBD新生大鼠脑白质区髓鞘和神经纤维束的损伤尚不清楚,Mel减轻WMD是否与其促进HIBD新生大鼠内源性神经再生有关尚不清楚,而不同Mel治疗方案对HIBD新生大鼠远期行为学的影响尚有待更多行为学实验验证。
脑白质是大脑发挥高级功能的重要部位。神经冲动沿有髓神经纤维跳跃传导是大脑处理外界信息的重要保障。神经信号的传导速度与神经轴突及其周围的髓鞘密切相关。HIE发生后,脑白质脱髓鞘致使神经传导受累,损害机体行为认知功能[11]。MBP是髓鞘的标记物,NF200为神经丝蛋白的标记物,本实验于HIBD后70 d行MBP/NF200免疫荧光双重染色,以观察不同Mel治疗方案对大鼠大脑纹状体区及胼胝体区有髓神经纤维束的保护作用。结果显示,SDIT和7DCT组大鼠大脑纹状体区FIMBP、FINF200高于HIBD组,且7DCT组高于SDIT组,提示SDIT与7DCT两种Mel治疗方案均可减轻大脑纹状体区神经纤维束损伤,7DCT方案疗效较优。7DCT组大鼠大脑胼胝体区FIMBP、FINF200高于HIBD组,而SDIT组大鼠大脑胼胝体区FIMBP、FINF200与HIBD组无差别,提示7DCT治疗方案可减轻大鼠大脑胼胝体区神经纤维束损伤,且疗效优于SDIT。
综上,两种Mel治疗方案均可减轻新生大鼠HIBD后WMD,并改善大鼠运动和空间记忆能力,且7DCT治疗方案疗效较优。
| [1] |
Janowska J, Sypecka J. Therapeutic strategies for leukodystrophic disorders resulting from perinatal asphyxia: focus on myelinating oligodendrocytes[J]. Mol Neurobiol, 2018, 55(5): 4388-4402. (  0) 0) |
| [2] |
Gosar D, Tretnjak V, Bregant T, et al. Reduced white-matter integrity and lower speed of information processing in adolescents with mild and moderate neonatal hypoxic-ischaemic encephalopathy[J]. Eur J Paediatr Neurol, 2020, 28: 205-213. DOI:10.1016/j.ejpn.2020.06.003 (  0) 0) |
| [3] |
Robertson NJ, Faulkner S, Fleiss B, et al. Melatonin augments hypothermic neuroprotection in a perinatal asphyxia model[J]. Brain, 2013, 136(Pt 1): 90-105. (  0) 0) |
| [4] |
Olivier P, Fontaine RH, Loron G, et al. Melatonin promotes oligodendroglial maturation of injured white matter in neonatal rats[J]. PLoS One, 2009, 4(9): e7128. DOI:10.1371/journal.pone.0007128 (  0) 0) |
| [5] |
贾天明, 刘帅, 杜开先, 等. 褪黑素对缺氧缺血所致的未成熟脑白质损伤大鼠的干预作用[J]. 中华实用儿科临床杂志, 2015, 30(8): 619-622. (  0) 0) |
| [6] |
陈伟, 陈岚芬, 张梦蓓, 等. 不同褪黑素治疗方案对缺氧缺血性脑损伤新生大鼠内源性神经干细胞增殖的影响[J]. 中国当代儿科杂志, 2019, 21(8): 830-835. (  0) 0) |
| [7] |
Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. DOI:10.1002/ana.410090206 (  0) 0) |
| [8] |
Zhao YS, Wang HY, Chen W, et al. Melatonin attenuates white matter damage after focal brain ischemia in rats by regulating the TLR4/NF-κB pathway[J]. Brain Res Bull, 2019, 150: 168-178. DOI:10.1016/j.brainresbull.2019.05.019 (  0) 0) |
| [9] |
闫少珍, 王晓莉, 王海宇, 等. 脐血单个核细胞侧脑室移植对HIBD新生大鼠脑神经元凋亡及Bax、Bcl-2蛋白的影响[J]. 中国当代儿科杂志, 2016, 18(9): 862-866. (  0) 0) |
| [10] |
王晓莉, 杨于嘉, 王庆红, 等. 不同时间窗高压氧治疗对HIBD新生大鼠脑白质损伤的影响[J]. 中国当代儿科杂志, 2007, 9(4): 308-312. (  0) 0) |
| [11] |
Zhang J, Yang C, Chen J, et al. Umbilical cord mesenchymal stem cells and umbilical cord blood mononuclear cells improve neonatal rat memory after hypoxia-ischemia[J]. Behav Brain Res, 2019, 362: 56-63. DOI:10.1016/j.bbr.2019.01.012 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


