热性惊厥(febrile seizure, FS)是儿童时期最常见的危急重症之一,我国患病率为3%~5%[1],且呈逐年递增趋势。FS为一次热程中(肛温 > 38.5℃,腋温≥38℃)出现的惊厥发作,并且要排除中枢神经系统感染、外伤或遗传代谢类疾病等其他导致惊厥的原因,既往没有无热惊厥史[2]。首次FS后,约35%患儿会复发,其中约50%患儿会有1次以上的多次发作[3]。研究表明,绝大多数FS患儿远期预后良好,但是反复发作FS的患儿,更容易出现无热惊厥,甚至继发癫痫[1, 4]。
海马结构是大脑边缘系统的重要结构之一,与机体的神经活动有着密切的关系。研究表明,FS、尤其是FS持续状态是引起海马损伤的重要因素之一[5]。Shinnar等[6]针对FS患儿进行病例对照研究,结果表明在FS持续状态后的急性期(72 h)内,约有1/10的患儿一侧海马发生急性损伤,而单纯FS组无此表现。既往研究多针对颞叶癫痫或惊厥持续状态(CSE)进行海马体积(hippocampal volume, HCV)的随访,结果发现颞叶癫痫患儿HCV比正常儿童小[7],约20%~30%患儿CSE后1个月、6个月及12个月的HCV呈减小趋势[8]。但目前缺乏FS患儿HCV的大样本随访研究,因此,本研究旨在分析反复发作FS患儿HCV的变化趋势,探究HCV变化与FS患儿预后的关系。
1 资料与方法 1.1 研究对象及分组选择2013年1月1日至2019年9月30日中国医科大学附属盛京医院小儿神经内科病房收治的FS反复发作、期间完善2次头部及海马磁共振(MRI)平扫的患儿共34例。诊断标准符合《热性惊厥诊断治疗与管理专家共识(2017实用版)》[1]。CSE及癫痫的诊断标准符合癫痫最新临床诊疗指南[9-10]。
根据随访时间的先后顺序,分为第1次随访组和第2次随访组。根据患儿在疾病过程中是否有CSE,分为CSE组及非惊厥持续状态(NCSE)组。根据患儿在随访期间的不同预后结果,分为FS组、无热惊厥组和癫痫组。无热惊厥组即纳入随访过程中出现无热惊厥,经脑电图检查未确诊癫痫的患儿。本研究通过我院医学伦理委员会批准(2020PS111K)。
1.2 标本采集头部及海马MRI均于患儿因惊厥发作入院后72 h内完成,扫描仪器为3.0 T MR扫描仪(Philips Intera Achieva),SENSE头线圈,重复时间/恢复时间=3 000/80 ms,体素20 mm×10 mm×10 mm,层厚3.0 mm,无间隔。
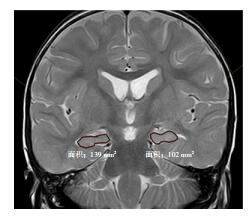
1.3 HCV的测量应用本院影像诊断PACS系统自带软件,在T2WI序列冠状位上进行HCV测量。通过人工分割法划分海马边界,由PACS系统自动计算各层面积,乘以层厚即可得该层HCV,见图 1。为消除颅腔体积对HCV的影响,将实际测量所得的HCV,通过校正公式计算出标准化HCV[11]。HCV校正公式:Vs=Ve×Mm/Me,其中Vs为标准化后的HCV(单位:cm3),Ve为HCV测量值(单位:cm3),Mm为68例次患儿的平均颅腔体积(单位:cm3),Me为该受试者的颅腔体积(单位:cm3)。颅腔体积Me=a×b×c,其中a为前后径(单位:cm),b为上下径(单位:cm),c为左右径(单位:cm)。部分层面解剖位置不易辨认时,可以结合其他2个方位图获得信息[11]。本研究所采用的HCV测量方法和边界划分,参照以往文献中HCV测量所用方法[11-12]。为了降低主观因素所造成的误差,所有数据均由同一个影像学小组进行测量,成员包括影像住院医师、主治医师和副教授各1名组成,测量3次取平均值。
|
图 1 人工分割法在PACS系统中测量海马面积 在冠状位T2WI序列中,左侧海马面积为102 mm2,右侧海马面积为139 mm2。 |
为探究HCV变化程度及相关影响因素,引入参数:HCV平均每年增大值(△V)。设定△V=(Vs2-Vs1)/ T,其中△V为同一患儿平均每年HCV的增大值(单位:cm3/年),Vs2为第2次随访时标准化HCV(单位:cm3),Vs1为第1次随访时标准化HCV(单位:cm3),T为2次随访的间隔时间(单位:年)。
1.5 统计学分析应用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用两样本t检验或配对t检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验,多组间比较用Kruskal-Wallis H检验。分析HCV变化的相关性因素时采用Spearman秩相关检验。计数资料以率(%)表示,率的比较采用Fisher确切概率法。P < 0.05为差异有统计学意义。
2 结果 2.1 一般临床资料34例患儿的平均发病年龄为1.5岁,男性23例(68%),男女比为2.1 : 1。18例(53%)患儿有惊厥家族史,19例(56%)在疾病过程中出现CSE,25例(74%)发生过复杂性FS,22例(65%)发作频率≤3次/年。5例(15%)发展为癫痫,7例(21%)发展为无热惊厥。第1次随访组患儿的年龄为2.3(1.6,3.9)岁,第2次随访组患儿的年龄为3.0(2.2,5.3)岁,2次随访间隔时长1.0(0.6,1.5)年。患儿一般临床资料特点见表 1。
| 表 1 反复发作FS患儿的一般临床资料(n=34) |
|
|
34例患儿,第2次随访时总HCV为(4.5±0.9)cm3,大于第1次随访时的总HCV [(3.7±0.9)cm3],差异有统计学意义(t=-9.837,P < 0.001)。Spearman秩相关检验结果显示总HCV与年龄呈正相关(rs=0.683,P < 0.001)。学龄前患儿(年龄≥3岁)第1次随访、第2次随访时总HCV、左侧HCV、右侧HCV均大于婴幼儿(年龄 < 3岁),差异有统计学意义(P < 0.01)。见表 2。
| 表 2 婴幼儿及学龄前反复发作FS患儿2次随访HCV结果比较(cm3) |
|
|
左侧△V为0.36(0.23,0.51)cm3/年,右侧△V为0.40(0.27,0.64)cm3/年,差异无统计学意义(P > 0.05)。总△V为0.75(0.50,1.17)cm3/年。CSE组的总△V、左侧△V、右侧△V均小于NCSE组,差异有统计学意义(P < 0.05)。FS组、无热惊厥组及癫痫组3组间总△V、左侧△V、右侧△V差异无统计学意义(P > 0.05)。见表 3~6。
| 表 3 NCSE组与CSE组患儿一般临床资料的比较[例(%)] |
|
|
| 表 4 NCSE组与CSE组患儿△V比较[M(P25,P75),cm3/年] |
|
|
| 表 5 FS组、无热惊厥组及癫痫组患儿一般临床资料的比较[例(%)] |
|
|
| 表 6 FS组、无热惊厥组及癫痫组患儿△V比较[M(P25,P75),cm3/年] |
|
|
FS是婴幼儿时期常见的惊厥类疾病之一,其临床表现为突然的意识丧失,多数伴有眼球上翻、凝视或斜视,面肌或四肢强直阵挛或阵挛性发作,数秒或数分钟缓解,严重者惊厥可反复发作,甚至出现CSE。一般来说,男性较女性更易发生FS,且通常伴有FS家族史[13]。本研究中共纳入34例患儿,其中男性68%,53%患儿有惊厥家族史,与其他学者研究结果大致相同[13-14]。
Obenaus等[15]研究发现,对照组6名14~60月龄的患脊髓肿瘤、结节性硬化等不影响颅内结构疾病的儿童HCV随着年龄增长而增大,且左右侧HCV之间无显著差异。Zhang等[7]也得出同一结论,且发现HCV与性别无关。本研究中将总HCV与年龄进行相关性分析发现,FS患儿总HCV与年龄呈正相关,两个随访组中,学龄前患儿左右侧HCV比婴幼儿患儿的大,也进一步证实HCV随着年龄增长而增大,与既往文献报道一致[15]。但HCV的增长变化曲线与儿童生长发育曲线是否匹配?增长速率是否逐渐减小?仍需要纳入更多年龄段的FS患儿及正常儿童的HCV进行对比分析,才能进一步得出结论。
既往研究表明,CSE是海马硬化的危险因素之一,CSE时间长的患者,海马萎缩程度增加[16]。本研究中34例患儿的HCV与自身比较均增大,在数值上未体现出萎缩,在年龄、性别、家族史、复杂性FS史等因素无差异的前提下,CSE患儿△V小于NCSE患儿,差异有统计学意义,证明CSE患儿HCV增长缓慢,即CSE会损害FS患儿的海马发育。
FS继发癫痫的主要危险因素包括:(1)神经系统发育异常;(2)一级亲属有特发性或遗传性癫痫病史;(3)复杂性FS。具备的危险因素越多,继发癫痫的风险越高[1, 17-18]。另外,惊厥发作前发热时间短、FS次数多也与继发癫痫有关[19]。本研究中,5例(15%)患儿目前已诊断为癫痫,另有7例(21%)患儿有无热抽搐表现。不同预后的3组患儿在家族史、复杂性FS史及发作频率等因素上,均未见显著差异,可能与入组病例少、随访时间短,症状尚未显露完全,癫痫不能得到及时诊断有关。从发病机制上分析,FS发作时,大脑对氧和葡萄糖的需求急剧增加,在惊厥发生前期脑血流增快以满足大脑的高代谢需要,而惊厥发生后期,由于颅内压的增高,脑血流迅速减少,导致脑缺氧和毒性代谢产物堆积,从而引起以边缘系统为主,尤其是海马结构的脑损伤。神经细胞兴奋性中毒、能量耗竭、大量的自由基产生,导致细胞凋亡,进而出现海马萎缩、硬化,从而形成致痫[20]。
综上所述,在一定年龄范围内,FS患儿的HCV随着年龄的增长而增大,伴CSE患儿HCV增长程度减小,提示CSE损伤海马发育。在疾病进展过程中可出现不同程度的海马损伤,甚至海马硬化,部分患儿可出现无热抽搐,甚至继发癫痫。影响患儿预后结局的因素很多,临床中需要注意患儿发病年龄、家族史、CSE时间长、发作频率等,从而进行早期干预,避免反复发作造成的神经细胞的破坏,遗留认知功能障碍等神经系统后遗症。本研究病例数目较少,随访时间短,且缺乏正常儿童作为对照组,故仍需要更多的临床资料,对FS疾病进展过程中海马结构的改变进行更深一步的研究。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
中华医学会儿科学分会神经学组. 热性惊厥诊断治疗与管理专家共识(2017实用版)[J]. 中华实用儿科临床杂志, 2017, 32(18): 1379-1382. DOI:10.3760/cma.j.issn.2095-428X.2017.18.005 (  0) 0) |
| [2] |
王卫平, 孙锟, 常立文. 儿科学[M]. 北京: 人民卫生出版社, 2018: 376-377.
(  0) 0) |
| [3] |
Yau MM, Hon KL, Cheng CF. Febrile seizures in children: a condensed update[J]. Hong Kong Med J, 2019, 25(6): 499-500. DOI:10.12809/hkmj198189 (  0) 0) |
| [4] |
Chung S. Febrile seizures[J]. Korean J Pediatr, 2014, 57(9): 384-395. DOI:10.3345/kjp.2014.57.9.384 (  0) 0) |
| [5] |
Hesdorffer DC, Shinnar S, Lewis DV, et al. Risk factors for febrile status epilepticus: a case-control study[J]. J Pediatr, 2013, 163(4): 1147-1151. DOI:10.1016/j.jpeds.2013.05.038 (  0) 0) |
| [6] |
Shinnar S, Bello JA, Chan S, et al. MRI abnormalities following febrile status epilepticus in children: the FEBSTAT study[J]. Neurology, 2012, 79(9): 871-877. DOI:10.1212/WNL.0b013e318266fcc5 (  0) 0) |
| [7] |
Zhang YZ, Li WH, Gao Y, et al. Hippocampal volume in children with temporal lobe epilepsy compared to healthy children: a magnetic resonance imaging study[J]. Neurol India, 2012, 60(1): 29-35. DOI:10.4103/0028-3886.93585 (  0) 0) |
| [8] |
Scott RC, King MD, Gadian DG, et al. Hippocampal abnormalities after prolonged febrile convulsion: a longitudinal MRI study[J]. Brain, 2003, 126(Pt 11): 2551-2557. (  0) 0) |
| [9] |
Scheffer IE, Berkovic S, Capovilla G, et al. ILAE classification of the epilepsies: position paper of the ILAE commission for classification and terminology[J]. Epilepsia, 2017, 58(4): 512-521. DOI:10.1111/epi.13709 (  0) 0) |
| [10] |
Fisher RS, Cross JH, D'Souza C, et al. Instruction manual for the ILAE 2017 operational classification of seizure types[J]. Epilepsia, 2017, 58(4): 531-542. DOI:10.1111/epi.13671 (  0) 0) |
| [11] |
黄蓉, 王华斌, 葛卫卫, 等. 海马萎缩的磁共振定量分析在痴呆与轻度认知损害之间的价值[J]. 中国CT和MRI杂志, 2018, 16(10): 31-34. DOI:10.3969/j.issn.1672-5131.2018.10.011 (  0) 0) |
| [12] |
商观锋, 夏文钢, 唐茹庭. 应用3.0T MRI技术对于神经精神疾病患者海马各部体积的测量[J]. 癫癎与神经电生理学杂志, 2017, 26(3): 136-142. (  0) 0) |
| [13] |
Dreier JW, Li J, Sun YL, et al. Evaluation of long-term risk of epilepsy, psychiatric disorders, and mortality among children with recurrent febrile seizures: a national cohort study in Denmark[J]. JAMA Pediatr, 2019, 173(12): 1164-1170. DOI:10.1001/jamapediatrics.2019.3343 (  0) 0) |
| [14] |
孙红匣, 王冬梅. 热性惊厥的研究进展[J]. 包头医学院学报, 2019, 35(11): 127-129. (  0) 0) |
| [15] |
Obenaus A, Yong-Hing CJ, Tong KA, et al. A reliable method for measurement and normalization of pediatric hippocampal volumes[J]. Pediatr Res, 2001, 50(1): 124-132. DOI:10.1203/00006450-200107000-00022 (  0) 0) |
| [16] |
Duarte JTC, Jardim AP, Comper SM, et al. The impact of epilepsy duration in a series of patients with mesial temporal lobe epilepsy due to unilateral hippocampal sclerosis[J]. Epilepsy Res, 2018, 147: 51-57. DOI:10.1016/j.eplepsyres.2018.08.009 (  0) 0) |
| [17] |
Freedman DA, Vidaurre J. Long-term risks of recurrent febrile seizures[J]. Pediatr Neurol Briefs, 2020, 34: 22. DOI:10.15844/pedneurbriefs-34-22 (  0) 0) |
| [18] |
褚境, 刘长云, 成晓蕾, 等. 小儿热性惊厥危险因素及遗传学分析[J]. 潍坊医学院学报, 2020, 42(1): 31-34. (  0) 0) |
| [19] |
Elshana H, Özmen M, Uzunhan TA, et al. A tertiary care center's experience with febrile seizures: evaluation of 632 cases[J]. Minerva Pediatr, 2017, 69(3): 194-199. (  0) 0) |
| [20] |
Walker MC. Hippocampal sclerosis: causes and prevention[J]. Semin Neurol, 2015, 35(3): 193-200. DOI:10.1055/s-0035-1552618 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


