2. 山西医科大学第一医院儿科, 山西太原 030000
惊厥性癫痫持续状态(convulsive status epilepticus, CSE)是较常见的儿童神经系统急症,多见于5岁以下儿童,年发病率约0.01%~0.04%[1]。2015年国际抗癫痫联盟(International League Against Epilepsy, ILAE)将癫痫持续状态(status epilepticus, SE)重新定义为:SE是由于癫痫发作自行终止机制失败或异常持续发作机制启动所致,可以导致长期不良后果,如神经元死亡、神经元损伤及神经元网络异常等[2]。研究证明,早期终止CSE可降低心脏和呼吸并发症的风险,并可降低儿童入住重症监护室及死亡的风险[3-5]。因此迅速控制CSE的惊厥状态是治疗的首要目标。
目前国际上公认的一线抗癫痫药物(anti-epileptic drug, AED)为苯二氮卓类药物,如地西泮、劳拉西泮、咪达唑仑等,主要通过加强中枢神经系统的GABA受体功能起到镇静止痉的作用。但是至少有三分之一的患者对苯二氮卓类药物治疗无效[6]。因此对于苯二氮卓类无效的CSE患者,需要进一步的二线AED治疗。苯妥英(phenytoin, PHT)、丙戊酸(valproate)、左乙拉西坦(levetiracetam, LEV)是较常用的3种二线药物。从上世纪70年代开始,静脉注射PHT逐渐应用于一线AED治疗失败后的二线用药。PHT的镇静作用较地西泮等药物小,研究表明在苯二氮卓类药物治疗之后立即注射PHT可延长其短暂的抗癫痫作用,并降低癫痫复发率[7]。PHT被指南推荐为治疗CSE的首选二线药物[8],但是静脉注射PHT的停药率在50%~96%之间[9],而且存在着心血管损害(低血压和致命性心律失常)及史-约综合征(Stevens-Johnson syndrome)[10-11]等明显不良反应。磷苯妥英(fosphenytoin, FPHT)是苯妥英的前体物质,与PHT相比,FPHT的耐受性好,输注速度快,肌肉吸收能力强,不良反应较PHT小,但同样具有呼吸抑制、心律失常等不良反应。在用药时需减慢输液速率同时进行心电监测,增加了PHT静脉输注的困难[12]。这些不良反应促使人们开始寻找PHT的有效替代药物。
LEV是一种疗效良好且安全性较高的二代AED。LEV的抗癫痫作用机制与其他AED药物不同,它通过与突触小泡蛋白2A(synaptic vesicle protein 2A, SV2A)结合,调节SV2A蛋白的活性而控制癫痫发作;它也可以抑制ryanodine受体和三磷酸肌醇(inositol triphosphate, IP3)受体依赖性内质网的Ca2+释放,并且阻断海马神经元的L型Ca2+通道来抑制Ca2+的内流,从而维持中枢神经系统的Ca2+稳态[13]。LEV与蛋白结合率很低,其代谢不涉及肝脏细胞色素酶系统,而主要经肾脏清除[14-15]。LEV已经被批准用于1个月以上癫痫患者的癫痫部分性发作和6岁以上特发性全身性癫痫患者的强直阵挛发作的辅助治疗[16]。与PHT相比,LEV药物不良反应的发生率和严重程度更低,在儿童主要表现为焦虑、情绪不稳[17]。因此LEV被认为是安全有效的抗癫痫药物,同时也被越来越多地用于SE治疗,在低龄儿童中的使用频率也显著增加[18-20]。
目前已有对于LEV和PHT治疗成人CSE的Meta分析[21],但是缺乏两种药物治疗儿童CSE有效性和安全性的Meta分析。因此,本研究收集了LEV和PHT在治疗儿童CSE的随机对照试验(RCT)并进行Meta分析,比较两种药物在治疗儿童CSE的有效性和安全性,为临床合理用药提供参考。
1 资料与方法 1.1 文献纳入标准纳入标准:(1)研究人群:使用一线AED(如苯二氮卓类药物)后仍有CSE(全身或局部)的患儿,且年龄 < 18岁。CSE定义为癫痫持续时间 > 5 min[2];(2)干预措施:试验组静脉注射LEV,对照组静脉注射PHT(美国为FPHT);(3)结局指标:主要结局指标是CSE控制率,即CSE发作在60 min内停止的比例;次要结局指标是24 h内癫痫复发率、不良事件的发生率、需要进一步AED治疗率;(4)研究设计:RCT。
1.2 文献检索在Web of Science、Cochrane、Embase、PubMed、万方数据、中国知网、中国生物医学文献数据库中进行系统检索,检索时间截至2020年7月。中文检索词为:“惊厥性癫痫持续状态” “苯妥英”“磷苯妥英”“左乙拉西坦”“儿童”“小儿”“随机对照试验”;英文检索词为:“clinical trials, randomized” “convulsive status epilepticus” “fenitoin” “fosphenytoin” “levetiracetam” “child” “children”,并手动检索纳入研究的参考文献。
1.3 文献筛选与质量评价将检出文献导入Endnote软件,两位研究人员基于文献纳入标准独立进行文献筛选。文献筛选流程如图 1所示。两位研究人员意见不一致时征求第三位研究人员的意见。采用Cochrane 5.0系统评价手册对纳入的RCT进行质量评价:(1)是否是随机试验及随机分配的原则,即产生随机序列采取的方法;(2)分配隐藏的具体表现;(3)是否随访及具体情况,基线特征差异有无统计学意义,有无发表偏倚,是否具有合并分析的可能;(4)盲法的实施情况;(5)文献是否报道失访病例情况。
1.4 数据提取采用Endnote软件和Excel办公软件提取研究数据。从纳入的研究中提取以下基线特征:关键性研究特征(如第一作者姓名、出版年份、进行研究的国家/地区、病例数、患儿性别、年龄、初始用药剂量)和定量结果(CSE控制率、24 h内癫痫复发率、不良事件发生率、需进一步AED治疗率)。
1.5 结局指标结局指标包括有效性指标和安全性指标。(1)有效性指标:CSE控制率(主要指标)、24 h内癫痫复发率(次要指标)、需要进一步AED治疗率(次要指标)。(2)安全性指标:不良事件,包括躁动、血压异常、心动过速、皮疹、意识模糊、气道并发症、恶心、呕吐、外渗性损伤等,以及史-约综合征、死亡等严重不良事件。需要进一步AED治疗的标准为:在注射LEV或者PHT后20 min,癫痫活动仍存在,则采取进一步的AED治疗,具体情况由儿科医生评估。
1.6 统计学分析采用RevMan 5.3软件进行Meta分析。采用χ2检验进行异质性分析。若异质性分析显示I2 < 50%且P≥0.10,定义为异质性不明显,使用固定效应模型进行Meta分析;若显示异质性明显(P < 0.10或I2≥50%),使用随机效应模型进行Meta分析。对于纳入的各研究间存在明显异质性者,采用逐一剔除各项研究法进行敏感性分析。本Meta分析提取数据指标为二分类变量,使用相对危险度(RR)及其95% 可信区间(95%CI)作为效应指标。P≤0.05为差异有统计学意义。
2 结果 2.1 文献筛选结果共检索出318篇相关文献,具体筛选流程见图 1。最终有7项RCT(1 434例患儿)[22-28]纳入本研究。所纳入研究的基本情况见表 1。
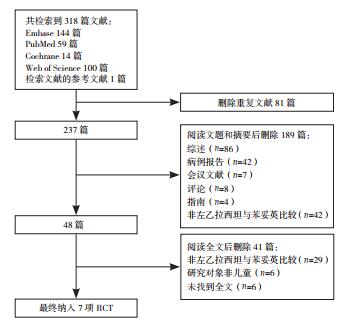
|
图 1 文献筛选流程 |
| 表 1 纳入研究的基本情况 |
|
|
有1篇文献[22]有高度偏倚风险,质量较低;其余6篇文献[23-28]均为低度偏倚风险,质量较高。6篇文献[23-28]明确为单盲研究;2篇文献[22, 26]未说明随机分配的具体方法;1篇文献[22]未明确说明分配隐藏的方法;3篇文献[22, 26-27]结果数据的完整性风险不明确。见图 2和表 2。
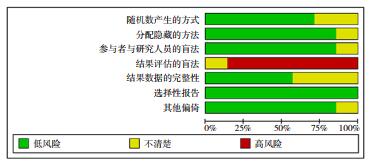
|
图 2 各种风险偏倚比例 |
| 表 2 纳入研究文献风险偏倚情况 |
|
|
纳入的7篇文献[22-28]均报道了CSE发作60 min内停止的比例(CSE的控制率)。各研究间异质性明显(I2=63%,P=0.01),采用随机效应模型进行分析。LEV组CSE的控制率为79.9%(585/732),PHT组为73.4%(517/704),LEV组CSE的控制率显著高于PHT组(RR=1.12,95%CI:1.00~1.24,P=0.05),见图 3。
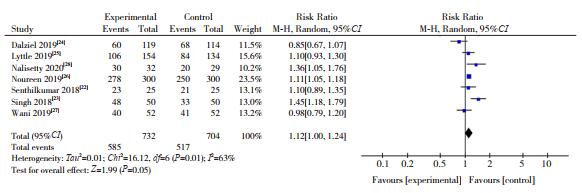
|
图 3 两组对于CSE控制效果对比的Meta分析 |
有4篇文献[22-23, 27-28]报道了两组24 h内癫痫复发率,各研究间异质性明显(I2=67%,P=0.03),采用随机效应模型进行分析。Meta分析显示两组24 h内癫痫复发率差异无统计学意义(RR=0.82,95%CI:0.22~3.11,P > 0.05),见图 4。
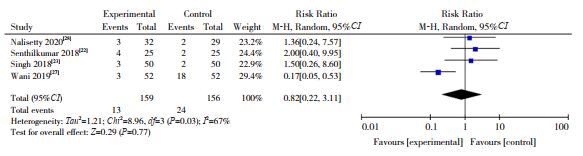
|
图 4 两组24 h内癫痫复发率对比的Meta分析 |
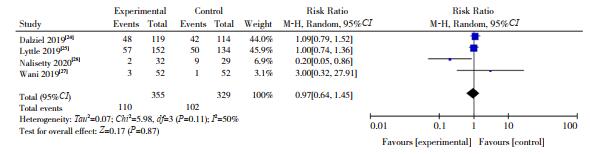
4篇文献[24-25, 27-28]报道了需进一步AED治疗率,各研究间异质性较高(I2=50%,P=0.11),采用随机效应模型进行分析。Meta分析显示两组间需进一步AED治疗率差异无统计学意义(RR=0.97,95%CI:0.64~1.45,P > 0.05),见图 5。
|
图 5 两组需进一步抗癫痫药物治疗率对比的Meta分析 |
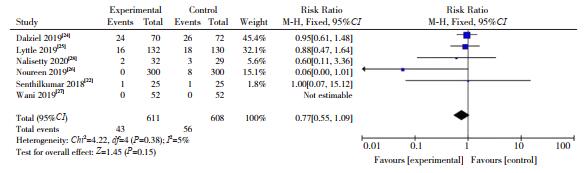
7篇文献[22-28]均报道了不良事件的发生率,各研究间异质性不明显(I2=5%,P=0.38),采用固定效应模型进行分析。Meta分析显示两组间不良事件的发生率差异无统计学意义(RR=0.77,95%CI:0.55~1.09,P > 0.05),见图 6。
|
图 6 两组不良事件发生率对比的Meta分析 |
LEV组和PHT组CSE控制效果存在明显异质性(I2=63%,P=0.01),在依次排除每一篇文献后发现剔除Dalziel等[24]这篇文献后异质性降低最明显,同时研究结果未发生变化,两组间比较差异仍具有统计学意义(RR=1.15,95%CI:1.04~1.27,P < 0.05)。
2.4.2 24 h内癫痫复发率的敏感性分析两组24 h内癫痫复发率结果存在明显异质性(I2=67%,P=0.03),经敏感性分析发现剔除Wani等[27]这篇文献后,异质性为0,研究结果未发生变化,两组间比较差异仍无统计学意义(RR=1.62,95%CI:0.61~4.26,P=0.94)。
3 讨论CSE是最常见的儿童神经系统急症之一,惊厥状态持续超过30 min即可造成不可逆的神经损伤[2]。国际指南推荐PHT或FPHT作为一线AED治疗失败后的首选二线用药[8]。这些建议是基于成人的观察性研究、专家意见提出的[29-31]。二线治疗还包括LEV和丙戊酸。一项关于1~94岁的苯二氮卓类难治性SE患者的前瞻性RCT中,发现FPHT、丙戊酸和LEV对大约一半的苯二氮卓类难治性SE患者是有效的,但是三者在有效性和安全性方面没有显著差异[6]。另一项涉及LEV和PHT的Meta分析结果显示,在年龄大于3个月的CSE人群中,LEV治疗组患者60 min内癫痫发作停止率并不优于PHT治疗组[21]。但是这两个研究都未对儿童患者单独分析,因此缺少两种药物治疗儿童CSE的有效性及安全性等指标的证据。
本研究是关于LEV和PHT作为治疗儿童CSE的二线用药的疗效及安全性的Meta分析。我们从有效性及安全性两方面进行了分析,前者包括两组CSE的控制效果、24 h内癫痫复发率、需进一步AED治疗率,后者包括不良事件发生率。本Meta分析显示,LEV与PHT在治疗CSE患儿的安全性、24 h内癫痫复发率及需要进一步AED治疗率方面没有明显差异,而LEV组CSE的控制率显著高于PHT组(RR=1.12,95%CI:1.00~1.24)。在关于CSE控制率的敏感性分析中,剔除Dalziel等[24]这篇文献后异质性明显降低,但研究结果未发生变化,显示LEV组CSE控制率仍高于PHT组(RR=1.15,95%CI:1.04~1.27),提示该研究结果稳定、可靠。
低血压、心律失常、外渗性损伤等是PHT主要的不良反应[11]。本Meta分析纳入的一项研究中,PHT治疗组出现了2例与治疗相关的严重不良事件,1例表现为严重的低血压,另1例表现为局灶性的癫痫发作和意识下降[25]。另一项研究中,1例出血性脑炎的患者在PHT治疗后27 d死亡,考虑为与药物无关的死亡事件[24]。关于LEV在小儿癫痫患者中的安全性的系统评价中,最常见的不良事件是焦虑情绪[17]。一项研究评估了LEV单药治疗在2岁以下癫痫患儿中的有效性及安全性,结果发现单用LEV对局灶性和全身性癫痫发作均有效,不良反应表现为易怒,未发生血液系统改变或行为异常[32]。临床上,由于PHT潜在的心血管毒性,其剂量增加及输注速度受到限制,而LEV即使在最大剂量,也很少出现不良反应[33]。成年CSE患者的观察性研究表明,接受LEV维持治疗的患者比例远远高于PHT(78% vs 8%)[34]。因此LEV似乎比PHT更可能成为儿童CSE的首选二线用药。
本Meta分析存在一些局限性。第一,纳入的7项研究中,仅4项研究[23-25, 28]报道了随访情况,另外3项研究[22, 26-27]未明确报道;有2项研究[22, 26]未明确报道随机化的具体方法,其中1项[22]未报道分配隐藏的具体方法。因此本Meta分析纳入的数据欠完整。第二,本Meta分析未比较LEV和PHT在病死率方面的差异,原因有三:(1)本Meta分析纳入的一些研究的样本量较小,未报道死亡事件;(2)两种药物导致的死亡事件本身就是罕见事件,发生率较小;(3)受试者在紧急情况下能够及时接受其他治疗,减少了死亡事件的发生。因此,本Meta分析不足以评估病死率,无法排除两种药物潜在的严重危害。第三,由于纳入文献数量限制,本Meta分析未根据年龄、种族、剂量等进行亚组分析;纳入的都是英文文献,缺少中文文献;大部分研究并未具体写明各年龄段患儿药物疗效。因此本Meta分析未能明确以上因素对结果的影响。第四,各研究对于CSE的有效控制标准可能有所差异。癫痫发作停止可以通过脑电图变化、发作频率降低等方面进行评价,但本Meta分析纳入的研究中大部分采用的观察指标是临床发作频率,因此结果具有一定主观性。
综上,本研究表明,基于有限的研究数据,对于一线治疗无效的CSE患儿,LEV控制惊厥发作的效果优于PHT,且不增加不良反应的发生率。然而由于本Meta分析纳入的文献较少,现有的证据仍存在一些局限性,因此仍需要大量多中心、大样本的RCT对两种药物的最佳剂量、安全性、临床预后及联合用药的效果等指标进行验证,以期得到更为可靠的证据指导临床实践。
| [1] |
Trinka E, Cock H, Hesdorffer D, et al. A definition and classification of status epilepticus: Report of the ILAE Task Force on Classification of Status Epilepticus[J]. Epilepsia, 2015, 56(10): 1515-1523. DOI:10.1111/epi.13121 (  0) 0) |
| [2] |
Alldredge BK, Gelb AM, Isaacs SM, et al. A comparison of lorazepam, diazepam, and placebo for the treatment of out-of-hospital status epilepticus[J]. N Engl J Med, 2001, 345(9): 631-637. DOI:10.1056/NEJMoa002141 (  0) 0) |
| [3] |
Silbergleit R, Durkalski V, Lowenstein D, et al. Intramuscular versus intravenous therapy for prehospital status epilepticus[J]. N Engl J Med, 2012, 366(7): 591-600. DOI:10.1056/NEJMoa1107494 (  0) 0) |
| [4] |
Gaínza-Lein M, Sánchez Fernández I, Jackson M, et al. Association of time to treatment with short-term outcomes for pediatric patients with refractory convulsive status epilepticus[J]. JAMA Neurol, 2018, 75(4): 410-418. DOI:10.1001/jamaneurol.2017.4382 (  0) 0) |
| [5] |
Kapur J, Elm J, Chamberlain JM, et al. Randomized trial of three anticonvulsant medications for status epilepticus[J]. N Engl J Med, 2019, 381(22): 2103-2113. DOI:10.1056/NEJMoa1905795 (  0) 0) |
| [6] |
Brophy GM, Bell R, Claassen J, et al. Guidelines for the evaluation and management of status epilepticus[J]. Neurocrit Care, 2012, 17(1): 3-23. DOI:10.1007/s12028-012-9695-z (  0) 0) |
| [7] |
Brigo F, Bragazzi NL, Lattanzi S, et al. A critical appraisal of randomized controlled trials on intravenous phenytoin in convulsive status epilepticus[J]. Eur J Neurol, 2018, 25(3): 451-463. DOI:10.1111/ene.13560 (  0) 0) |
| [8] |
Glauser T, Shinnar S, Gloss D, et al. Evidence-based guideline: treatment of convulsive status epilepticus in children and adults: report of the Guideline Committee of the American Epilepsy Society[J]. Epilepsy Curr, 2016, 16(1): 48-61. DOI:10.5698/1535-7597-16.1.48 (  0) 0) |
| [9] |
Craig S. Phenytoin poisoning[J]. Neurocrit Care, 2005, 3(2): 161-170. DOI:10.1385/NCC:3:2:161 (  0) 0) |
| [10] |
Appleton RE, Gill A. Adverse events associated with intravenous phenytoin in children: a prospective study[J]. Seizure, 2003, 12(6): 369-372. DOI:10.1016/S1059-1311(02)00338-2 (  0) 0) |
| [11] |
Menon R, Radhakrishnan A, Radhakrishnan K. Status epilepticus[J]. J Assoc Physicians India, 2013, 61(8 Suppl): 58-63. (  0) 0) |
| [12] |
Minicucci F, Ferlisi M, Brigo F, et al. Management of status epilepticus in adults. Position paper of the Italian League against Epilepsy[J]. Epilepsy Behav, 2020, 102: 106675. DOI:10.1016/j.yebeh.2019.106675 (  0) 0) |
| [13] |
Nowack A, Malarkey EB, Yao J, et al. Levetiracetam reverses synaptic deficits produced by overexpression of SV2A[J]. PLoS One, 2011, 6(12): e29560. DOI:10.1371/journal.pone.0029560 (  0) 0) |
| [14] |
Walker MC, Patsalos PN. Clinical pharmacokinetics of new antiepileptic drugs[J]. Pharmacol Ther, 1995, 67(3): 351-384. DOI:10.1016/0163-7258(95)00021-6 (  0) 0) |
| [15] |
Weijenberg A, Brouwer OF, Callenbach PM. Levetiracetam monotherapy in children with epilepsy: a systematic review[J]. CNS Drugs, 2015, 29(5): 371-382. DOI:10.1007/s40263-015-0248-9 (  0) 0) |
| [16] |
Cormier J, Chu CJ. Safety and efficacy of levetiracetam for the treatment of partial onset seizures in children from one month of age[J]. Neuropsychiatr Dis Treat, 2013, 9: 295-306. (  0) 0) |
| [17] |
McTague A, Kneen R, Kumar R, et al. Intravenous levetiracetam in acute repetitive seizures and status epilepticus in children: experience from a children's hospital[J]. Seizure, 2012, 21(7): 529-534. DOI:10.1016/j.seizure.2012.05.010 (  0) 0) |
| [18] |
Hsia Y, Neubert A, Sturkenboom MC, et al. Comparison of antiepileptic drug prescribing in children in three European countries[J]. Epilepsia, 2010, 51(5): 789-796. DOI:10.1111/j.1528-1167.2009.02331.x (  0) 0) |
| [19] |
Glauser TA, Ayala R, Elterman RD, et al. Double-blind placebo-controlled trial of adjunctive levetiracetam in pediatric partial seizures[J]. Neurology, 2006, 66(11): 1654-1660. DOI:10.1212/01.wnl.0000217916.00225.3a (  0) 0) |
| [20] |
Legros B, Boon P, De Jonghe P, et al. Opinion of Belgian neurologists on antiepileptic drug treatment in 2006:Belgian study on epilepsy treatment (BESET-2)[J]. Acta Neurol Scand, 2009, 120(6): 402-410. DOI:10.1111/j.1600-0404.2009.01182.x (  0) 0) |
| [21] |
Li LJ, Zhang Y, Jia L, et al. Levetiracetam versus phenytoin for the treatment of established status epilepticus: a systematic review and meta-analysis of randomized controlled trials[J]. Seizure, 2020, 78: 43-48. DOI:10.1016/j.seizure.2020.03.002 (  0) 0) |
| [22] |
Senthil Kumar CS, Selvakumar P, Kowsik M. Randomized controlled trial of levetiracetam versus fosphenytoin for convulsive status epilepticus in children[J]. Pediatr Rev: Int J Pediatr Res, 2018, 5(4): 237-242. DOI:10.17511/ijpr.2018.i04.13 (  0) 0) |
| [23] |
Singh K, Aggarwal A, Faridi MMA, et al. Ⅳ levetiracetam versus Ⅳ phenytoin in childhood seizures: a randomized controlled trial[J]. J Pediatr Neurosci, 2018, 13(2): 158-164. DOI:10.4103/JPN.JPN_126_17 (  0) 0) |
| [24] |
Dalziel SR, Borland ML, Furyk J, et al. Levetiracetam versus phenytoin for second-line treatment of convulsive status epilepticus in children (ConSEPT): an open-label, multicentre, randomised controlled trial[J]. Lancet, 2019, 393(10186): 2135-2145. DOI:10.1016/S0140-6736(19)30722-6 (  0) 0) |
| [25] |
Lyttle MD, Rainford NEA, Gamble C, et al. Levetiracetam versus phenytoin for second-line treatment of paediatric convulsive status epilepticus (EcLiPSE): a multicentre, open-label, randomised trial[J]. Lancet, 2019, 393(10186): 2125-2134. DOI:10.1016/S0140-6736(19)30724-X (  0) 0) |
| [26] |
Noureen N, Khan S, Khursheed A, et al. Clinical efficacy and safety of injectable levetiracetam versus phenytoin as second-line therapy in the management of generalized convulsive status epilepticus in children: an open-label randomized controlled trial[J]. J Clin Neurol, 2019, 15(4): 468-472. DOI:10.3988/jcn.2019.15.4.468 (  0) 0) |
| [27] |
Wani G, Imran A, Dhawan N, et al. Levetiracetam versus phenytoin in children with status epilepticus[J]. J Family Med Prim Care, 2019, 8(10): 3367-3371. DOI:10.4103/jfmpc.jfmpc_750_19 (  0) 0) |
| [28] |
Nalisetty S, Kandasamy S, Sridharan B, et al. Clinical effectiveness of levetiracetam compared to fosphenytoin in the treatment of benzodiazepine refractory convulsive status epilepticus[J]. Indian J Pediatr, 2020, 87(7): 512-519. DOI:10.1007/s12098-020-03221-2 (  0) 0) |
| [29] |
National Institute for Health and Care Excellence. Epilepsies: diagnosis and management[EB/OL]. (2020-02-11)[2020-06-13]. https: //www.nice.org.uk/guidance/cg137.
(  0) 0) |
| [30] |
McTague A, Martland T, Appleton R. Drug management for acute tonic-clonic convulsions including convulsive status epilepticus in children[J]. Cochrane Database Syst Rev, 2018, 1(1): CD001905. (  0) 0) |
| [31] |
Sánchez Fernández I, Abend NS, Agadi S, et al. Gaps and opportunities in refractory status epilepticus research in children: a multi-center approach by the Pediatric Status Epilepticus Research Group (pSERG)[J]. Seizure, 2014, 23(2): 87-97. DOI:10.1016/j.seizure.2013.10.004 (  0) 0) |
| [32] |
Arican P, Gencpinar P, Cavusoglu D, et al. Levetiracetam monotherapy for the treatment of infants with epilepsy[J]. Seizure, 2018, 56: 73-77. DOI:10.1016/j.seizure.2018.02.006 (  0) 0) |
| [33] |
Wright C, Downing J, Mungall D, et al. Clinical pharmacology and pharmacokinetics of levetiracetam[J]. Front Neurol, 2013, 4: 192. (  0) 0) |
| [34] |
Nakamura K, Inokuchi R, Daidoji H, et al. Efficacy of levetiracetam versus fosphenytoin for the recurrence of seizures after status epilepticus[J]. Medicine (Baltimore), 2017, 96(25): e7206. DOI:10.1097/MD.0000000000007206 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


