2. 柳州市妇幼保健院, 广西柳州 545001
肺炎链球菌是儿童最重要的条件致病菌,已成为威胁儿童(尤其5岁以下儿童)健康的最重要公共卫生问题之一[1]。肺炎链球菌主要定植于儿童鼻咽部,但当细菌和宿主因素使它们侵入人体内血流、中耳间隙、脑膜等无菌部位时,便可引起严重的侵入性疾病[2]。既往研究表明,健康儿童鼻咽部肺炎链球菌携带率可达13%~70%[3]。我国是全球肺炎链球菌所致疾病负担最高的国家之一,且我国儿童肺炎链球菌检出率呈逐年上升趋势[4-7]。肺炎链球菌在鼻咽部的定植是肺炎链球菌感染性疾病的先决条件,低龄儿童是肺炎链球菌携带率最高的人群,重点关注高危人群的肺炎链球菌携带情况和影响因素具有重要的公共卫生意义[8]。值得注意的是,目前国内在此方面的研究多围绕儿童个体特征(性别、年龄、地区等)展开影响因素分析,而较少对肺炎链球菌携带的聚集性进行研究。肺炎链球菌具有易于传播的生物学特性,肺炎链球菌是否存在集体水平的聚集现象值得探讨。因此,本研究对广西柳州幼儿园儿童的肺炎链球菌携带情况进行了调查,旨在探讨幼儿园儿童肺炎链球菌携带的聚集性及影响因素,为肺炎链球菌性疾病的预防提供科学依据。
1 资料与方法 1.1 研究对象本研究获广东药科大学伦理委员会(审批号:2019-19)和柳州市妇幼保健院伦理委员会(审批号:2018-084)批准,所有儿童的监护人均签署知情同意书。采用横断面研究设计,于2018年4~6月期间抽取柳州市幼儿园健康儿童作为研究对象。
研究对象纳入标准:≤7岁的健康幼儿园儿童,且家长签署知情同意书。排除标准:调查前14 d内曾经使用过抗生素或患有肺炎、支气管炎等疾病的儿童。通过多阶段分层整群抽样的方法抽取幼儿园儿童:第一阶段,将柳州市5个区按经济条件和地理位置分成市区、郊区两层,然后每层随机抽取1个区;第二阶段,将每个区的全部幼儿园统一编号建立抽样框,采用简单随机抽样方法从每区抽样框中随机抽取3所幼儿园。共抽取6所幼儿园,抽中幼儿园的所有儿童均参与本次调查。
本研究共纳入了1 704名健康儿童,对其家长进行问卷调查,回收有效问卷1 702份,有效率为99.88%。问卷调查内容包括:(1)基本人口学资料(年龄、性别、民族等);(2)疾病史(最近1年儿童的过敏性疾病史,包括湿疹、支气管哮喘和过敏性鼻炎等儿童常见过敏性疾病);(3)用药史(最近1年抗生素使用情况);(4)疫苗接种史(肺炎链球菌疫苗接种史);(5)医院相关暴露因素(最近1年医院/诊所看病情况)。
1.2 标本采集与菌株分离鉴定由统一培训的医务人员对儿童的双侧鼻前庭拭子进行采样,并于采样后2 h内送检。鼻拭子标本经培养后,将形态可疑菌落转移至哥伦比亚血平板上,然后置于35℃ 5%的二氧化碳培养箱培养24 h,通过奥普托欣敏感性试验和胆汁溶菌试验鉴定肺炎链球菌。
1.3 统计学分析采用EpiData建库并进行数据双录入和一致性检验,采用Stata 16.0软件进行统计学分析。计数资料采用频数和百分率(%)描述,不同特征儿童肺炎链球菌携带率的比较采用卡方检验。根据本研究资料所存在的层次结构(图 1),以学校为水平3单位,班级为水平2单位,儿童个体为水平1单位,以是否携带肺炎链球菌为因变量(1=是,0=否),拟合二分类随机效应logistic回归模型[9]。建模策略:首先,建立只包含截距的三水平零模型和两水平的零模型,比较两模型拟合效果从而选择较优模型(两水平logistic回归模型拟合效果较好,作为最终模型)。然后,采用逐步回归法进行变量筛选,引入最终模型的变量有年龄、同住人口数和近1年过敏性疾病史。采用Z检验对回归系数进行假设检验,检验水准α=0.05。以组内相关系数(intra-class correlation, ICC)度量层次结构数据中存在的聚集性,ICC越大表示聚集性越大;ICC接近0时,其反映的聚集效应则相对较小。
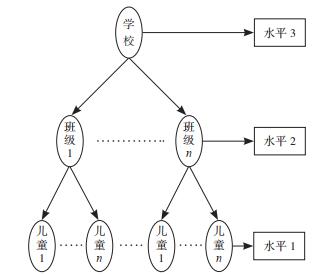
|
图 1 数据结构分层图 |
本研究调查的1 702名健康儿童的平均年龄为(4.9±1.1)岁,年龄最大者7岁,最小2岁;男性883例(51.88%),女性819例(48.12%);汉族1 104例(64.86%),少数民族598例(35.14%);公立幼儿园儿童1 007例(59.17%),私立幼儿园儿童695例(40.83%)。见表 1。
| 表 1 不同特征儿童肺炎链球菌携带率的比较[n(%)] |
|
|
1 702名儿童中,224名鼻腔携带肺炎链球菌,携带率为13.16%(95%CI:11.59%~14.86%)。各幼儿园间儿童肺炎链球菌携带率(最低为7.1%,最高为16.6%)差异无统计学意义(χ2=10.20,P=0.070)。
2.2 不同特征儿童肺炎链球菌携带率的比较2~ < 5岁儿童的携带率高于5~7岁(P < 0.001);同住人口数≥5的儿童携带率高于同住人口数 < 5的儿童(P=0.038);但不同性别、幼儿园类型、地区、民族的儿童肺炎链球菌携带率差异均无统计学意义(P > 0.05)。同时,有无过敏性疾病史、抗生素使用史、肺炎链球菌疫苗接种史、医院/诊所看病史的儿童肺炎链球菌携带率差异也均无统计学意义(P > 0.05)。见表 1。
2.3 儿童肺炎链球菌携带的聚集性分析拟合三水平零模型(只包含截距),结果显示:水平3的学校单位上的随机效应近似于0,且随机效应无统计学意义(Z=2.42×10-3,P=1.000),提示儿童肺炎链球菌携带在学校水平上不存聚集效应,故最终拟合两水平logistic回归模型。两水平零模型结果显示,在班级单位上的随机效应具有统计学意义(Z=2.07,P=0.038),提示幼儿园儿童的肺炎链球菌携带在班级水平上存在聚集性,ICC为5.9%。不同特征人群的分层分析结果显示,女性的ICC稍高于男性(10.4% vs 7.6%),2~ < 5岁儿童的ICC稍高于5~7岁儿童(3.6% vs 0.0%),市区儿童的ICC稍高于郊区儿童(9.5% vs 3.6%),私立幼儿园儿童的ICC稍高于公立幼儿园儿童(6.4% vs 5.5%)。见表 2。
| 表 2 不同特征儿童中肺炎链球菌携带班级聚集性的两水平零模型 |
|
|
采用逐步回归法进行自变量筛选,引入最终模型的变量有年龄、同住人口数、过敏性疾病史。两水平多因素logistic回归分析结果显示:5~7岁儿童的肺炎链球菌携带风险低于2~ < 5岁儿童(OR=0.55,95%CI:0.40~0.76);同住人口数≥5儿童的肺炎链球菌携带风险高于同住人口数 < 5的儿童(OR=1.34,95%CI:1.01~1.79)。此外,在控制了其他影响因素的情况下,水平2单位的随机效应无统计学意义(Z=1.26,P=0.208),ICC为2.8%,提示儿童肺炎链球菌携带在班级水平的聚集现象可能是因某些个体因素在班级间的聚集性所导致。见表 3。
| 表 3 儿童肺炎链球菌携带的两水平多因素logistic回归模型 |
|
|
肺炎链球菌是儿童鼻咽部的常见定植菌,当机体免疫力低下时可引起多种疾病,被世界卫生组织列为12种重要病原体之一[2]。既往大量研究从动物实验[10-11]、流行病学研究[12-13]、生物学证据[14-15]等多方面论证了肺炎链球菌定植是肺炎链球菌疾病的先决条件,同时,新近携带肺炎链球菌者相比长期携带者具有更高的疾病风险[12-13]。据估计,2015年全球5岁以下儿童死亡583万人,其中约29.4万是由肺炎链球菌感染所致[16]。肺炎链球菌的携带具有较明显的地域性和人群特征。国外的一篇综述文献显示,随着国家、地区、人群的不同,肺炎链球菌携带率为2%~86%[3]。国内不同地区儿童肺炎链球菌携带率亦存在一定的差异。其中,香港小学生肺炎链球菌携带率为3.5%[17],潮汕地区6所幼儿园儿童携带率为26.6%[18],广州2~6岁幼儿园儿童携带率为24.1%[19],北京1~12岁健康儿童携带率为57.5%[8],新疆维吾尔自治区幼儿园儿童携带率为80.4%[20]。本研究通过大样本、多所幼儿园的调查,显示柳州地区儿童肺炎链球菌携带率为13.16%。各地区肺炎链球菌携带率的不同可能与年龄、地域、季节和肺炎链球菌疫苗接种史等因素有关。
值得关注的是,幼儿园儿童肺炎链球菌携带数据存在着“学校-班级-个体”的多层次结构;且肺炎链球菌具有传染性,传染病数据的观察结果之间存在相关性,即具有“非独立性”,因此需要选用合适的分析方法进行分析。既往文献资料主要局限于传统的logistic回归分析细菌感染、携带的影响因素。但是,传统logistic回归要求个体间相互独立,无法处理特殊的非独立数据。因此,本研究引入能处理具有层次结构的随机效应logistic回归模型,探究幼儿园儿童肺炎链球菌携带的聚集性及影响因素。这不仅能实现既往文献中对个体因素进行的多因素分析,还能够更加细致地进一步对个体因素外的集体单位(学校和班级层面)的宏观影响进行效应分析。两水平多因素logistic模型分析显示,5~7岁儿童的肺炎链球菌携带风险明显低于2~ < 5岁者(OR=0.55);同住人口数≥5儿童的肺炎链球菌携带风险明显高于同住人口数 < 5的儿童(OR=1.34),提示年龄较小(2~ < 5岁)、同住人口数≥5的儿童为肺炎链球菌携带的高危人群,与既往相关研究结果相似[8, 18-19],提示低龄儿童是肺炎链球菌性疾病防控的重点关注对象。由于5岁以下儿童的机体免疫系统尚未发育完善,对外界环境适应能力较差,当暴露于易感环境中时,其病原体携带及疾病发生风险更高[21]。既往研究表明,环境拥挤、入托入幼均可增加儿童肺炎链球菌的感染风险[22]。香港的研究发现,不同学校间的肺炎链球菌携带率存在一定差异(0~13%,P < 0.001),提示部分学校可能存在肺炎链球菌携带者的聚集现象[17]。对广州幼儿园的调查提示,肺炎链球菌携带呈现班级聚集现象[19]。本研究的多水平零模型分析结果显示,儿童肺炎链球菌携带情况在水平3(学校水平)未发现聚集性,而在水平2(班级水平)存在聚集效应,提示同一班级儿童菌株携带可能存在交叉传播风险。同时,肺炎链球菌携带的班级残差的差异性,一定程度上反映不同班级在环境卫生管理和儿童健康管理方面可能存在差异。在纳入个体解释变量后,原本在零模型中有统计学意义的随机效应变得无统计学意义,且ICC变小,提示儿童肺炎链球菌携带者在班级水平的聚集现象可能是由某些个体特征(例如年龄)在班级间的聚集性所致。据文献报道,除年龄外,肺炎链球菌携带还可能受家中是否有兄弟姐妹、家庭社会经济水平等个体特征及班级规模、老师和保育员数量等集体单位特征的影响[23]。因此,在进行肺炎链球菌性疾病防控时,应重视高危人群的健康教育与干预,以及学校或班级卫生管理制度的制订。此外,去定植是预防卫生保健相关的感染性疾病的有效干预措施。既往研究表明,金黄色葡萄球菌的去定植能有效降低感染性疾病的发生风险[24]。然而目前大多数研究都集中在金黄色葡萄球菌的去定植方面[24-26],肺炎链球菌去定植相关研究较少,该措施与疾病之间的关系尚无定论。
本研究采用了随机效应logistic回归模型,能准确分析有组内相关性的数据,避免损失数据的高层次特征,使参数估计更为稳健;既可分析数据是否存在聚集性,同时可分析个体和群体水平影响因素对研究结局的作用大小。然而,此模型也有一定的局限性,例如参数估计较复杂,参数多时不够简约等。既往关于幼儿园儿童肺炎链球菌相关研究较少且样本含量小,因此我们在既往研究基础上,以多中心、大样本探究多个幼儿园中儿童肺炎链球菌携带率的聚集性及影响因素。但是,本研究属于横断面研究,未对研究对象进行纵向追踪,仅检测某一时间点中儿童肺炎链球菌的携带情况,不能评估长期、持续携带状态。因此,今后可采用连续多次监测,动态研究儿童肺炎链球菌的长期持续携带状态。同时,由于横断面研究中影响因素与结局变量是同时收集的,只能揭示影响因素与肺炎链球菌携带间的潜在关系,无法进行因果推断,因此今后可开展前瞻性的队列研究来验证本研究结果。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Chen Y, Deng W, Wang SM, et al. Burden of pneumonia and meningitis caused by Streptococcus pneumoniae in China among children under 5 years of age: a systematic literature review[J]. PLoS One, 2011, 6(11): e27333. DOI:10.1371/journal.pone.0027333 (  0) 0) |
| [2] |
Weiser JN, Ferreira DM, Paton JC. Streptococcus pneumoniae: transmission, colonization and invasion[J]. Nat Rev Microbiol, 2018, 16(6): 355-367. DOI:10.1038/s41579-018-0001-8 (  0) 0) |
| [3] |
Bogaert D, De Groot R, Hermans PW. Streptococcus pneumoniae colonisation: the key to pneumococcal disease[J]. Lancet Infect Dis, 2004, 4(3): 144-154. DOI:10.1016/S1473-3099(04)00938-7 (  0) 0) |
| [4] |
O'Brien KL, Wolfson LJ, Watt JP, et al. Burden of disease caused by Streptococcus pneumoniae in children younger than 5 years: global estimates[J]. Lancet, 2009, 374(9693): 893-902. DOI:10.1016/S0140-6736(09)61204-6 (  0) 0) |
| [5] |
王传清, 王爱敏, 俞蕙, 等. 2016年儿童细菌耐药监测[J]. 中华儿科杂志, 2018, 56(1): 29-33. DOI:10.3760/cma.j.issn.0578-1310.2018.01.008 (  0) 0) |
| [6] |
付盼, 王传清, 俞蕙, 等. 中国儿童细菌耐药监测组2017年儿童细菌感染及耐药监测[J]. 中国循证儿科杂志, 2018, 13(6): 406-411. DOI:10.3969/j.issn.1673-5501.2018.06.002 (  0) 0) |
| [7] |
付盼, 王传清, 俞蕙, 等. 中国儿童细菌耐药监测组2018年儿童细菌感染及耐药监测[J]. 中国循证儿科杂志, 2019, 14(5): 321-326. (  0) 0) |
| [8] |
邸明芝, 黄辉, 吕敏, 等. 北京市东城区221名1~12岁健康儿童肺炎链球菌携带状况研究[J]. 疾病监测, 2012, 27(8): 595-598. (  0) 0) |
| [9] |
杨珉, 李晓松. 医学和公共卫生研究常用多水平统计模型[M]. 北京: 北京大学医学出版社, 2007: 69-79.
(  0) 0) |
| [10] |
Ogunniyi AD, LeMessurier KS, Graham RM, et al. Contributions of pneumolysin, pneumococcal surface protein A (PspA), and PspC to pathogenicity of Streptococcus pneumoniae D39 in a mouse model[J]. Infect Immun, 2007, 75(4): 1843-1851. DOI:10.1128/IAI.01384-06 (  0) 0) |
| [11] |
Peltola VT, Boyd KL, McAuley JL, et al. Bacterial sinusitis and otitis media following influenza virus infection in ferrets[J]. Infect Immun, 2006, 74(5): 2562-2567. DOI:10.1128/IAI.74.5.2562-2567.2006 (  0) 0) |
| [12] |
Gray BM, Converse GM 3rd, Dillon HC Jr. Epidemiologic studies of Streptococcus pneumoniae in infants: acquisition, carriage, and infection during the first 24 months of life[J]. J Infect Dis, 1980, 142(6): 923-933. DOI:10.1093/infdis/142.6.923 (  0) 0) |
| [13] |
Syrjänen RK, Auranen KJ, Leino TM, et al. Pneumococcal acute otitis media in relation to pneumococcal nasopharyngeal carriage[J]. Pediatr Infect Dis J, 2005, 24(9): 801-806. DOI:10.1097/01.inf.0000178072.83531.4f (  0) 0) |
| [14] |
Bergmann S, Rohde M, Chhatwal GS, et al. alpha-Enolase of Streptococcus pneumoniae is a plasmin(ogen)-binding protein displayed on the bacterial cell surface[J]. Mol Microbiol, 2001, 40(6): 1273-1287. DOI:10.1046/j.1365-2958.2001.02448.x (  0) 0) |
| [15] |
Kostyukova NN, Volkova MO, Ivanova VV, et al. A study of pathogenic factors of Streptococcus pneumoniae strains causing meningitis[J]. FEMS Immunol Med Microbiol, 1995, 10(2): 133-137. DOI:10.1111/j.1574-695X.1995.tb00022.x (  0) 0) |
| [16] |
Wahl B, O'Brien KL, Greenbaum A, et al. Burden of Streptococcus pneumoniae and haemophilus influenzae type B disease in children in the era of conjugate vaccines: global, regional, and national estimates for 2000-15[J]. Lancet Glob Health, 2018, 6(7): e744-e757. DOI:10.1016/S2214-109X(18)30247-X (  0) 0) |
| [17] |
Boost MV, O'Donoghue MM, Dooley JS. Prevalence of carriage of antimicrobial resistant strains of Streptococcus pneumoniae in primary school children in Hong Kong[J]. Epidemiol Infect, 2001, 127(1): 49-55. (  0) 0) |
| [18] |
Pan H, Cui BL, Huang YC, et al. Nasal carriage of common bacterial pathogens among healthy kindergarten children in Chaoshan region, southern China: a cross-sectional study[J]. BMC Pediatr, 2016, 16(1): 161. DOI:10.1186/s12887-016-0703-x (  0) 0) |
| [19] |
吴本权, 唐英春, 朱家馨, 等. 广州市区两幼儿园2~6岁健康儿童肺炎链球菌携带状况调查[J]. 中国当代儿科杂志, 2001, 3(5): 529-531. DOI:10.3969/j.issn.1008-8830.2001.05.013 (  0) 0) |
| [20] |
Xie N, Chen ZY, Chen T, et al. A cross-sectional survey assessing carriage of Streptococcus pneumoniae in a healthy population in Xinjiang Uygur Autonomous Region of China[J]. Biomed Environ Sci, 2018, 31(3): 233-237. (  0) 0) |
| [21] |
罗春绸, 蔡惠贞, 蔡梦云, 等. 幼儿园健康学龄前儿童入园前咽部病原体携带状况分析[J]. 社区医学杂志, 2020, 18(15): 1043-1046. (  0) 0) |
| [22] |
杨永弘, 申昆玲, 郑跃杰. 进一步关注我国儿童肺炎链球菌性疾病的研究[J]. 中华实用儿科临床杂志, 2020, 35(7): 481-484. DOI:10.3760/cma.j.cn101070-20200302-00304 (  0) 0) |
| [23] |
Nesti MM, Goldbaum M. Infectious diseases and daycare and preschool education[J]. J Pediatr (Rio J), 2007, 83(4): 299-312. DOI:10.2223/JPED.1649 (  0) 0) |
| [24] |
Septimus EJ, Schweizer ML. Decolonization in prevention of health care-associated infections[J]. Clin Microbiol Rev, 2016, 29(2): 201-222. DOI:10.1128/CMR.00049-15 (  0) 0) |
| [25] |
Huang SS, Singh R, McKinnell JA, et al. Decolonization to reduce postdischarge infection risk among MRSA carriers[J]. N Engl J Med, 2019, 380(7): 638-650. DOI:10.1056/NEJMoa1716771 (  0) 0) |
| [26] |
Sakr A, Brégeon F, Rolain JM, et al. Staphylococcus aureus nasal decolonization strategies: a review[J]. Expert Rev Anti Infect Ther, 2019, 17(5): 327-340. DOI:10.1080/14787210.2019.1604220 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


