2. 广州市妇女儿童医疗中心儿内科, 广东广州 510623
新生儿坏死性小肠结肠炎(necrotizing enterocolitis, NEC)是新生儿期常见的严重胃肠道疾病,多见于早产儿和低出生体重(LBW)儿[1],临床以腹胀、呕吐、便血为主要表现,腹部X线检查以肠壁囊样积气为特征。NEC发生率与新生儿出生体重呈反比[1],且与出生时胎龄呈负相关[2]。有研究表明我国LBW儿(出生体重 < 2 500 g)和极低出生体重(VLBW)儿(出生体重 < 1 500 g)的发生率分别为2.50%和4.53%,Ⅰ、Ⅱ、Ⅲ期NEC患儿分别占51.1%、30.3%和18.6%,Ⅱ、Ⅲ期NEC患儿病死率为41.7%[3]。从临床的角度来看,NEC的早期表现如反应差、精神萎靡、嗜睡、体温不稳定、喂养不耐受等很难与早产儿常见的新生儿败血症等其他疾病和情况区分开来[4]。影像学检查中发现肠壁积气、肠壁增宽、门静脉积气、气腹,甚至肠穿孔等改变时,其疾病状态已非常危重[2]。非特异性生物标志物如血小板计数、白细胞计数、白细胞介素6、C反应蛋白、降钙素原等对NEC的识别缺乏特异性与敏感性[5],因此早期鉴别特异性肠道生物标志物对降低新生儿,尤其是早产儿和LBW儿的病死率有着非常重要的临床意义。
粪便钙卫蛋白(fecal calprotectin, FC)是S100蛋白家族中1个36 kDa的钙锌结合胞浆蛋白,是由活化或受损的粒细胞、巨噬细胞、上皮细胞及单核细胞等释放的蛋白质,与中性粒细胞迁徙至胃肠道有关,占粒细胞胞浆蛋白的半数以上,具有直接的抗菌作用[6],对代谢降解具有抵抗力,其在粪便中的浓度大约是血浆的6倍[6],很容易在粪便中找到[7-8]。因此FC作为一种检测简单、可重复性高的非侵入性的检测指标,具有更高的灵敏度和特异度。现FC已作为筛查、诊断和检测成人或儿童肠道炎症性疾病的有用指标之一[9-10],目前国内外已有多篇文献对FC诊断NEC的价值进行了探讨,但研究结果尚不一致,对其诊断价值仍存争议[11]。为克服单一研究样本量小、检验效能低的缺点,本研究通过Meta分析方法进行定量综合评价FC对NEC的诊断价值,为临床应用提供一定依据。
1 资料与方法 1.1 文献检索检索Cochrane Library、Embase、Web of Science、PubMed、维普期刊数据库、中国生物医学文献数据库、中国知网、万方数据库。中文检索词:新生儿、早产儿、低出生体重儿、坏死性小肠结肠炎、粪便钙卫蛋白;英文检索词:“Infant”“Newborn”“Neonates”“Infant”“Premature”“Low-Birth-Weight Infant”“Enterocolitis”“Necrotizing”“Necro-tizing Enterocolitis”“Leukocyte L1 Antigen Complex”“Calprotectin”。将检索时间设定为从建库开始至2020年5月。为检索更加全面,必要时进行文献追踪。
1.2 文献纳入及排除标准纳入标准:(1)研究目的为评价或探讨FC对NEC的诊断效能的中英文文献;(2)研究对象为新生儿(年龄 < 28 d);(3)回顾性或前瞻性研究;(4)在研究中明确提出NEC的诊断标准,并有正常新生儿或非NEC新生儿作为对照的诊断对比资料;(5)能从原始文献中获得FC诊断NEC的真阳性值(TP)、真阴性值(TN)、假阳性值(FP)、假阴性值(FN)等诊断参数;(6)当作者与内容均相似时,选取数据最全面的1篇文献。排除标准:(1)研究对象为非新生儿;(2)非诊断性试验研究;(3)样本量不足;(4)不能提取所需要数据及信息的研究。
1.3 文献筛选两名调查人员独立评审和评估每项研究,意见矛盾时,另增一位研究者进行评估。首先筛选标题和摘要,以确定潜在的合格研究,然后分析全文进行进一步评估。如果存在不确定的问题,通过Email与文章的作者确认。文献筛选流程及结果见图 1。
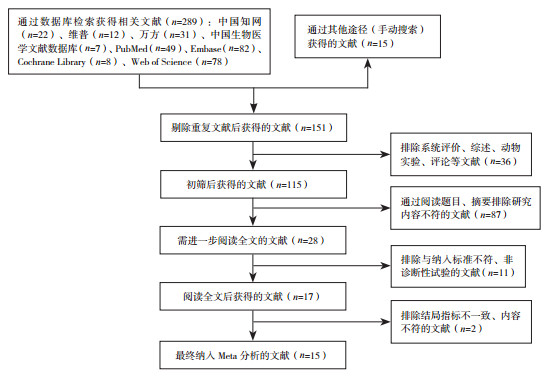
|
图 1 文献筛选流程图 |
从纳入分析的15篇文献中,提取了文献作者、发表时间、所在国家、病例与对照组例数、出生体重、胎龄、平均年龄、性别等一般情况,还有FC检测方法及检测界值,以及TN、TP、FN、FP等诊断参数信息。
1.5 纳入文献质量评价进入Meta分析的研究质量评价采用quality assessment of diagnostic accuracy studies(QUADAS)标准评价[12]。该标准总共包含14个问题,对每条问题作出“是”“否”或“不清楚”的判断,由2名研究者分别进行评估,有分歧时讨论决定。满足“是”的 < 10项则为低质量,10~11项为中等质量,12~14项为高质量。
1.6 统计学分析首先进行异质性检验,绘制受试者工作特征(ROC)曲线,并计算灵敏度对数与(1-特异度)对数的Spearman相关系数及P值,来评价是否具有阈值效应。根据MetaDisc 1.4软件计算所得I2来评估纳入文献的异质性大小,I2≥50%,表明有显著异质性,采用随机效应模型进行统计分析,否则使用固定效应模型。应用MetaDisc 1.4软件进行Meta分析。应用Stata 15.0软件进行敏感性分析及发表性偏倚检验;绘制Fagan图以估计测试后概率;进行亚组分析并用Meta回归对异质性的可能来源进行分析。
2 结果 2.1 检索结果通过检索共获得304篇文献。根据图 1的筛选流程初步筛出28篇文献,进一步评估全文,排除与纳入标准不符、非诊断性试验的文献11篇,排除结局指标不一致、内容不符的文献2篇,最终纳入15篇,其中中文文献5篇,英文文献10篇。所有研究均采集了21组数据,合计1 719例新生儿,其中NEC组560例,对照组1 159例。纳入文献基本特征见表 1。
| 表 1 纳入文献基本特征 |
|
|
对纳入文献逐一进行质量评价。3篇文献[20-21, 23]纳入人群为VLBW儿,12篇文献[14, 16-18, 20-27]纳入人群为早产儿,有发生疾病谱偏倚的可能。所有文献选择研究对象的标准是明确的。只有6篇文献[13-15, 18, 22-23]提供了诊断NEC及标本检测的具体时间,发生疾病进展偏倚的可能性较大。所有文献病例组和对照组均接受了金标准试验,表明无发生参照偏倚的可能。所有文献均接受了相同的金标准试验,表明无多重参照偏倚发生的可能,且金标准试验均独立于待评价试验,发生金标准偏倚的可能性较小。12篇文献[13-20, 22-24, 27]未清楚描述待评价试验的结果判读是否是在不知晓金标准试验结果的情况下进行,提示对诊断性试验判读偏倚是否会发生描述不清楚。7篇文献[16-18, 24-27]不清楚金标准试验的结果判读是否是在不知晓待评价试验结果的情况下进行。仅有1篇文献[21]报告了难以解释的试验结果,2篇文献[25-26]对退出研究的病例进行解释。纳入文献中,低质量文献有4篇[18-19, 22, 27],高质量文献有2篇[25-26],其余均为中等质量。
2.3 异质性检验绘制了FC诊断NEC的综合受试者工作特征(summary receiver operating characteristic, SROC)曲线(图 2),曲线下面积(AUC)为0.9131,Q*指数为0.8456,说明FC对于NEC的诊断具有较高的价值;且未发现呈“肩臂状”点分布,进一步计算灵敏度对数与(1-特异度)对数的Spearman相关系数为-0.374,灵敏度和1-特异度呈负相关,P=0.095,均提示不存在阈值效应。根据异质性检验结果,可以发现各研究结果间的诊断比值比(DOR)(χ2=40.16,P=0.0048,I2=50.2%),存在显著的异质性,因此采用随机效应模型进行Meta分析。

|
图 2 FC诊断NEC的SROC曲线 |
图 3所示为FC诊断NEC的特异度、灵敏度的森林图,FC诊断新生儿NEC的特异度、灵敏度分别为0.80(95%CI:0.78~0.82)、0.86(95%CI:0.83~0.89);图 4~5所示为似然比和DOR的森林图,阴性似然比(NLR)、阳性似然比(PLR)、DOR分别为0.19(95%CI:0.14~0.26)、4.71(95%CI:3.57~6.23)、29.56(95%CI:17.98~48.61)。说明FC对于NEC的诊断具有较高的价值。
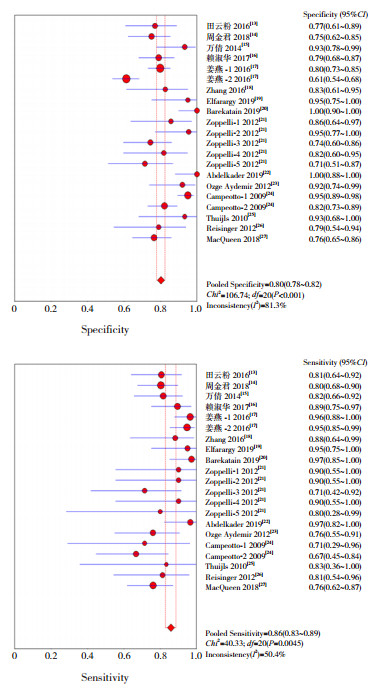
|
图 3 FC诊断NEC的汇总特异度(上)及灵敏度(下)分析 |
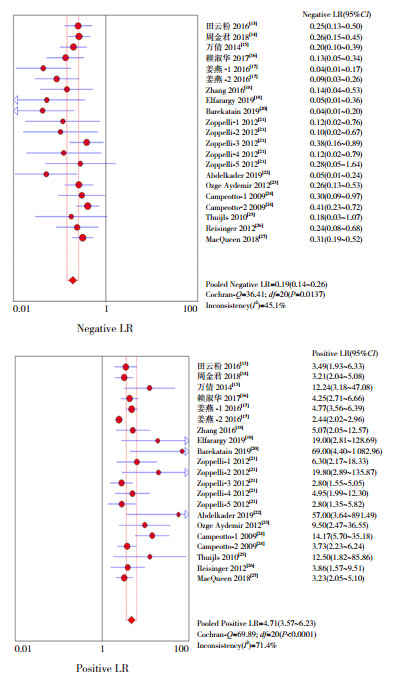
|
图 4 FC诊断NEC的汇总阴性似然比(上)及阳性似然比(下)分析 |
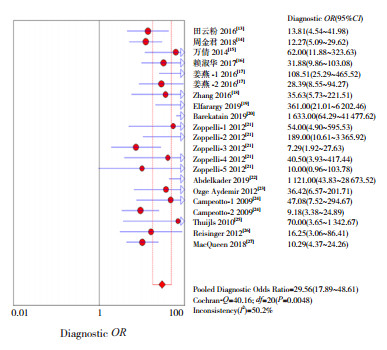
|
图 5 FC诊断NEC的汇总诊断比值比分析 |
诊断性Meta分析异质性来源于阈值效应、协变量效应、发表偏倚等。本研究发现纳入研究间存在异质性,且没有阈值效应。Deek's法的P=0.69(图 6),说明纳入研究没有发表偏倚。将纳入研究分为早产儿组、非早产儿组、VLBW组(出生体重 < 1 500 g)、非VLBW组,分别进行亚组分析,结果见表 2。在早产儿组中FC诊断NEC有较高的灵敏度与特异度,在VLBW组中,灵敏度与早产儿组相近,但有更高的特异度,亚组分析说明FC在早产儿和VLBW儿的NEC诊断中均有较高的灵敏度与特异度。将文献中发表时间、研究方法、研究国家、NEC诊断时间、粪便标本收集时间作为协变量进行Meta回归分析,未发现异质性的来源(均P > 0.05),说明异质性来源于其他非协变量因素。利用Stata 15.0软件进行敏感性分析(图 7),评估单个研究对本次Meta分析的影响,删除任意1篇文献,然后对余下研究进行汇总分析发现诊断参数置信区间与原数据大部分重叠,说明本文纳入文献的稳定性较好。绘制Fagan图(图 8)进行试验后概率估计,用Fagan分析说明FC在诊断NEC中的价值,即纳入研究金标准的检验概率为80%,计算得知FC诊断NEC时,明确患有NEC的概率为86%,排除NEC时,明确患有NEC的概率为13%。
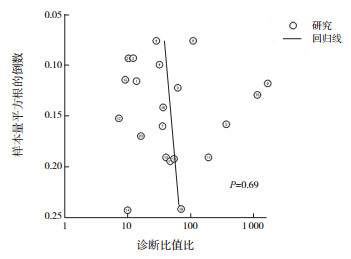
|
图 6 Deek's法分析纳入文献发表偏倚情况 |
| 表 2 亚组分析 |
|
|
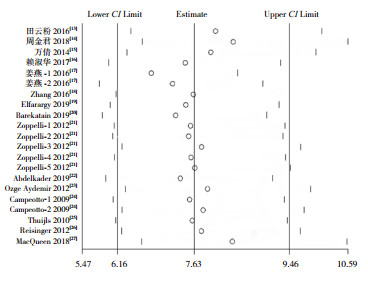
|
图 7 纳入文献敏感性分析 |
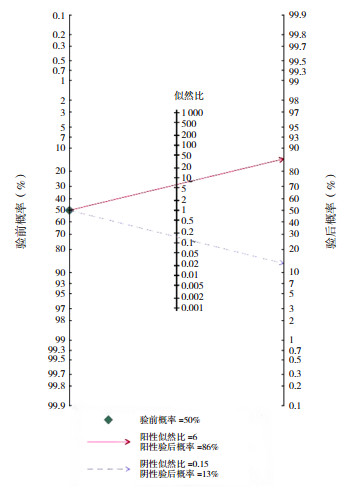
|
图 8 纳入文献Fagan图 |
当PLR > 10或NLR < 0.1时,诊断或排除某种疾病的可能性就显著增加。DOR > 1时,其值越大说明该诊断试验的判别效果越好;取值< 1时,正常人比患者更有可能被诊断试验判为阳性;取值=1时,表示该诊断试验无法判别正常人与患者。为了评估SROC曲线的准确性,还计算了Q*指数,Q*指数越大时,AUC越接近1,说明准确性越高。
本研究有较高的总Se、Sp,分别为0.86(95%CI:0.83~0.89)、0.80(95%CI:0.78~0.82)。总PLR、NLR分别为4.71、0.19,PLR > 10或NLR < 0.1时,诊断或排除某种疾病的可能性就显著增加,该研究结果不支持FC检测阴性时排除NEC的可能性大。DOR为29.56,其值越大说明该诊断试验的判别效果越好。AUC=0.9131、Q*=0.8456,Q*指数越大时,AUC越接近1,说明准确性越高。由于纳入文献存在高度异质性,因此从诊断阈值效应、协变量效应、发表偏倚3个方面探讨可能的异质性来源。分析发现本研究没有阈值效应和发表偏倚,进一步行Meta回归分析,结果表明,发表时间、研究国家、研究方法、NEC诊断时间、粪便标本收集时间均不是异质性的来源,异质性可能与FC诊断界值、有无NEC高危因素等其他因素有关,说明本研究设计的差异并不会造成结果的明显差异。本研究通过Meta分析方法将小样本试验结果进行定量分析,发现FC对早期诊断NEC具有较好的灵敏度和特异度,有较高的诊断价值。
NEC是一种少见且严重的胃肠道疾病,目前还没有有效的干预措施来防止NEC的发生和进展。其发病机制目前仍不明确,可能与多种因素有关,NEC的发生很可能是黏膜损伤和宿主反应之间相互作用的结果,这种反应导致受影响区域坏死,其进展会导致肠破裂、腹膜炎、脓毒症和死亡[20]。NEC的诊断依赖于一系列临床症状、实验室数据和放射学发现,这些临床参数是非特异性的,不能为NEC的早期诊断提供足够的依据。现在并无针对NEC的特异性治疗方案,其预防策略包括鼓励使用母乳喂养、应用益生菌[28-29],及早怀疑和适当管理。因此,早期找到可靠的特异的肠道炎症生物标志物或因子,将有助于降低NEC的发病率和病死率。
先前的研究发现,FC在NEC患儿粪便中含量较正常新生儿、喂养不耐受等患儿明显升高,治疗后下降,FC的增加与疾病严重程度呈正相关[8, 18, 30-31]。NEC可能会损害整个肠道,最常见的区域是末端回肠和近端升结肠,这可能是不可逆转的。广泛的黏膜感染会导致FC水平升高,当FC螯合了锌离子,形成了稳定的结构,则具有抗热性,它们不会被降解,这种稳定形式的FC在室温下可以在粪便中保持长达7 d[18],且FC的检测是无创、简便的,减少了对新生儿的刺激,FC的这些特性使其能作为筛选肠道炎症的可靠生化标志物。
本研究的局限性:(1)检索文献均为公开发表的,可能遗漏一些灰色文献;有可能会错失除中英文外的相关文献;(2)在诊断性试验中应用盲法可大大减少诊断的倾向性,但大多研究未报道是否使用盲法,存在测量偏倚的可能;(3)大多数文献并未说明纳入病例有无发生NEC的高危因素,有无使用抗生素、益生菌等信息,可能对结果造成一定影响;(4)纳入文献的异质性较大,尽管本研究已进行了亚组分析、异质性探索,均未发现异质性来源,但临床异质性仍可能对结论的可靠性造成一定影响,待以后相关研究增多,可进一步细化亚组分析;(5)部分纳入研究样本量偏少或质量偏低。
综上所述,粪便FC在新生儿NEC的诊断中具有较高的特异度及灵敏度,结合其稳定性高、方便检测等特点,可作为NEC良好的辅助诊断工具,在临床上用于诊断新生儿NEC具有一定价值,有利于早期对新生儿NEC作出诊断。未来可以进行更多多中心、大样本试验来进一步验证其诊断效能。
| [1] |
Knell J, Han SM, Jaksic T, et al. Current status of necrotizing enterocolitis[J]. Curr Probl Surg, 2019, 56(1): 11-38. DOI:10.1067/j.cpsurg.2018.11.005 (  0) 0) |
| [2] |
Bellodas Sanchez J, Kadrofske M. Necrotizing enterocolitis[J]. Neurogastroenterol Motil, 2019, 31(3): e13569. DOI:10.1111/nmo.13569 (  0) 0) |
| [3] |
Qian T, Zhang R, Zhu L, et al. Necrotizing enterocolitis in low birth weight infants in China: mortality risk factors expressed by birth weight categories[J]. Pediatr Neonatol, 2017, 58(6): 509-515. DOI:10.1016/j.pedneo.2016.10.004 (  0) 0) |
| [4] |
Thakkar HS, Lakhoo K. Necrotizing enterocolitis[J]. Surgery (Oxford), 2019, 37(11): 628-631. DOI:10.1016/j.mpsur.2019.09.007 (  0) 0) |
| [5] |
Garg BD, Sharma D, Bansal A. Biomarkers of necrotizing enterocolitis: a review of literature[J]. J Matern Fetal Neonatal Med, 2018, 31(22): 3051-3064. DOI:10.1080/14767058.2017.1361925 (  0) 0) |
| [6] |
Ayling, RM, Kok K. Fecal calprotectin[M]//Makowski GS. Advances in clinical chemistry. Amsterdam: Elsevier, 2018, 87: 161-190.
(  0) 0) |
| [7] |
Goldstein GP, Sylvester KG. Biomarker discovery and utility in necrotizing enterocolitis[J]. Clin Perinatol, 2019, 46(1): 1-17. DOI:10.1016/j.clp.2018.10.001 (  0) 0) |
| [8] |
MacQueen BC, Christensen RD, Yost CC, et al. Elevated fecal calprotectin levels during necrotizing enterocolitis are associated with activated neutrophils extruding neutrophil extracellular traps[J]. J Perinatol, 2016, 36(10): 862-869. DOI:10.1038/jp.2016.105 (  0) 0) |
| [9] |
Vernia F, Di Ruscio M, Stefanelli G, et al. Is fecal calprotectin an accurate marker in the management of Crohn's disease?[J]. J Gastroenterol Hepatol, 2020, 35(3): 390-400. DOI:10.1111/jgh.14950 (  0) 0) |
| [10] |
Heida A, Park KT, van Rheenen PF. Clinical utility of fecal calprotectin monitoring in asymptomatic patients with inflammatory bowel disease: a systematic review and practical guide[J]. Inflamm Bowel Dis, 2017, 23(6): 894-902. DOI:10.1097/MIB.0000000000001082 (  0) 0) |
| [11] |
Wang KW, Tao GZ, Sun Z, et al. Recent potential noninvasive biomarkers in necrotizing enterocolitis[J]. Gastroenterol Res Pract, 2019, 2019: 8413698. (  0) 0) |
| [12] |
Whiting PF, Weswood ME, Rutjes AW, 等. QUADAS评价: 一种用于诊断性研究的质量评价工具(修订版)[J]. 中国循证医学杂志, 2007, 7(7): 531-536. DOI:10.3969/j.issn.1672-2531.2007.07.010 (  0) 0) |
| [13] |
田云粉, 李利, 米弘瑛, 等. 肠型脂肪酸结合蛋白和粪钙卫蛋白联合检测在足月新生儿坏死性小肠结肠炎中的应用价值[J]. 中国当代儿科杂志, 2016, 18(11): 1080-1083. DOI:10.7499/j.issn.1008-8830.2016.11.005 (  0) 0) |
| [14] |
周金君, 李双双, 张小华, 等. 肠脂酸结合蛋白联合粪钙卫蛋白检测在新生儿坏死性小肠结肠炎中的意义[J]. 世界最新医学信息文摘, 2018, 18(57): 157. (  0) 0) |
| [15] |
万倩. 粪钙卫蛋白与新生儿坏死性小肠结肠炎的相关性研究[D]. 兰州: 兰州大学, 2014.
(  0) 0) |
| [16] |
赖淑华, 杨长仪. 粪钙卫蛋白在早期诊断早产儿坏死性小肠结肠炎中的临床价值[J]. 海峡预防医学杂志, 2017, 23(1): 98-101. (  0) 0) |
| [17] |
姜燕, 李和勤, 白亚飞, 等. 尿肠型脂肪酸结合蛋白与粪钙卫蛋白在诊断早产儿喂养不耐受及坏死性小肠结肠炎中的价值[J]. 广西医学, 2016, 38(5): 660-663. (  0) 0) |
| [18] |
Zhang M, Zhang XT, Zhang JY. Diagnostic value of fecal calprotectin in preterm infants with necrotizing enterocolitis[J]. Clin Lab, 2016, 62(5): 863-869. (  0) 0) |
| [19] |
Elfarargy MS, El Farargy MS, Atef MM, et al. Early biomarkers in neonatal necrotizing enterocolitis: a pilot study[J]. J Popul Ther Clin Pharmacol, 2019, 26(3): e1-e8. (  0) 0) |
| [20] |
Barekatain B, Saneian H, Ebrahimi A, et al. Evaluation and comparison of stool calprotectin level in necrotizing enterocolitis infected and noninfected neonates of < 1500 g[J]. J Clin Neonatol, 2019, 8(2): 90-95. DOI:10.4103/jcn.JCN_106_18 (  0) 0) |
| [21] |
Zoppelli L, Güttel C, Bittrich HJ, et al. Fecal calprotectin concentrations in premature infants have a lower limit and show postnatal and gestational age dependence[J]. Neonatology, 2012, 102(1): 68-74. DOI:10.1159/000337841 (  0) 0) |
| [22] |
Abdelkader M, Mesbah BE, Khashana A. Fecal calprotectin level in neonates with necrotizing enterocolitis[J]. Iran J Neonatol, 2019, 10(3): 7-13. (  0) 0) |
| [23] |
Aydemir O, Aydemir C, Sarikabadayi YU, et al. Fecal calprotectin levels are increased in infants with necrotizing enterocolitis[J]. J Matern Fetal Neonatal Med, 2012, 25(11): 2237-2241. DOI:10.3109/14767058.2012.684172 (  0) 0) |
| [24] |
Campeotto F, Baldassarre M, Butel MJ, et al. Fecal calprotectin: cutoff values for identifying intestinal distress in preterm infants[J]. J Pediatr Gastroenterol Nutr, 2009, 48(4): 507-510. DOI:10.1097/MPG.0b013e318186c4a6 (  0) 0) |
| [25] |
Thuijls G, Derikx JP, van Wijck K, et al. Non-invasive markers for early diagnosis and determination of the severity of necrotizing enterocolitis[J]. Ann Surg, 2010, 251(6): 1174-1180. DOI:10.1097/SLA.0b013e3181d778c4 (  0) 0) |
| [26] |
Reisinger KW, Van der Zee DC, Brouwers HA, et al. Noninvasive measurement of fecal calprotectin and serum amyloid A combined with intestinal fatty acid-binding protein in necrotizing enterocolitis[J]. J Pediatr Surg, 2012, 47(9): 1640-1645. DOI:10.1016/j.jpedsurg.2012.02.027 (  0) 0) |
| [27] |
MacQueen BC, Christensen RD, Yost CC, et al. Reference intervals for stool calprotectin in preterm neonates and their utility for the diagnosis of necrotizing enterocolitis[J]. J Perinatol, 2018, 38(10): 1379-1385. DOI:10.1038/s41372-018-0108-9 (  0) 0) |
| [28] |
Zhu XL, Tang XG, Qu F, et al. Bifidobacterium may benefit the prevention of necrotizing enterocolitis in preterm infants: a systematic review and meta-analysis[J]. Int J Surg, 2019, 61: 17-25. DOI:10.1016/j.ijsu.2018.11.026 (  0) 0) |
| [29] |
Underwood MA. Probiotics and the prevention of necrotizing enterocolitis[J]. J Pediatr Surg, 2019, 54(3): 405-412. DOI:10.1016/j.jpedsurg.2018.08.055 (  0) 0) |
| [30] |
Albanna EA, Ahmed HS, Awad HA. Stool calprotectin in necrotizing enterocolitis[J]. J Clin Neonatol, 2014, 3(1): 16-19. DOI:10.4103/2249-4847.128721 (  0) 0) |
| [31] |
Yoon JM, Park JY, Ko KO, et al. Fecal calprotectin concentration in neonatal necrotizing enterocolitis[J]. Korean J Pediatr, 2014, 57(8): 351-356. DOI:10.3345/kjp.2014.57.8.351 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


