2. 解放军总医院第六医学中心, 北京 100048
随着围生医学的发展,几乎所有国家的早产率都在上升。不幸的是,早产儿大脑发育过程特别容易遭受缺氧缺血和炎症感染,其发生脑白质损伤(white matter injury, WMI)的风险很高[1]。WMI常导致远期认知障碍和脑性瘫痪等后遗症[1],给家庭和社会经济造成了巨大负担。脑室周围白质软化(periventricular leukomalacia, PVL)是WMI的主要表现形式[2],它干扰少突胶质细胞谱系的发育[3-4]。然而,目前还没有针对WMI治疗的特异性方法。
少突胶质前体细胞(oligodendrocyte precursor cells, OPCs)是中枢神经系统少突胶质细胞的前体,在胚胎发育和出生后早期的神经发育过程中发挥着重要作用。髓鞘脱失是PVL的病理标志, 随着OPCs向有髓少突胶质细胞的增殖和分化减少而增加[5-6]。越来越多的研究表明,在WMI中,OPCs对于潜在的髓鞘重塑活动驱动也发挥了关键作用[7]。此外,实验室先前的研究表明通过侧脑室移植人少突胶质前体细胞(human oligodendrocyte precursor cells, hOPCs)后可对WMI大鼠模型起神经保护和修复作用,增强髓鞘再生能力,并维持正常的神经功能[8]。因此,hOPCs具有很大的移植潜力。
通过脑立体定位仪移植细胞到胼胝体和侧脑室,或者通过动静脉注射移植等途径都是目前干细胞动物实验中常用的方法。但是将这些干细胞研究转化为临床应用,需要改善细胞递送方式从而避免对脑组织的损伤,同时需要克服中枢神经系统存有血脑屏障的难题。经小脑延髓池注射细胞至蛛网膜下腔的移植方式是非侵入性的,操作简单方便,不良反应小,可反复操作。细胞可以进入脑脊液,快速弥散于蛛网膜下腔,并且直接接触脑组织。
本实验的目的是研究经蛛网膜下腔移植hOPCs至WMI大鼠模型是否能促进髓鞘再生和改善其远期行为能力。
1 材料与方法 1.1 动物从北京维通利华购买清洁级Sprague-Dawley孕鼠。将孕鼠单独关在笼子里,自由进食。待产子后,选取生后3 d的新生大鼠作为实验对象。根据实验要求,将新生大鼠随机分为假手术组、模型组、hOPCs移植组(移植组),每组10只,其中雄性大鼠5只,雌性大鼠5只,30日龄时分笼。90日龄时,进行水迷宫实验后,每组随机选取3只大鼠进行电镜观察。
1.2 主要试剂多聚甲醛和牛血清白蛋白(A1992,美国Sigma公司),兔抗鼠神经节苷脂(ganglioside, A2B5)抗体(MAB1416,美国R&D Systems公司),兔抗鼠少突胶质细胞转录因子-2(oligodendrocyte transcription factor-2, Olig2)抗体(AB9610,美国Millipore公司),驴抗兔IgG 488二抗(AB175649,英国Abcam公司)。
1.3 细胞培养本研究中采用的hOPCs从人类自然流产的11周胎儿脑中分离的神经干细胞诱导分化产生。细胞来源已获得解放军总医院第六医学中心医学伦理审查委员会批准(20170812),并在术前与供者签订知情同意书。按照文献所述[9],通过反复的机械分散、离心、分离,将提取的胎儿脑组织分离成单细胞悬液。然后将这些细胞种植到专用的神经干细胞培养基中,诱导其在体外分化得到hOPCs。用hOPCs特异性标记物A2B5和Olig2进行染色,鉴定并检测细胞纯度。细胞移植时,将hOPCs浓缩在磷酸缓冲0.9%氯化钠溶液中制成细胞悬液(1.8×106/20 μL PBS)。
1.4 PVL动物模型的建立参照文献建造PVL动物模型[10-11],将出生后(P)3 d的大鼠放置在冰上15 min行冰冻麻醉,待其对有害刺激无反应。大鼠取仰卧位用胶布固定,消毒颈部皮肤。在显微镜下沿正中线切开皮肤约0.5 cm,剥离其右侧颈总动脉,用电凝笔离断后,缝合皮肤。建造模型过程中,排除模型组出血过多的大鼠1只。术后,立即将新生大鼠放回母鼠笼中复温2 h,然后将幼鼠置于密封的37℃恒温缺氧箱中,暴露于缺氧(94%N2+6%O2)环境中2 h。假手术组大鼠仅在冰冻麻醉后游离右侧颈总动脉,但不予离断,也不对其进行缺氧处理。
1.5 细胞移植给予戊巴比妥(60 mg/kg)腹腔注射麻醉P8 d大鼠,并用立体定位仪将其固定在俯卧位,头部在水平线下以大约30°的角度弯曲。沿中线切开后头皮,用镊子对肌肉进行钝性分离。在枕骨与寰椎的交界处,暴露出寰枕膜。将寰枕膜晾干,用汉密尔顿进样针从中间向左侧刺穿。观察到脑脊液流出,以确保针尖位于小脑延髓池内[12]。将20 μL hOPCs细胞悬液(移植组)或20 μL PBS(模型组及假手术组)缓慢注射到小脑延髓池,此过程大约10 min。然后将针尖停留在蛛网膜下腔内10 min以防止细胞泄漏。移植期间,大鼠没有明显的不良反应。拔针后立即将1滴0.9%氯化钠溶液滴于针头处,以避免移植细胞与脑脊液一起从第四脑室流出。最后缝合皮肤。移植组大鼠无出血、无死亡。移植前3 d开始对大鼠腹腔注射环孢素(每日10 mg/kg),直到移植后1个月。
1.6 行为测试按照文献所述方法[13],在移植后第12周对所有大鼠进行Morris水迷宫实验。在实验中,将大鼠依次紧靠侧壁放置在每个象限内。连续训练5 d进行定位航行实验,记录定位目标平台所用的总时间(延迟截止时间60 s),评估大鼠的学习能力。在测试的第6天,进行空间探索实验,将平台移出迷宫,测量60 s内的目标平台穿越次数、目标象限穿越次数和目标象限停留时间,评估大鼠的远期记忆功能。
1.7 免疫荧光染色取状态良好的6孔板培养的hOPCs进行免疫荧光染色鉴定。hOPCs用4%多聚甲醛室温固定5 min,PBS洗3次;每孔加入3%BSA在28~30℃的三气培养箱中封闭2 h,吸弃封闭液后加入一抗A2B5(1 : 50)和Olig2(1 : 100),于4℃孵育过夜;PBS洗3次,每次5 min;加入二抗驴抗兔IgG 488(1 : 500),室温避光孵育2 h,PBS洗3次,每次5 min;DAPI复染10 min,PBS洗3次,每次5 min;在荧光显微镜下拍照。
1.8 电镜移植后第12周,每组各取3只大鼠经心脏灌注。从每只鼠右半脑同一位置取总面积为1 mm2的胼胝体样本。2.5%戊二醛固定30 min,PBS室温洗涤3次。四氧化锇固定后,用丙酮脱水并包埋在环氧树脂中。然后将标本切成70 nm的超薄切片,再用电镜观察轴突的超微结构。通过Image J软件,从低倍率图像(6 000倍)中随机选取100个有髓轴突,计算g-ratio(轴突总直径/纤维总直径),g-ratio值越大,说明髓鞘厚度越小[14]。
1.9 统计学分析采用GraphPad Prism 8和SPSS 11.0统计软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示。水迷宫定位航行实验采用重复测量方差分析,同一时间点组间两两比较采用LSD-t检验。其他结果采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 从神经干细胞分化制备hOPCs采用hOPCs特异性标记物(Olig2、A2B5)进行免疫荧光染色,验证移植细胞纯度。免疫荧光分析显示,移植细胞为Olig2+、A2B5+细胞(图 1),阳性百分率分别为92.5%、95.1%,即为hOPCs。该结果表明hOPCs纯度较高,可用于本实验研究。
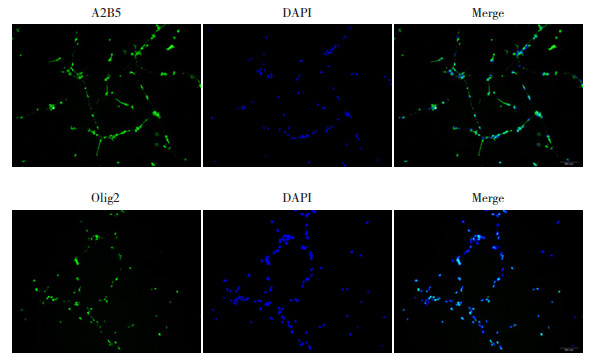
|
图 1 分化培养hOPCs移植到WMI大鼠中(免疫荧光染色,×200) 上图绿色荧光为神经节苷脂(A2B5)的阳性表达,蓝色荧光为DAPI标记的细胞核;下图绿色荧光为少突胶质细胞转录因子-2(Olig2)的阳性表达;蓝色荧光为DAPI标记的细胞核。 |
移植后第12周对大鼠进行Morris水迷宫测试。在Morris水迷宫定位航行实验中,从第1天到第5天,模型组的逃避潜伏期明显长于假手术组(P < 0.05)。但是,与模型组相比,除第2天外,移植组的逃避潜伏期均缩短(P < 0.05)。在水迷宫空间探索实验中,与假手术组相比,模型组大鼠的目标平台和目标象限穿越次数均减少,目标象限停留时间缩短(P < 0.05)。移植组大鼠的目标象限停留时间长于模型组(P < 0.05);模型组与移植组之间的目标平台和目标象限穿越次数差异均无统计学意义(P > 0.05)。这些结果表明,hOPCs移植在一定程度上减轻了WMI大鼠的认知功能障碍,改善了神经系统的预后。见表 1~2。
| 表 1 各组大鼠定位航行实验逃避潜伏期比较(x±s,s) |
|
|
| 表 2 各组大鼠空间探索实验测试结果比较(x±s) |
|
|
为了评估WMI,通过电镜直接观察轴突的超微结构(图 2)。模型组髓鞘呈松散、分离和崩解的形态,有髓轴突数量减少;假手术组髓鞘完好,均匀,边界清晰;移植组部分髓鞘局部分离,结构大致完整,有髓轴突数量增加。各组g-ratio比较差异有统计学意义(F=153.100,P < 0.001)。与假手术组(0.672±0.010)相比,模型组大鼠的g-ratio(0.857±0.020)升高(P < 0.05),说明髓鞘厚度减小;与模型组相比,移植组的g-ratio(0.753±0.006)降低(P < 0.05),说明髓鞘厚度增加。提示hOPCs移植促进了WMI模型大鼠的髓鞘再生。
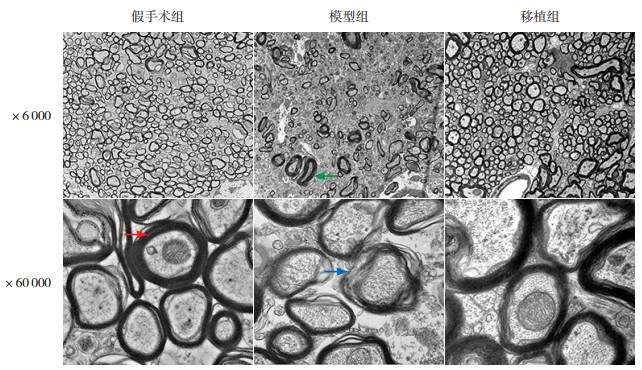
|
图 2 各组大鼠电镜下髓鞘形态 电镜图像显示,模型组髓鞘呈松散、分离和崩解的形态(蓝色箭头所示),有髓轴突(绿色箭头所示)数量减少;假手术组髓鞘完好,均匀,边界清晰,同心圆结构正常(红色箭头所示);移植组部分髓鞘局部分离,结构大致完整,有髓轴突数量增加。 |
随着早产儿的增加,容易引起远期神经功能损害的WMI的发生率也增加。许多研究报道WMI的典型表现是髓鞘脱失和髓鞘再生能力减弱[1]。人类多能干细胞hOPCs被证明在髓鞘形成和损伤后的髓鞘再生中发挥关键作用。作为一种低侵入性的治疗策略,小脑延髓池移植路径容易应用于临床。因此,为了探讨蛛网膜下腔移植hOPCs的治疗效果,本研究通过小脑延髓池将hOPCs移植到WMI大鼠的大脑中,通过行为测试评估大鼠神经功能,并通过电镜观察和评估大鼠髓鞘水平。结果显示,与模型组相比,移植hOPCs明显增强了移植组的髓鞘生成,改善了神经功能结局。这些结果提示,采用经蛛网膜下腔进行的hOPCs移植可能成为将来治疗WMI的新策略。
过去,hOPCs直接从人类胚胎干细胞诱导而来或使用流式细胞术检测其特异的表面标记物从供体脑组织中获得[15-16]。源自人类胚胎干细胞的细胞可能具有很强的致瘤性,而通过免疫分选则需要大量的供体脑组织以获得足够数量的细胞。在本实验室先前的研究中[9],根据细胞分化方案产生了高纯度的、特定神经细胞型的hOPCs,且此细胞培养方法具有高稳定性和可重复性。考虑将来临床使用,这些特性是必要的。因此,我们研究了hOPCs增强髓鞘再生和减轻WMI后神经功能障碍的能力。
细胞的脑移植有几种不同的途径,包括动静脉注射,腰椎穿刺后鞘内注射,脑实质内和脑室内注射。脑实质内和脑室内注射可直接将细胞移植到病变处,但炎症微环境会影响供体细胞的存活,并且有创的移植方式可能会对脑造成进一步损伤从而限制其临床应用。虽然全身给药如静脉和动脉注射是微创的,但移植细胞似乎受到血脑屏障的影响,很难到达脑损伤部位。由于注射部位位于脑脊液循环的末端,通过腰椎穿刺后的鞘内注射将细胞递送至目标区域的移植方式也可能受到限制。有研究报道[12],通过小脑延髓池移植后,大量的间充质干细胞可以迁移至脑实质并开始增殖。此外,也有研究发现[17],通过小脑延髓池移植的神经球细胞大约有三分之二出现在缺乏髓鞘纤维的区域。所以我们设想,炎症微环境可能促进移植细胞迁移到受损的脑组织,即我们注射到蛛网膜下腔的hOPCs可以选择性地进入到脑缺血区域。小脑延髓池穿刺是临床上用于脑脊液检查的常规医疗程序,操作简单、方便、安全。在临床应用中,移植手术应由经验丰富的医生进行,以避免手术失误造成损伤。
作为一种新的移植策略,通过小脑延髓池递送细胞方式的有效性在本研究中得到了验证。本研究结果显示,与模型组大鼠相比,经蛛网膜下腔移植的hOPCs促进了移植组大鼠认知功能的改善,与假手术组相比无明显差别。此外,电镜结果显示,与模型组大鼠相比,通过小脑延髓池进行hOPCs移植的大鼠髓鞘再生能力增强。同时,与假手术组相比,移植组g-ratio也无明显差异。这与先前报道的关于hOPCs移植的效果相当[8, 18]。
研究报道,hOPCs在移植后通过分化成少突胶质细胞,促进髓鞘形成和改善神经功能预后[18]。但是,其他研究表明,移植的hOPCs可以通过独立于靶细胞分化的机制,对神经元和少突胶质细胞产生保护作用[19-20]。然而,移植的hOPCs在体内迁移分化的情况和其改善行为功能的机制尚不清楚,有待于进一步的研究。
| [1] |
Back SA. White matter injury in the preterm infant: pathology and mechanisms[J]. Acta Neuropathol, 2017, 134(3): 331-349. DOI:10.1007/s00401-017-1718-6 (  0) 0) |
| [2] |
Bax M, Tydeman C, Flodmark O. Clinical and MRI correlates of cerebral palsy: the European Cerebral Palsy Study[J]. JAMA, 2006, 296(13): 1602-1608. DOI:10.1001/jama.296.13.1602 (  0) 0) |
| [3] |
Volpe JJ. Brain injury in premature infants: a complex amalgam of destructive and developmental disturbances[J]. Lancet Neurol, 2009, 8(1): 110-124. DOI:10.1016/S1474-4422(08)70294-1 (  0) 0) |
| [4] |
Back SA, Luo NL, Borenstein NS, et al. Late oligodendrocyte progenitors coincide with the developmental window of vulnerability for human perinatal white matter injury[J]. J Neurosci, 2001, 21(4): 1302-1312. DOI:10.1523/JNEUROSCI.21-04-01302.2001 (  0) 0) |
| [5] |
Billiards SS, Haynes RL, Folkerth RD, et al. Myelin abnormalities without oligodendrocyte loss in periventricular leukomalacia[J]. Brain Pathol, 2008, 18(2): 153-163. DOI:10.1111/j.1750-3639.2007.00107.x (  0) 0) |
| [6] |
Volpe JJ. Neurobiology of periventricular leukomalacia in the premature infant[J]. Pediatr Res, 2001, 50(5): 553-562. DOI:10.1203/00006450-200111000-00003 (  0) 0) |
| [7] |
Boulanger JJ, Messier C. From precursors to myelinating oligodendrocytes: contribution of intrinsic and extrinsic factors to white matter plasticity in the adult brain[J]. Neuroscience, 2014, 269: 343-366. DOI:10.1016/j.neuroscience.2014.03.063 (  0) 0) |
| [8] |
吴成君, 汪兆艳, 杨印祥, 等. 少突胶质前体细胞移植治疗早产儿脑白质损伤大鼠模型[J]. 中国当代儿科杂志, 2017, 19(9): 1003-1007. (  0) 0) |
| [9] |
Wang CY, Luan Z, Yang YX, et al. High purity of human oligodendrocyte progenitor cells obtained from neural stem cells: suitable for clinical application[J]. J Neurosci Methods, 2015, 240: 61-66. DOI:10.1016/j.jneumeth.2014.10.017 (  0) 0) |
| [10] |
Feng EC, Jiang L. Effects of leptin on neurocognitive and motor functions in juvenile rats in a preterm brain damage model[J]. Mol Med Rep, 2018, 18(4): 4095-4102. (  0) 0) |
| [11] |
Shen Y, Plane JM, Deng WB. Mouse models of periventricular leukomalacia[J]. J Vis Exp, 2010(39): 1951. (  0) 0) |
| [12] |
Choi JH, Chung JY, Yoo DY, et al. Cell proliferation and neuroblast differentiation in the rat dentate gyrus after intrathecal treatment with adipose-derived mesenchymal stem cells[J]. Cell Mol Neurobiol, 2011, 31(8): 1271-1280. DOI:10.1007/s10571-011-9729-7 (  0) 0) |
| [13] |
Vorhees CV, Williams MT. Morris water maze: procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc, 2006, 1(2): 848-858. DOI:10.1038/nprot.2006.116 (  0) 0) |
| [14] |
West KL, Kelm ND, Carson RP, et al. A revised model for estimating g-ratio from MRI[J]. Neuroimage, 2016, 125: 1155-1158. DOI:10.1016/j.neuroimage.2015.08.017 (  0) 0) |
| [15] |
Okamura RM, Lebkowski J, Au M, et al. Immunological properties of human embryonic stem cell-derived oligodendrocyte progenitor cells[J]. J Neuroimmunol, 2007, 192(1-2): 134-144. DOI:10.1016/j.jneuroim.2007.09.030 (  0) 0) |
| [16] |
Dietz KC, Polanco JJ, Pol SU, et al. Targeting human oligodendrocyte progenitors for myelin repair[J]. Exp Neurol, 2016, 283(Pt B): 489-500. (  0) 0) |
| [17] |
Mitome M, Low HP, Lora Rodriguez KM, et al. Neuronal differentiation of EGF-propagated neurosphere cells after engraftment to the nucleus of the solitary tract[J]. Neurosci Lett, 2008, 444(3): 250-253. DOI:10.1016/j.neulet.2008.08.050 (  0) 0) |
| [18] |
Windrem MS, Schanz SJ, Guo M, et al. Neonatal chimerization with human glial progenitor cells can both remyelinate and rescue the otherwise lethally hypomyelinated shiverer mouse[J]. Cell Stem Cell, 2008, 2(6): 553-565. DOI:10.1016/j.stem.2008.03.020 (  0) 0) |
| [19] |
Webber DJ, van Blitterswijk M, Chandran S. Neuroprotective effect of oligodendrocyte precursor cell transplantation in a long-term model of periventricular leukomalacia[J]. Am J Pathol, 2009, 175(6): 2332-2342. DOI:10.2353/ajpath.2009.090051 (  0) 0) |
| [20] |
Foote AK, Blakemore WF. Inflammation stimulates remyelination in areas of chronic demyelination[J]. Brain, 2005, 128(Pt 3): 528-539. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


