患儿男,1月龄,因左手抖动1周就诊。患儿惊厥发作形式为局灶起源的阵挛发作、强直发作。第2胎第2产,足月顺产,出生体重3.2 kg,身长50 cm,头围36 cm,生后无窒息、黄疸等。患儿生后无喂养困难,既往身体健康。患儿姐姐出生时出现喂养困难、尖叫、抽搐、昏迷,约半岁时夭折,父母身体健康,非近亲结婚。体格检查示生命体征平稳,头围36.5 cm,身长52 cm,前囟平软,张力正常,无明显特殊面容,心肺腹未见阳性体征,四肢活动正常,肌张力正常。辅助检查:血生化示尿酸11 μmol/L(参考值100~410 μmol/L),血常规、血氨、乳酸、心肌酶谱、尿有机酸分析、血串联质谱未见异常;脑脊液生化示蛋白0.57 g/L(参考值0.15~0.45 g/L),脑脊液常规、脑脊液培养未见异常。视频脑电图提示爆发-抑制倾向,发作开始右额-前额(F4~F8)中高幅尖波活动。头颅CT提示钙化、脑积水、囊化(图 1)。头颅MRI提示双侧额顶叶异常信号,考虑脑软化、萎缩、囊变,基底节丘脑受累,大脑半球广泛水肿信号(图 2)。入院诊断癫痫,因患儿起病早、惊厥频繁、颅脑病变重,结合姐姐有类似病史考虑遗传代谢性疾病不能排除,经患儿父母签署知情同意书后对患儿及其父母进行全外显子组测序分析。患儿住院期间予以营养神经、降颅压、丙戊酸钠(逐渐加量至每日40 mg/kg)联合托吡酯(逐渐加量至每日5 mg/kg)抗癫痫治疗。治疗后患儿癫痫发作频率较前明显减少,予以出院。出院后基因检测结果示该患儿存在MOCS1 基因(NM_001075098)c.217C > T(p.R73W)纯合变异,变异遗传自患儿的父亲和母亲(图 3)。依据美国医学遗传学与基因组学学会遗传变异分类标准与指南,该变异判定为“可能致病的”。故该患儿诊断为钼辅酶缺乏症(MoCD)A型。
|
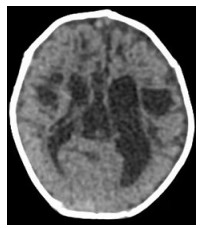
图 1 患儿1月龄头颅CT 左侧脑室扩大及颞叶囊化。 |
|
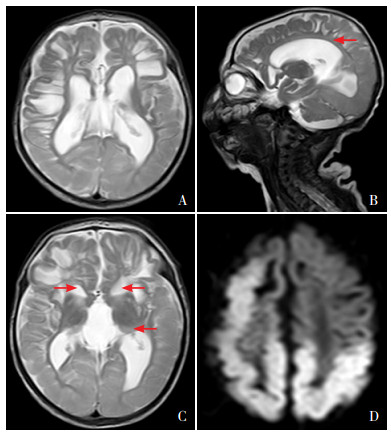
图 2 患儿1月龄头颅MRI A:横断位双侧额叶片状T2高信号,提示软化、萎缩、囊变;B:矢状位T2WI见胼胝体变薄(箭头所示);C:横断位基底节多发T2高信号(箭头所示);D:扩散加权成像可见大脑半球广泛水肿信号。 |
|
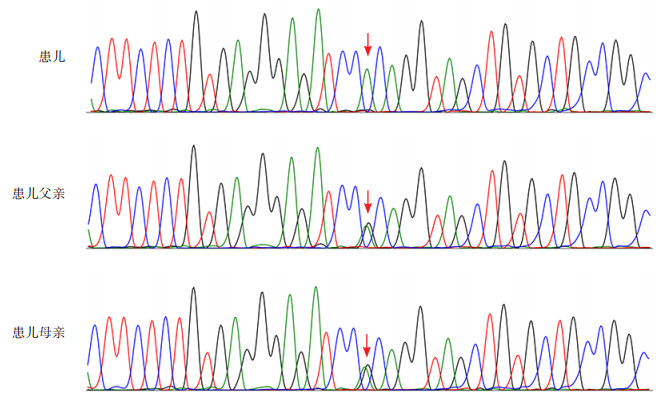
图 3 患儿及其父母MOCS1基因Sanger测序图 患儿存在MOCS1基因(NM_001075098)c.217C > T(p.R73W)纯合变异,分别来源于父母。箭头所示变异位置。 |
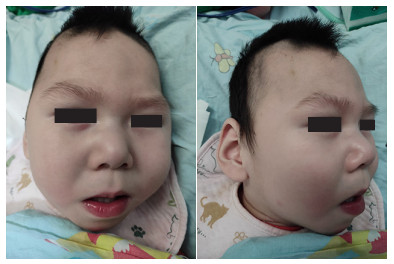
患儿出院后惊厥逐渐减少,1~2个月后无惊厥发作,出院后9个月(10月龄)患儿家属自行停抗癫痫药物。出院后患儿逐渐出现全面发育迟缓、小头畸形、特殊面容(长脸、长额头、前额隆起、长人中、低鼻梁、颜面部浮肿、厚下嘴唇,图 4)、反复难治性肺炎。院外长期行康复治疗,效果欠佳,1岁6月龄抬头不稳,不能翻身、主动抓物,不会喊“baba、mama”,双下肢及背部肌张力增高。
|
图 4 患儿特殊面容 小头畸形,长脸,长额头,前额隆起,长人中,低鼻梁,颜面部浮肿,厚下嘴唇。 |
讨论:MoCD是一种儿童期起病的严重的罕见常染色体隐性遗传的神经代谢性疾病,该病于1978年首次报道。钼辅酶由MOCS1、MOCS2、MOCS3和GPHN基因介导,根据生物合成通路中缺陷位点不同,MoCD分为A、B、C三种不同类型,其中A型(MOCS1基因突变)最常见(超过60%),但不同类型临床表型严重程度无显著差异[1-3]。MOCS1基因突变位点约40多个[4],对应临床表现均为MoCD A型,无其他相关疾病报道,表型稳定,R319Q是MOCS1基因最常见的突变位点[5]。钼辅酶对黄嘌呤氧化酶、亚硫酸氧化酶、醛氧化酶、线粒体相关酶的活性至关重要。而黄嘌呤氧化酶在嘌呤代谢中将黄嘌呤和次黄嘌呤转变成尿酸的过程中发挥重要作用,亚硫酸氧化酶是解毒亚硫酸过程中的终端酶,亚硫酸异常聚集导致快速进行性神经元丧失,最终致死,与罕见的孤立亚硫酸盐氧化酶缺乏类似。因此,特异性生化检查是诊断MoCD的重要工具,尿酸水平明显下降,尿嘌呤代谢物即黄嘌呤和次黄嘌呤显著增高。尿亚硫酸、硫胱氨酸和代硫酸盐排出增加(图 5)。
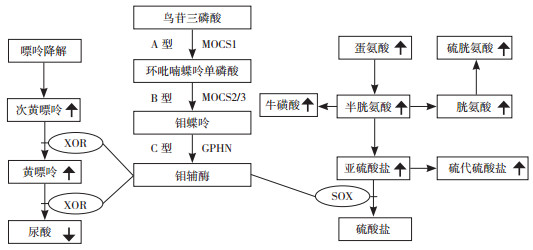
|
图 5 钼辅酶生物合成通路中的主要步骤及受钼辅酶缺乏影响的主要代谢产物[4] [XOR]黄嘌呤氧化酶;[SOX]亚硫酸氧化酶。鸟苷三磷酸通过MOCS1转变为环吡喃蝶呤单磷酸,随后通过MOCS2和MOCS3代谢为钼蝶呤;GPHN介导钼蝶呤转化为钼辅酶。 |
MoCD典型临床表现包括新生儿期出现难治性癫痫、特殊面容、严重的精神运动发育迟缓、喂养困难、小头畸形、肌张力异常及早期死亡等[1, 6-7]。发病率未知,估计活产新生儿比例为1/(100 000~200 000)[8]。国内目前尚无MoCD临床病例报道,本例患儿新生儿期出现癫痫,尿酸明显下降,有脑软化、萎缩、囊变和基底节丘脑受累,婴儿期出现严重全面性发育迟缓、小头畸形、特殊面容等表现,基因检查明确诊断为MoCD A型(MOCS1基因相关),与国外报道的MoCD病例特征[9]相符。大部分MoCD患儿存活时间一般为一周到几个月之内。在少数超过数月的病例中,患儿表现为严重全面发育迟缓、四肢瘫痪、卧床休息和非常差的生活质量。
MoCD患儿由于亚硫酸盐的积累,新生儿期头颅CT表现为弥漫性脑水肿,随着疾病进展,大脑半球出现多囊性变性,丘脑和或基底节均可发现钙化。头颅MRI可表现为皮质下囊性改变、脑软化、白质胶质细胞增生和脑萎缩,其表现为脑室和脑沟扩大、胼胝体变薄等。头颅MRI表现可与缺氧性缺血性脑病相鉴别[9]。多灶性癫痫样放电和爆发-抑制的脑电图提示广泛脑损伤[2]。
MoCD预后差。既往众多的治疗方法如补充钼料、低蛋氨酸饮食等[4]疗效不佳,但2015年Lancet报道MoCD A型已成为一种可治疗的疾病,环吡喃蝶呤单磷酸(cPMP)替代疗法是第一种有效的疗法,具有良好的安全性。在出现严重脑病之前,用cPMP恢复钼辅助因子依赖性酶的活性,可获得良好的长期发育结果。即使出现严重脑病之后治疗,也可减轻症状[3]。目前美国食品和药物监督管理局已受理Fosdenopterin(cPMP替代疗法)用于治疗MoCD A型患者的新药申请及优先审查[10]。
综上,对表现为新生儿期难治性癫痫发作、全面发育迟缓、喂养困难、考虑缺氧性缺血性脑病患儿,MoCD应作为其鉴别诊断。小头畸形、多囊性脑损伤及尿酸水平降低可为其诊断提供线索。为明确该病,应进行分子遗传学检测。早期诊断对及时进行治疗十分关键,确诊患儿家系必须进行精准遗传学咨询。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Alonzo Martínez MC, Cazorla E, Cánovas E, et al. Molybdenum cofactor deficiency: mega cisterna magna in two consecutive pregnancies and review of the literature[J]. Appl Clin Genet, 2020, 13: 49-55. DOI:10.2147/TACG.S239917 (  0) 0) |
| [2] |
Hitzert MM, Bos AF, Bergman KA, et al. Favorable outcome in a newborn with molybdenum cofactor type A deficiency treated with cPMP[J]. Pediatrics, 2012, 130(4): e1005-e1010. DOI:10.1542/peds.2011-3330 (  0) 0) |
| [3] |
Schwahn BC, Van Spronsen FJ, Belaidi AA, et al. Efficacy and safety of cyclic pyranopterin monophosphate substitution in severe molybdenum cofactor deficiency type A: a prospective cohort study[J]. Lancet, 2015, 386(10007): 1955-1963. DOI:10.1016/S0140-6736(15)00124-5 (  0) 0) |
| [4] |
Reiss J, Hahnewald R. Molybdenum cofactor deficiency: mutations in GPHN, MOCS1, and MOCS2[J]. Hum Mutat, 2011, 32(1): 10-18. DOI:10.1002/humu.21390 (  0) 0) |
| [5] |
Reiss J, Christensen E, Kurlemann G, et al. Genomic structure and mutational spectrum of the bicistronic MOCS1 gene defective in molybdenum cofactor deficiency type A[J]. Hum Genet, 1998, 103(6): 639-644. DOI:10.1007/s004390050884 (  0) 0) |
| [6] |
Nagappa M, Bindu PS, Taly AB, et al. Child neurology: molybdenum cofactor deficiency[J]. Neurology, 2015, 85(23): e175-e178. DOI:10.1212/WNL.0000000000002194 (  0) 0) |
| [7] |
Scelsa B, Gasperini S, Righini A, et al. Mild phenotype in molybdenum cofactor deficiency: a new patient and review of the literature[J]. Mol Genet Genomic Med, 2019, 7(6): e657. (  0) 0) |
| [8] |
Sass JO, Gunduz A, Araujo Rodrigues Funayama C, et al. Functional deficiencies of sulfite oxidase: differential diagnoses in neonates presenting with intractable seizures and cystic encephalomalacia[J]. Brain Dev, 2010, 32(7): 544-549. DOI:10.1016/j.braindev.2009.09.005 (  0) 0) |
| [9] |
Zaki MS, Selim L, El-Bassyouni HT, et al. Molybdenum cofactor and isolated sulphite oxidase deficiencies: clinical and molecular spectrum among Egyptian patients[J]. Eur J Paediatr Neurol, 2016, 20(5): 714-722. DOI:10.1016/j.ejpn.2016.05.011 (  0) 0) |
| [10] |
BridgeBio Pharma, Inc. . Nulibry: treatment for molybdenum cofactor seficiency (MoCD) type A[EB/OL]. (2019-12-03)[2021-02-24]. https://www.drugs.com/nda/bbp_870_191203.html.
(  0) 0) |
 2021, Vol. 23
2021, Vol. 23

