2. 吉林大学第一医院发育行为儿科, 吉林长春 130031;
3. 哈尔滨医科大学公共卫生学院儿少卫生与妇幼保健学教研室, 黑龙江哈尔滨 150001;
4. 华中科技大学同济医学院附属同济医院儿童保健科, 湖北武汉 430030;
5. 海南省妇女儿童医学中心儿童保健部, 海南海口 570206;
6. 西安市儿童医院儿童保健中心, 陕西西安 710003;
7. 南京医科大学附属脑科医院, 江苏南京 210000;
8. 青岛大学附属医院儿童保健科, 山东青岛 266000;
9. 深圳市宝安区妇幼保健院, 广东深圳 518000;
10. 上海市儿童医院儿童保健科, 上海 200000;
11. 郑州大学附属儿童医院儿童保健科, 河南郑州 450018;
12. 湖南省妇幼保健院, 湖南长沙 410008;
13. 德阳市妇幼保健院, 四川德阳 618000;
14. 首都儿科研究所附属儿童医院保健科, 北京 100020
孤独症谱系障碍(autism spectrum disorder, ASD)是一组以社会交往障碍、重复刻板行为和兴趣狭窄为主要特征的神经发育性障碍疾病[1-2]。ASD儿童的患病率逐年上升,最新文献报道美国8岁儿童中ASD的患病率是1/54[3],国内6~12岁儿童中ASD的患病率为0.7%[4]。多数研究表明遗传、环境和免疫因素在ASD的病因中发挥着重要作用[5-8],但其机制尚未阐明。研究表明营养素是一种重要的环境因子,可能与ASD的发病有关[9]。
与正常儿童相比,ASD儿童存在更多的进食行为问题,主要表现在挑食、偏好某种食物及刻板的进食行为等方面,因此ASD儿童更容易出现营养素的缺乏[10]。微量元素在维持中枢神经系统的正常结构和主要功能方面起着重要作用,此外,与人体免疫系统、生长发育和智能发育等密切相关[11-13]。国内外研究显示,ASD儿童的血清钙、锌、铁水平显著低于正常儿童[14-16]。但也有研究报道ASD儿童的铁含量显著高于对照组[17]。这些研究结果不一,可能是由于样本量较小,纳入的研究对象局限于单一地区,代表性较欠缺。此外,对于ASD儿童的微量元素水平与核心症状的相关性研究,国内尚未报道。因此,本研究通过全国多中心、大样本调查探讨ASD儿童与正常儿童常见微量元素镁、铁、铜、锌血清水平的差异,并进一步探讨其水平与ASD儿童核心症状的相关性,为临床监测和干预ASD儿童的营养状况提供依据。
1 资料与方法 1.1 研究对象研究对象来自“全国孤独症谱系障碍儿童营养规范管理多中心研究”。该项目已获得重庆医科大学附属儿童医院医学伦理委员会的批准(批号:121-1/2018),并在中国临床试验中心(http://www.chictr.org.cn/index.aspx)注册(ChiCTR2000031194),所有参与本研究的儿童家长均已签署知情同意书。
样本量的计算:按两独立样本均数比较的研究设计计算样本量。镁、铁、铜、锌的均值和标准差均参考既往文献里的相应数值[15, 18],取α=0.05,1-β=0.9,应用PASS 11软件进行计算,得出每组所需样本量为475例。
2018年9月至2019年9月在中国13个城市三级甲等医院门诊和特殊教育机构招募2~7岁1 342名ASD儿童和1 293名正常儿童,最初总共纳入2 635名儿童。其中165名儿童未收集到血清标本,并对儿童进行性别、年龄的匹配,最终纳入1 020名ASD儿童(ASD组)和1 038名正常儿童(对照组)。13个城市来自中国的东部(上海和南京)、西部(重庆、德阳和西安)、南部(深圳、海口和长沙)、北部(哈尔滨、青岛和长春)和中部(武汉和郑州)地区。调查对象纳入流程见图 1。
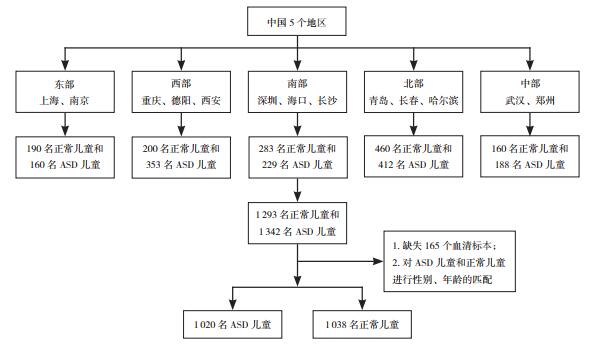
|
图 1 调查对象纳入流程图 |
ASD组:由两位临床经验丰富的发育行为及儿童保健科医师根据《精神障碍诊断和统计手册》(DSM-5)[19]对患儿进行ASD确诊。排除标准:(1)脑损伤;(2)严重躯体和感觉障碍(盲、聋);(3)独立的神经发育障碍疾病和神经系统疾病;(4)其他急慢性疾病;(5)过去半年内使用过营养素补充剂。
对照组排除标准:(1)发育行为障碍性疾病、神经精神病;(2)先天性疾病、急慢性感染性疾病等;(3)食物或药物过敏;(4)过去半年内使用过营养补充剂;(5)严重营养不良。
1.2 血清微量元素的测定在清晨空腹状态下抽取静脉血2~3 mL置于红头管中,常温放置1~2 h或在37℃水浴条件下放置0.5~1 h,然后用高速离心机以3 000 r/min离心10 min,取0.7 mL上层血清放入普通EP管中,统一用干冰运输到北京和合医学检验所有限公司进行检测。采用电感耦合等离子体质谱法[20]测量血清镁、铁、铜、锌的浓度,检测仪器的型号是API3200(美国)。
1.3 孤独症行为量表孤独症行为量表(Autism Behaviour Checklist, ABC)[21]适用于8个月至28岁ASD患者的筛查和辅助诊断,由家长填写。该量表包括57项ASD儿童的行为症状表现,归纳为感觉能力、交往能力、躯体运动能力、语言、生活自理5个因子。每项分别评分1、2、3、4分共4个等级。总分≥53分作为ASD筛查界限分,总分≥67分作为ASD阳性界限分。
1.4 社交反应量表社交反应量表(Social Responsiveness Scale, SRS)[22]用于评估4~18岁ASD儿童的日常社交情况,由家长填写。该量表包括65个项目,由社交知觉、社交认知、社交沟通、社交动机及孤独症行为方式等5个分项组成。每个项目包含1、2、3、4分共4个等级评分。总分 > 65分为ASD筛查阳性。
1.5 孤独症评定量表孤独症评定量表(Childhood Autism Rating Scale, CARS)[21]适用于2岁以上ASD儿童的症状评估,包括15个项目。由经过培训的人员进行评估,每项包含1、2、3、4分4个等级评分。若总分为30~36分,且低于3分的项目不到5项,提示轻-中度ASD;若总分 > 36分且至少5项的评分高于3分,提示重度ASD。
1.6 质量控制调查前对研究人员进行统一培训,统一调查方法和标准。数据录入采用双录入法,以保证数据的准确性。
1.7 统计学分析采用SPSS 25.0软件进行统计学分析。正态性检验用Kolmogorow-Smirnov方法,符合正态分布或近似正态分布的计量资料以均数±标准差(x±s)表示,不符合正态分布的计量资料采用中位数(四分位数间距)[M(P25,P75)]表示。符合正态分布且方差齐的两组间数据的比较采用两样本t检验,不符合正态分布的计量资料两组间的比较采用Mann-Whitney U检验。计数资料以例数和百分率[n(%)]表示,两组间计数资料的比较采用χ2检验。采用偏相关分析法(控制年龄和性别两个变量)评估血清微量元素水平与ABC和SRS量表评分的关系。P < 0.05为差异有统计学意义。
2 结果 2.1 基本情况ASD组共1 020名儿童,年龄2~7岁,男性占76.57%(781/1 020);对照组1 038名儿童,年龄2~7岁,男性占76.20%(791/1 038)。两组性别、年龄的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 ASD组和对照组的基本资料 |
|
|
ASD组儿童血清镁、铜、锌水平明显低于对照组(均P < 0.05),而两组血清铁水平比较差异无统计学意义(P > 0.05),见表 2。
| 表 2 ASD组和对照组血清微量元素水平的比较[M(P25,P75),mg/L] |
|
|
重度ASD儿童血清镁和锌水平显著低于轻-中度ASD儿童(均P < 0.05),见表 3。
| 表 3 轻-中度和重度ASD儿童血清微量元素水平的比较[M(P25,P75),mg/L] |
|
|
偏相关分析显示,ASD儿童的各血清微量元素水平与SRS量表总分及各分项得分均无明显相关性(P > 0.05)。血清镁水平与ABC量表总分和交往能力得分均呈负相关(分别r=-0.318,P < 0.001;r=-0.282,P < 0.001);血清锌水平与ABC量表总分、交往能力得分及躯体运动得分均呈负相关(分别r=-0.221,P < 0.001;r=-0.270,P < 0.001;r=-0.207,P < 0.001)。见表 4。
| 表 4 ASD儿童的血清微量元素水平与SRS和ABC量表得分的相关性 |
|
|
ASD病因复杂,其发病机制至今尚不清楚。微量元素作为酶的辅助因子,在调节机体生理功能方面发挥着重要作用。锌、铜等微量元素在维持神经系统功能中起着重要作用,在人体中其含量过低或过高可能会导致发育障碍的发生。据文献报道,儿童体内铜、锌和硒等微量元素水平的稳态失调,可能会增加ASD儿童的患病风险[23-25]。本研究通过全国多中心、大样本调查探讨ASD儿童常见微量元素镁、铁、铜、锌的血清水平,并采用ABC、SRS、CARS量表对ASD儿童的核心症状进行评估,探讨ASD儿童常见微量元素与其核心症状间的联系,为临床干预提供依据。
本研究对ASD组和对照组儿童的血清微量元素水平进行比较时,发现ASD儿童的血清镁、铜、锌水平显著低于对照组。Wu等[15]和Crăciun等[26]研究也发现ASD儿童的血清锌水平显著低于正常儿童,本研究结果与之相一致。ASD儿童锌缺乏可能是多种因素造成的,其具体机制尚未研究清楚,可能是由于ASD儿童特殊的饮食行为问题,比如挑食、拒绝尝试新的食物等[10],引起锌摄入量不足。本研究结果表明,ASD儿童的血清镁水平显著低于正常儿童,姚梅玲等[18]对50例ASD儿童全血中微量元素含量进行分析时也得到了同样的结果。此外,Saghazadeh等[16]对ASD儿童微量元素水平进行Meta分析时,其研究结果也表明ASD患者血清镁水平低于对照组。Skalny等[27]对ASD儿童体内镁含量的一项研究中,提出头发和尿液中的镁含量可能是神经发育性障碍的重要预测指标。本研究发现ASD儿童血清铜水平明显低于正常儿童,与Skalny等[17]的研究结果一致。
本研究发现重度ASD儿童的血清镁、锌水平明显低于轻-中度ASD儿童,提示低水平的镁、锌可能会加重ASD儿童的严重程度。Fiore等[28]的研究也发现锌与ASD儿童的严重程度呈负相关。一项关于印度ASD儿童队列的研究结果表明,头发中的镁含量与ASD严重程度呈反比关系[29]。此外,本研究对ASD儿童血清微量元素水平与核心症状进行相关性分析发现,血清镁水平与ABC量表总分、交往能力得分呈负相关,血清锌水平与ABC量表总分、交往能力得分及躯体运动得分呈负相关,提示镁、锌可能与ASD儿童的核心症状有关。研究表明锌在维持大脑正常功能中发挥着重要作用,主要参与神经元的形成、迁移和分化。此外,锌可能会影响神经元的兴奋性突触活动,引起ASD儿童出现相关的行为异常[25]。镁在维持大脑的功能作用和调节情绪中起着关键作用,被认为是参与神经发育和神经元成熟的重要因素[30]。并涉及数百种酶促反应,参与细胞内信号传递,以及调节5-羟色胺、多巴胺和胆碱等神经递质的传递[31]。相关研究表明低镁水平可能导致γ-氨基丁酸能信号受损,增加ASD的发病风险[16]。
本研究是一个全国多中心大样本的研究,最初收集到2 615例样本,由于部分儿童,尤其ASD儿童抽血时不配合导致样本出现溶血情况,致使15%样本损失;另外,我们并未研究其他微量元素对ASD儿童的影响,例如硒、锰、钴等元素。本研究是基于一个全国多中心研究的部分内容,通过大样本的横断面调查,发现ASD儿童的血清镁、铜、锌含量较低,血清镁和锌水平与ASD儿童的核心症状具有一定关联,但这种关联的意义需要进一步研究。临床上应注意监测ASD儿童的微量元素营养状况,有针对性地进行个体干预。
| [1] |
Lord C, Elsabbagh M, Baird G, et al. Autism spectrum disorder[J]. Lancet, 2018, 392(10146): 508-520. DOI:10.1016/S0140-6736(18)31129-2 (  0) 0) |
| [2] |
Hyman SL, Levy SE, Myers SM, et al. Identification, evaluation, and management of children with autism spectrum disorder[J]. Pediatrics, 2020, 145(1): e20193447. DOI:10.1542/peds.2019-3447 (  0) 0) |
| [3] |
Maenner MJ, Shaw KA, Baio J, et al. Prevalence of autism spectrum disorder among children aged 8 years-Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2016[J]. MMWR Surveill Summ, 2020, 69(4): 1-12. DOI:10.15585/mmwr.ss6904a1 (  0) 0) |
| [4] |
Zhou H, Xu X, Yan WL, et al. Prevalence of autism spectrum disorder in China: a nationwide multi-center population-based study among children aged 6 to 12 years[J]. Neurosci Bull, 2020, 36(9): 961-971. DOI:10.1007/s12264-020-00530-6 (  0) 0) |
| [5] |
Bölte S, Girdler S, Marschik PB. The contribution of environmental exposure to the etiology of autism spectrum disorder[J]. Cell Mol Life Sci, 2019, 76(7): 1275-1297. DOI:10.1007/s00018-018-2988-4 (  0) 0) |
| [6] |
Tammimies K. Genetic mechanisms of regression in autism spectrum disorder[J]. Neurosci Biobehav Rev, 2019, 102: 208-220. DOI:10.1016/j.neubiorev.2019.04.022 (  0) 0) |
| [7] |
Chaste P, Leboyer M. Autism risk factors: genes, environment, and gene-environment interactions[J]. Dialogues Clin Neurosci, 2012, 14(3): 281-292. DOI:10.31887/DCNS.2012.14.3/pchaste (  0) 0) |
| [8] |
Liu XM, Li ZW, Fan CH, et al. Genetics implicate common mechanisms in autism and schizophrenia: synaptic activity and immunity[J]. J Med Genet, 2017, 54(8): 511-520. (  0) 0) |
| [9] |
Fujiwara T, Morisaki N, Honda Y, et al. Chemicals, nutrition, and autism spectrum disorder: a mini-review[J]. Front Neurosci, 2016, 10: 174. (  0) 0) |
| [10] |
Bandini LG, Curtin C, Phillips S, et al. Changes in food selectivity in children with autism spectrum disorder[J]. J Autism Dev Disord, 2017, 47(2): 439-446. DOI:10.1007/s10803-016-2963-6 (  0) 0) |
| [11] |
Maywald M, Wessels I, Rink L. Zinc signals and immunity[J]. Int J Mol Sci, 2017, 18(10): 2222. DOI:10.3390/ijms18102222 (  0) 0) |
| [12] |
Maggini S, Pierre A, Calder PC. Immune function and micronutrient requirements change over the life course[J]. Nutrients, 2018, 10(10): 1531. DOI:10.3390/nu10101531 (  0) 0) |
| [13] |
Martínez de Victoria E. Calcium, essential for health[J]. Nutr Hosp, 2016, 33(Suppl 4): 341. (  0) 0) |
| [14] |
Guo M, Li L, Zhang Q, et al. Vitamin and mineral status of children with autism spectrum disorder in Hainan Province of China: associations with symptoms[J]. Nutr Neurosci, 2020, 23(10): 803-810. DOI:10.1080/1028415X.2018.1558762 (  0) 0) |
| [15] |
Wu LL, Mao SS, Lin X, et al. Evaluation of whole blood trace element levels in Chinese children with autism spectrum disorder[J]. Biol Trace Elem Res, 2019, 191(2): 269-275. DOI:10.1007/s12011-018-1615-4 (  0) 0) |
| [16] |
Saghazadeh A, Ahangari N, Hendi K, et al. Status of essential elements in autism spectrum disorder: systematic review and meta-analysis[J]. Rev Neurosci, 2017, 28(7): 783-809. DOI:10.1515/revneuro-2017-0015 (  0) 0) |
| [17] |
Skalny AV, Mazaletskaya AL, Ajsuvakova OP, et al. Hair trace element concentrations in autism spectrum disorder (ASD) and attention deficit/hyperactivity disorder (ADHD)[J]. J Trace Elem Med Biol, 2020, 61: 126539. DOI:10.1016/j.jtemb.2020.126539 (  0) 0) |
| [18] |
姚梅玲, 刘随成, 孔德荣, 等. 50例儿童孤独症全血中微量元素含量分析[J]. 河南预防医学杂志, 2012, 23(3): 161-162. (  0) 0) |
| [19] |
American Psychiatric Association, DSM-5 Task Force. Diagnostic and Statistical Manual of Mental Disorders: (DSM-5)[M]. 5th ed. Washington: American Psychological Association, 2013.
(  0) 0) |
| [20] |
陈杭亭, 曾宪津, 曹淑琴. 电感耦合等离子体质谱方法在生物样品分析中的应用[J]. 分析化学, 2001, 29(5): 592-600. DOI:10.3321/j.issn:0253-3820.2001.05.025 (  0) 0) |
| [21] |
Rellini E, Tortolani D, Trillo S, et al. Childhood Autism Rating Scale (CARS) and Autism Behavior Checklist (ABC) correspondence and conflicts with DSM-IV criteria in diagnosis of autism[J]. J Autism Dev Disord, 2004, 34(6): 703-708. DOI:10.1007/s10803-004-5290-2 (  0) 0) |
| [22] |
Cen CQ, Liang YY, Chen QR, et al. Investigating the validation of the Chinese Mandarin version of the Social Responsiveness Scale in a Mainland China child population[J]. BMC Psychiatry, 2017, 17(1): 51. DOI:10.1186/s12888-016-1185-y (  0) 0) |
| [23] |
Schofield K. The metal neurotoxins: an important role in current human neural epidemics?[J]. Int J Environ Res Public Health, 2017, 14(12): 1511. DOI:10.3390/ijerph14121511 (  0) 0) |
| [24] |
El-Ansary A, Bjørklund G, Tinkov AA, et al. Relationship between selenium, lead, and mercury in red blood cells of Saudi autistic children[J]. Metab Brain Dis, 2017, 32(4): 1073-1080. DOI:10.1007/s11011-017-9996-1 (  0) 0) |
| [25] |
Grabrucker S, Jannetti L, Eckert M, et al. Zinc deficiency dysregulates the synaptic ProSAP/Shank scaffold and might contribute to autism spectrum disorders[J]. Brain, 2014, 137(Pt 1): 137-152. (  0) 0) |
| [26] |
Crăciun EC, Bjørklund G, Tinkov AA, et al. Evaluation of whole blood zinc and copper levels in children with autism spectrum disorder[J]. Metab Brain Dis, 2016, 31(4): 887-890. DOI:10.1007/s11011-016-9823-0 (  0) 0) |
| [27] |
Skalny AV, Mazaletskaya AL, Ajsuvakova OP, et al. Magnesium status in children with attention-deficit/hyperactivity disorder and/or autism spectrum disorder[J]. Soa Chongsonyon Chongsin Uihak, 2020, 31(1): 41-45. (  0) 0) |
| [28] |
Fiore M, Barone R, Copat C, et al. Metal and essential element levels in hair and association with autism severity[J]. J Trace Elem Med Biol, 2020, 57: 126409. DOI:10.1016/j.jtemb.2019.126409 (  0) 0) |
| [29] |
Lakshmi Priya MD, Geetha A. Level of trace elements (copper, zinc, magnesium and selenium) and toxic elements (lead and mercury) in the hair and nail of children with autism[J]. Biol Trace Elem Res, 2011, 142(2): 148-158. DOI:10.1007/s12011-010-8766-2 (  0) 0) |
| [30] |
Mousain-Bosc M, Siatka C, Bali JP. Magnesium, Hyperactivity and Autism in Children[M]. Adelaide: University of Adelaide Press, 2011: 283-302.
(  0) 0) |
| [31] |
Botturi A, Ciappolino V, Delvecchio G, et al. The role and the effect of magnesium in mental disorders: a systematic review[J]. Nutrients, 2020, 12(6): 1661. DOI:10.3390/nu12061661 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


