先天性甲状腺功能减低症(congenital hypothyroidism, CH)是新生儿常见先天性内分泌疾病,主要由甲状腺发育异常或功能缺陷引起,可导致儿童严重智力和体格发育障碍[1]。CH在全球的发病率为20/10万~200/10万[2-4]。近年来,随着国内外新生儿CH筛查的广泛开展,多个国家/地区CH发病率呈明显上升趋势[5-6]。我国大陆新生儿CH发病率为41.3/10万[7]。CH发病机制尚未明确,通过对该病危险因素的识别、干预可降低其发病率[8]。目前国内外已有大量研究报道新生儿CH危险因素,但研究结论存在争议[9]。本研究收集国内外有关新生儿CH危险因素的文献进行Meta分析,为新生儿CH的预防提供参考依据。
1 资料与方法 1.1 文献检索以“congenital hypothyroidism”“risk factor”“risk”“先天性甲状腺功能减低症”“先天性甲状腺功能减退症”“先天性甲状腺功能低下症”“先天性甲减”“危险因素”“影响因素”为检索词,系统检索PubMed、Web of Science、Embase、Elsevier/ScienceDirect、SpringerLink、中国生物医学文献数据库、中国知网、万方数据库、维普中文期刊数据库等数据库自建库至2020年8月1日发表的有关新生儿CH影响因素的研究。语言种类限定为中文和英文,辅以手工检索及文献追溯。
1.2 文献纳入标准和排除标准纳入标准:(1)以上各数据库建库开始至2020年8月1日前有关CH影响因素的原创性研究;(2)研究设计类型为病例对照研究或者研究人群分为病例组和对照组,并对两组暴露因素进行比较的现况或回顾性研究;(3)各研究疾病诊断标准和暴露因素定义及量化基本一致;(4)文献直接或间接提供暴露因素的OR(95%CI)。
排除标准:(1)研究对象非新生儿;(2)病例报道、会议摘要、评论和综述类文章;(3)研究质量差,资料收集不科学,无法获得数据的文献;(4)重复发表文献。
1.3 文献资料提取和质量评价由两名研究人员严格按照纳入标准和排除标准独立进行文献筛选、质量评价、数据提取,并且交叉核对结果。若出现不一致,通过讨论解决。文献资料提取包括第一作者姓名、发表年份、研究时间、研究地区、研究设计类型、病例组和对照组人数、暴露因素及其OR(95%CI)。采用Newcastle-Ottawa Scale(NOS)量表对病例对照研究进行质量评价,NOS评分≥ 6分为高质量研究;采用美国卫生保健质量和研究机构(AHRQ)推荐的横断面研究评价标准对现况调查文献进行评价,评分≥ 8分为高质量文献[10]。
1.4 统计学分析应用R 3.6.2软件进行统计学分析。森林图的制作采用RevMan 5.3软件。效应量为新生儿CH影响因素的OR值及其95%CI。采用Q检验和I2统计量评价研究间的异质性,若P < 0.1表明存在异质性,I2 > 50%则异质性较大,采用随机效应模型进行分析;反之,采用固定效应模型分析。通过比较不同效应模型合并值的差异,分析研究结果的敏感性。运用漏斗图和Egger's线性回归评估潜在发表偏移。
2 结果 2.1 纳入文献的基本情况初步检索共获得文献394篇,根据纳入标准和排除标准,经筛选最终纳入20篇文献[11-30],其中中文文献12篇[11-22],英文文献8篇[23-30]。文献筛选流程及结果见图 1。纳入文献研究地点来自中国、澳大利亚、意大利、伊朗、埃及、巴基斯坦等6个国家;总样本量合计11 564人,其中病例组3 579人,对照组7 985人;13篇病例对照研究中10篇为高质量研究,7篇现况调查均为高质量研究。纳入文献的基本情况见表 1。

|
图 1 文献筛选流程图 |
| 表 1 纳入文献的基本情况 |
|
|
根据纳入文献涉及的新生儿CH影响因素,选择12个母亲相关因素和7个胎儿相关因素进行分析。异质性分析结果表明:妊娠期焦虑、妊娠期抽烟、妊娠期接触辐射、甲状腺疾病家族史、低出生体重、巨大儿、早产儿、出生缺陷等8个因素在不同研究间异质性较小(I2 < 50%),采用固定效应模型分析,其他因素在不同研究间异质性较大(I2 > 50%),采用随机效应模型分析。Meta分析结果显示,妊娠合并高血压、妊娠期抽烟、近亲结婚史、不良生育史、分娩方式、胎儿性别与新生儿CH的关联无统计学意义(P > 0.05);母亲高龄、妊娠合并甲状腺疾病、妊娠糖尿病、妊娠期焦虑、妊娠期用药、妊娠期接触辐射、甲状腺疾病家族史、低出生体重、巨大儿、早产儿、过期产儿、双胎及多胎、出生缺陷是新生儿CH的危险因素(P < 0.05)。分析结果见表 2和图 2~7。
| 表 2 新生儿CH危险因素异质性检验和Meta分析结果 |
|
|
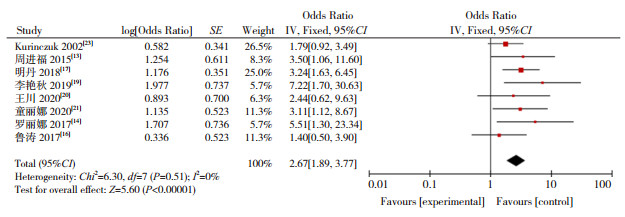
|
图 2 低出生体重与CH发病关系的森林图 |

|
图 3 巨大儿与CH发病关系的森林图 |
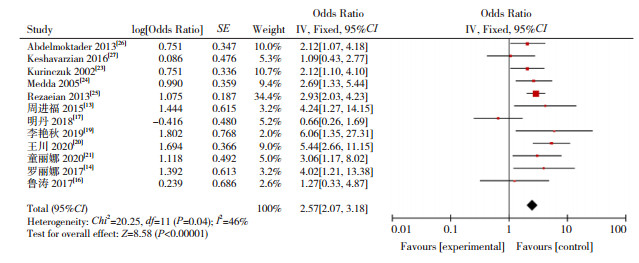
|
图 4 早产儿与CH发病关系的森林图 |
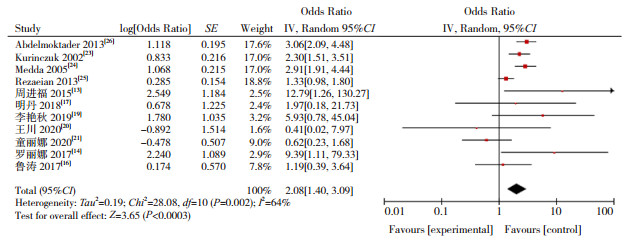
|
图 5 过期产儿与CH发病关系的森林图 |
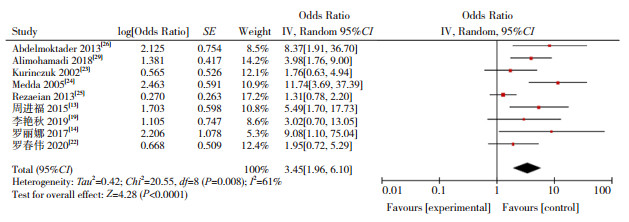
|
图 6 双胎及多胎与CH发病关系的森林图 |
|
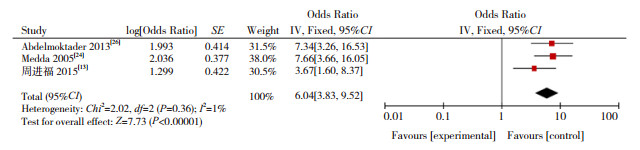
图 7 出生缺陷与CH发病关系的森林图 |
各危险因素固定效应和随机效应两种模型合并效应值无明显不同,见表 3。漏斗图分析显示本研究部分危险因素漏斗图不完全对称,提示存在发表偏倚。Egger's检验结果显示甲状腺疾病家族史(t=-2.487,P < 0.05)、双胎及多胎(t=2.966,P=0.021)存在发表偏移,见表 3。采用剪补法对以上两因素进行校正,结果显示甲状腺疾病家族史[OR及95%CI:10.318(7.390~14.407)]、多胎及双胎[OR及95%CI:1.986(1.333~2.958)]两个指标校正后合并效应值略有改变,但方向未发生变化,说明这两项危险因素分析结果稳定可靠。
| 表 3 敏感性分析和发表偏移检验 |
|
|
新生儿CH受遗传和环境因素共同作用,患儿在新生儿期无特异临床症状,群体筛查是早期发现该病的主要手段,但不能根本降低其发生[31]。CH与围生期因素密切相关,明确CH与妊娠期母体因素和胎儿发育的关系,可对该病进行病因预防。本研究收集相关研究进行Meta分析,结果显示母亲高龄、妊娠合并甲状腺疾病、妊娠糖尿病、妊娠期焦虑、妊娠期用药、妊娠期接触辐射、甲状腺疾病家族史、低出生体重、巨大儿、早产儿、过期产儿、双胎及多胎、出生缺陷是新生儿CH的高危因素。
孕母高龄可导致子代多种不良妊娠结局,引起孕产妇围生期并发症和胎儿死亡[32]。本研究结果显示,孕母高龄是新生儿CH的危险因素(OR=2.111)。随着产妇年龄增加,机体功能减退,影响卵细胞质量和宫内环境,可造成胚胎期甲状腺发育不良,增加CH发病的风险[13]。因此,针对育龄妇女,应选择合适年龄优生优育。以往研究显示,孕母妊娠期甲状腺功能异常可导致新生儿CH[15, 17, 24],此次研究得出相同结论(OR=3.365)。妊娠合并甲状腺功能亢进,母体高水平的血清甲状腺激素进入胎儿体内,反馈性抑制胎儿分泌促甲状腺激素,出现中枢性CH;孕母服用的抗甲状腺素类药物,也可抑制胎儿甲状腺激素合成,造成新生儿暂时性CH[33]。血清甲状腺过氧化物酶抗体(thyroidperoxidase antibody, TPOAb)水平是妊娠合并CH的重要预测指标,孕母妊娠合并CH,其新生儿抗-TPOAb阳性率明显升高,发生CH的风险增加[34]。文献报道妊娠期糖代谢异常抑制胚胎发育,增加新生儿畸形率[35],同时妊娠糖尿病与甲状腺功能异常密切相关,两者相互影响,增加子代不良妊娠结局风险[36]。本研究结果显示,妊娠糖尿病与新生儿CH发病有关(OR=2.158),提示孕期控制血糖水平可降低CH发病,但其发病机制需要深入探索。
本研究显示,妊娠期焦虑增加新生儿CH发病风险(OR=3.375)。妊娠期焦虑与子代不良妊娠结局的关系已被证实[37],孕期心理应激产生高水平促炎症细胞因子,干扰免疫功能,影响胎儿发育[38],尤其是孕母不良情绪状态与甲状腺功能异常共同作用,新生儿CH发生率更高[39]。因此,应加强孕期情绪障碍筛查,保障胎儿甲状腺功能正常发育。研究报道妊娠期服用药物与新生儿CH有关,不同种类药物影响各异[22]。本研究显示,妊娠期用药是CH的危险因素(OR=2.774)。服用抗甲状腺素类药物、多巴胺、含碘消毒剂、糖皮质激素类药物的孕母存在胎儿甲状腺功能紊乱的风险,建议谨慎使用。人群调查发现长期低剂量辐射影响甲状腺形态和功能[40]。本Meta分析显示,妊娠期接触辐射增加CH的风险(OR=3.262)。其可能原因是辐射影响胚胎期甲状腺发育,动物实验研究结果为可能的作用机制提供了参考[41]。本研究发现,有甲状腺疾病家族史的孕妇其子代患CH风险高(OR=8.706),说明遗传因素在CH发病中起重要作用[42]。随着分子生物技术的发展,CH与遗传变异关系的证据不断出现。已有研究报道了多种与新生儿CH有关的候选基因,可为CH临床诊治提供依据[43]。
本研究显示,低出生体重(OR=2.674)、巨大儿(OR=1.657)、早产儿(OR=2.567)、过期产儿(OR=2.083)增加CH的发病风险,研究结果与以往报道一致[13-14, 19]。低出生体重儿和早产儿由于宫内生长受限,甲状腺发育不成熟,抑制下丘脑-垂体-甲状腺系统功能,同时早产儿、低出生体重儿易合并其他新生儿疾病,影响甲状腺正常功能[44]。有研究报道巨大儿主要因为孕母伴有糖代谢障碍,使新生儿甲状腺功能异常的风险增高,过期产儿导致CH则与胎盘老化,某些器官功能减退有关[45]。本Meta分析显示,双胎及多胎是新生儿CH危险因素(OR=3.455),其原因可能是妊娠胎数影响孕母甲状腺功能,导致新生儿CH发生。研究表明,双胎妊娠孕母的血清促甲状腺激素水平较单胎妊娠低,其甲状腺功能异常发生率较单胎妊娠更高[46]。同时,双胎妊娠致早产的风险高于多胎妊娠,导致新生儿CH发病风险增加[47],提示应重视双胎及多胎妊娠对母婴健康的影响。有研究显示,CH患儿易发生先天性甲状腺外器官畸形[48]。本Meta分析结果显示,出生缺陷与CH的发生风险增加有关(OR=6.038),但机制尚不清楚,需要进一步研究。
本研究存在一定局限性:首先,由于纳入文献中只涉及母亲因素和胎儿因素,未提供碘含量等相关环境因素与CH的关系,使得研究的新生儿CH影响因素不够全面。其次,纳入的文献包括病例对照研究和现况调查,存在研究间的方法学差异,导致部分因素异质性较高。最后,纳入研究仅含中英文文献,对其他语种出版的文献无法分析,可能产生语种偏倚。
综上所述,本Meta分析评价了新生儿CH的危险因素及其关联强度,其中母亲高龄、妊娠合并甲状腺疾病、妊娠糖尿病、妊娠期焦虑、妊娠期用药、妊娠期接触辐射、甲状腺疾病家族史、低出生体重、巨大儿、早产儿、过期产儿、双胎及多胎、出生缺陷可能增加新生儿CH患病的风险。因此应加强孕产妇围生期保健,减少基础疾病,避免有害暴露,保持孕产妇生理、心理的健康状态,预防新生儿CH的发生。
| [1] |
Wassner AJ. Congenital hypothyroidism[J]. Clin Perinatol, 2018, 45(1): 1-18. DOI:10.1016/j.clp.2017.10.004 (  0) 0) |
| [2] |
Anastasovska V, Kocova M. Ethnicity and incidence of congenital hypothyroidism in the capital of Macedonia[J]. J Pediatr Endocrinol Metab, 2017, 30(4): 405-409. (  0) 0) |
| [3] |
McGrath N, Hawkes CP, McDonnell CM, et al. Incidence of congenital hypothyroidism over 37 years in Ireland[J]. Pediatrics, 2018, 142(4): e20181199. DOI:10.1542/peds.2018-1199 (  0) 0) |
| [4] |
Shaghaghian S, Rahimi N, Mousavi-Roknabadi RS, et al. Appropriateness of congenital hypothyroidism screening program in Fars province, Iran: a retrospective study from 2005 to 2015[J]. Iran J Med Sci, 2019, 44(3): 245-250. (  0) 0) |
| [5] |
Barry Y, Bonaldi C, Goulet V, et al. Increased incidence of congenital hypothyroidism in France from 1982 to 2012:a nationwide multicenter analysis[J]. Ann Epidemiol, 2016, 26(2): 100-105.e4. DOI:10.1016/j.annepidem.2015.11.005 (  0) 0) |
| [6] |
Jaruratanasirikul S, Piriyaphan J, Saengkaew T, et al. The etiologies and incidences of congenital hypothyroidism before and after neonatal TSH screening program implementation: a study in southern Thailand[J]. J Pediatr Endocrinol Metab, 2018, 31(6): 609-617. DOI:10.1515/jpem-2017-0340 (  0) 0) |
| [7] |
Deng K, He CH, Zhu J, et al. Incidence of congenital hypothyroidism in China: data from the national newborn screening program, 2013-2015[J]. J Pediatr Endocrinol Metab, 2018, 31(6): 601-608. DOI:10.1515/jpem-2017-0361 (  0) 0) |
| [8] |
杨海河, 裘蕾, 赵金琦, 等. 1989-2014年北京市先天性甲状腺功能减低症发病特征及影响因素分析[J]. 中华预防医学杂志, 2016, 50(8): 728-732. DOI:10.3760/cma.j.issn.0253-9624.2016.08.011 (  0) 0) |
| [9] |
Hashemipour M, Samei P, Kelishadi R, et al. A systematic review on the risk factors of congenital hypothyroidism[J]. J Pediatr Rev, 2019, 7(4): 199-210. (  0) 0) |
| [10] |
曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四: 观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 4(4): 297-299. DOI:10.3969/j.1674-4055.2012.04.004 (  0) 0) |
| [11] |
裘蕾, 张玉敏, 段建华, 等. 北京地区先天性甲状腺功能减低症危险因素研究[J]. 中国儿童保健杂志, 2008, 16(4): 412-413. DOI:10.3969/j.issn.1008-6579.2008.04.018 (  0) 0) |
| [12] |
田国力, 朱伟明, 许洪平, 等. 上海地区新生儿先天性甲状腺功能低下症的发病趋势及相关因素分析[J]. 中国预防医学杂志, 2008, 9(6): 521-525. DOI:10.3969/j.issn.1009-6639.2008.06.020 (  0) 0) |
| [13] |
周进福, 罗金英, 赵红, 等. 125例新生儿先天性甲状腺功能减低症围产因素分析[J]. 中华流行病学杂志, 2015, 36(7): 747-751. DOI:10.3760/cma.j.issn.0254-6450.2015.07.018 (  0) 0) |
| [14] |
罗丽娜. 衡阳地区2013-2015年新生儿先天性甲状腺功能减低症发病相关情况分析[D]. 衡阳: 南华大学, 2017.
(  0) 0) |
| [15] |
刘颖, 田永波. 黔南地区新生儿先天性甲状腺功能减退症影响因素分析[J]. 中国妇幼保健, 2017, 32(3): 509-511. (  0) 0) |
| [16] |
鲁涛. 邢台市126例新生儿先天性甲状腺功能减低症围产因素分析[J]. 中国妇幼健康研究, 2017, 28(S4): 39. (  0) 0) |
| [17] |
明丹, 郑荣秀. 新生儿及母亲临床特征对先天性甲状腺功能减退症筛查的影响[J]. 天津医药, 2018, 46(7): 742-746. (  0) 0) |
| [18] |
罗炼, 吴文华. 2012~2017年清远市先天性甲状腺功能减退症的影响因素分析[J]. 中国实用医药, 2019, 14(4): 76-77. (  0) 0) |
| [19] |
李艳秋, 王丹, 王成. 新生儿先天性甲状腺功能减退发生的影响因素分析[J]. 医学综述, 2019, 25(22): 4556-4559. DOI:10.3969/j.issn.1006-2084.2019.22.037 (  0) 0) |
| [20] |
王川, 尚煜. 北京市朝阳区15年先天性甲状腺功能减低症发病趋势及影响因素分析[J]. 中国妇幼卫生杂志, 2020, 11(1): 1-5. (  0) 0) |
| [21] |
童丽娜, 汪凌霄. 儿童先天性甲状腺功能减低症发生的影响因素分析[J]. 中国妇幼保健, 2020, 35(11): 2026-2028. (  0) 0) |
| [22] |
罗春伟, 赵德华, 梁歌, 等. 母亲相关因素与新生儿先天性甲状腺功能减低症易感性的病例对照研究[J]. 中国当代儿科杂志, 2020, 22(1): 37-41. (  0) 0) |
| [23] |
Kurinczuk JJ, Bower C, Lewis B, et al. Congenital hypothyroidism in Western Australia 1981-1998[J]. J Paediatr Child Health, 2002, 38(2): 187-191. DOI:10.1046/j.1440-1754.2002.00812.x (  0) 0) |
| [24] |
Medda E, Olivieri A, Stazi MA, et al. Risk factors for congenital hypothyroidism: results of a population case-control study (1997-2003)[J]. Eur J Endocrinol, 2005, 153(6): 765-773. DOI:10.1530/eje.1.02048 (  0) 0) |
| [25] |
Rezaeian S, Poorolajal J, Moghimbegi A, et al. Risk factors of congenital hypothyroidism using propensity score: a matched case-control study[J]. J Res Health Sci, 2013, 13(2): 151-156. (  0) 0) |
| [26] |
Abdelmoktader AM. Risk factors for congenital hypothyroidism in Egypt: results of a population case-control study (2003-2010)[J]. Ann Saudi Med, 2013, 33(3): 273-276. DOI:10.5144/0256-4947.2013.273 (  0) 0) |
| [27] |
Keshavarzian E, Valipoor AA, Maracy MR. The incidence of congenital hypothyroidism and its determinants from 2012 to 2014 in Shadegan, Iran: a case-control study[J]. Epidemiol Health, 2016, 38: e2016021. DOI:10.4178/epih.e2016021 (  0) 0) |
| [28] |
Ahmad A, Wasim A, Hussain S, et al. Congenital hypothyroidism in neonates of a tertiary care hospital[J]. Pak J Med Sci, 2017, 33(5): 1269-1272. (  0) 0) |
| [29] |
Alimohamadi Y, Taghdir M, Sepandi M. Statistical data analysis of the risk factors of neonatal congenital hypothyroidism in Khuzestan province, Iran[J]. Data Brief, 2018, 21: 2510-2514. DOI:10.1016/j.dib.2018.11.113 (  0) 0) |
| [30] |
Khammarnia M, Siakhulak FR, Ansari H, et al. Risk factors associated with congenital hypothyroidism: a case-control study in southeast Iran[J]. Electron Physician, 2018, 10(2): 6286-6291. DOI:10.19082/6286 (  0) 0) |
| [31] |
Persani L, Rurale G, de Filippis T, et al. Genetics and management of congenital hypothyroidism[J]. Best Pract Res Clin Endocrinol Metab, 2018, 32(4): 387-396. DOI:10.1016/j.beem.2018.05.002 (  0) 0) |
| [32] |
魏丽坤, 余丽敏, 王宝晨, 等. 高龄孕产妇的围产期妊娠结局分析[J]. 中华医学杂志, 2018, 98(39): 3205-3207. DOI:10.3760/cma.j.issn.0376-2491.2018.39.016 (  0) 0) |
| [33] |
陈倩. 妊娠合并甲状腺功能亢进症对胎儿及新生儿的影响[J]. 中国实用妇科与产科杂志, 2013, 29(6): 410-412. (  0) 0) |
| [34] |
蒋芳, 高劲松, 边旭明, 等. 妊娠合并甲状腺功能减退症孕妇的新生儿脐血甲状腺功能筛查的意义[J]. 中华围产医学杂志, 2010, 13(4): 298-302. DOI:10.3760/cma.j.issn.1007-9408.2010.04.009 (  0) 0) |
| [35] |
Lacroix M, Battista MC, Doyon M, et al. Lower adiponectin levels at first trimester of pregnancy are associated with increased insulin resistance and higher risk of developing gestational diabetes mellitus[J]. Diabetes Care, 2013, 36(6): 1577-1583. DOI:10.2337/dc12-1731 (  0) 0) |
| [36] |
华沛旻, 顾颖. 甲状腺功能异常与妊娠期糖尿病的相关性及其对妊娠结局的影响[J]. 中国妇幼保健, 2018, 33(22): 5062-5065. (  0) 0) |
| [37] |
Grigoriadis S, Graves L, Peer M, et al. Maternal anxiety during pregnancy and the association with adverse perinatal outcomes: systematic review and meta-analysis[J]. J Clin Psychiatry, 2018, 79(5): 17r12011. (  0) 0) |
| [38] |
Coussons-Read ME, Okun ML, Nettles CD. Psychosocial stress increases inflammatory markers and alters cytokine production across pregnancy[J]. Brain Behav Immun, 2007, 21(3): 343-350. DOI:10.1016/j.bbi.2006.08.006 (  0) 0) |
| [39] |
李琼, 李海洋, 徐海耿, 等. 孕期甲状腺功能减退及情绪障碍对不良妊娠结局的影响[J]. 中国现代医生, 2019, 57(32): 51-54. (  0) 0) |
| [40] |
龚力, 何谦. 低剂量电离辐射效应及对我国放射从业人员甲状腺功能及结节影响研究进展[J]. 职业与健康, 2019, 35(10): 1430-1432. (  0) 0) |
| [41] |
Juutilainen J. Developmental effects of extremely low frequency electric and magnetic fields[J]. Radiat Prot Dosimetry, 2003, 106(4): 385-390. DOI:10.1093/oxfordjournals.rpd.a006376 (  0) 0) |
| [42] |
Mansour C, Ouarezki Y, Jones J, et al. Trends in Scottish newborn screening programme for congenital hypothyroidism 1980-2014:strategies for reducing age at notification after initial and repeat sampling[J]. Arch Dis Child, 2017, 102(10): 936-941. DOI:10.1136/archdischild-2016-312156 (  0) 0) |
| [43] |
陈晓宇, 秦晓松. 中国儿童先天性甲状腺功能减退症的基因学研究进展[J]. 中国当代儿科杂志, 2018, 20(3): 243-250. (  0) 0) |
| [44] |
Andersen SL, Olsen J, Wu CS, et al. Low birth weight in children born to mothers with hyperthyroidism and high birth weight in hypothyroidism, whereas preterm birth is common in both conditions: a Danish national hospital register study[J]. Eur Thyroid J, 2013, 2(2): 135-144. (  0) 0) |
| [45] |
唐晴, 罗静思, 陈少科, 等. 新生儿先天性甲状腺功能异常发病率与胎龄、出生体重关系的研究[J]. 中国优生与遗传杂志, 2012, 20(8): 88-89. (  0) 0) |
| [46] |
张爽, 李楠, 李薇, 等. 双胎妊娠对妊娠期妇女甲状腺功能影响[J]. 中国公共卫生, 2018, 34(7): 937-941. (  0) 0) |
| [47] |
Jiang X, Huang YL, Feng Y, et al. Same-sex twins have a high incidence of congenital hypothyroidism and a high probability to be missed at newborn screening[J]. Clin Chim Acta, 2020, 502: 111-115. DOI:10.1016/j.cca.2019.12.018 (  0) 0) |
| [48] |
朱娅梅, 李堂. 先天性甲状腺功能减退对儿童各系统发育的影响[J]. 国外医学(儿科学分册), 2003, 30(1): 30-32. DOI:10.3760/cma.j.issn.1673-4408.2003.01.011 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


