(1)病史:患儿女,3岁,因发热2个月,意识障碍1周入院。患儿2个月前出现反复中-高热,最高体温40℃,口服退热药可降至正常。无咳嗽、腹泻、呕吐,伴精神差,无惊厥、意识障碍,就诊于外院,血培养阴性,多次查血钠低,促卵泡素8.04 mIU/mL(参考值:1.7~7.7 mIU/mL),考虑“(1)颅内感染,(2)脓毒症,(3)电解质紊乱,(4)肿瘤性疾病”,予头孢噻肟钠抗感染、脱水降颅内压等治疗1周余,体温转为低热后出院,继续口服抗生素治疗。出院后患儿再次出现高热,最高达40℃,就诊于当地县医院,头颅CT提示侧脑室周围对称性低密度,诊断为“(1)脓毒症?(2)低钠血症,(3)轻度贫血”等,予哌拉西林他唑巴坦钠等治疗2 d症状未缓解。入院前1周患儿出现呕吐,每日3~4次,呈喷射性,出现智力运动逐渐倒退,站立不能,少语,意识不清;且伴惊厥发作,表现为双目凝视,口唇青紫,伴或不伴肢体抽搐,持续几十秒至数分钟不等,数日发作1次。就诊至我市某医院,予阿奇霉素、炎琥宁等治疗4 d,意识障碍进行性加重,且出现呼吸不规则,转至我院治疗。自发热以来,精神饮食差,体重下降约4 kg。
(2)既往史、个人史、家族史:病前智力运动发育里程碑正常,家族史阴性;近半年来体重增长迅速,每月约增长1.5~2.0 kg(体重最高时24 kg),同时伴多汗、多尿及遗尿;既往无反复感染,无使用免疫抑制剂病史。
(3)入院体格检查:体温39.3℃,呼吸42次/min(节律不规则),脉搏150次/min,血压106/75 mm Hg,身高95 cm,体重20 kg(> 3 SD),体重指数22.16 kg/m2。外观肥胖,嗜睡状,反应迟钝,呼吸节律不规则,双瞳孔等大等圆,对光反射迟钝,颈抗二横指,心肺腹部体检无异常。四肢肌张力稍高,双膝腱反射活跃,病理征阴性。
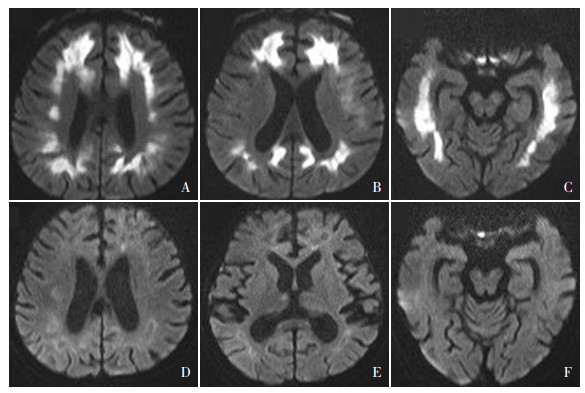
(4)实验室检查:血常规示血红蛋白105 g/L,降钙素原0.25 ng/mL(参考值:< 0.05 ng/mL),凝血功能示D-二聚体4.32 μg/mL(参考值:< 0.5 μg/mL),肝肾功能、血脂、电解质、C-反应蛋白、红细胞沉降率、类风湿因子、甲状腺功能、免疫全套、抗核抗体谱、单纯疱疹病毒、巨细胞病毒、EB病毒抗体均正常,血培养阴性。肥达氏反应、真菌D-葡聚糖检测、结核菌感染T细胞斑点试验均阴性。腰椎穿刺测颅内压290 mm H2O,脑脊液细胞数、蛋白、葡萄糖及氯化物水平正常,抗酸及墨汁染色阴性。头颅MRI示双侧脑室周围白质损害为主的对称性病变(图 1A~C)。垂体MRI、胸腹部CT、心脏彩超均正常。
|
图 1 患儿不同时期头颅MRI结果 图A~C为入院第5天的弥散加权成像,显示脑室周围(额、顶及颞叶)对称性高信号。图D~F为出院40 d(治疗近2月)后复查的弥散加权成像,显示原来病灶基本消失,部分病灶软化。 |
病例特点:(1)学龄前期女童,长期反复发热,抗生素治疗无效;(2)显著的中枢神经系统症状及体征;(3)颅内压增高,头颅MRI异常、低钠血症及促卵泡素稍高;(4)既往健康,半年来体重快速增长。对于长期发热患儿,在病因分析中首先需考虑感染性病因[1],如细菌、结核杆菌、真菌或慢病毒等感染导致的脓毒症及中枢神经系统感染。细菌感染导致的脓毒症、细菌性脑膜炎可出现上述症状,但本例患儿炎症指标增高不明显,多次血培养阴性,脑损害重而脑脊液检测无异常,且经过多种抗生素治疗无效,故不支持细菌感染。结核及真菌感染可出现长期发热、意识障碍、高颅内压等,与本例患儿症状相似,但患儿无结核患者接触史,无消瘦,无结核及真菌感染的危险因素,真菌D-葡聚糖检测、结核菌感染T细胞斑点试验阴性,胸部CT无结核及真菌感染征象,脑脊液常规生化检测无异常,脑脊液抗酸染色及墨汁染色阴性,故不支持结核与真菌感染。患儿无免疫缺陷及使用免疫抑制剂病史,病毒相关检测阴性,不支持慢病毒及机会性感染。
其次需考虑非感染性疾病可能[1],包括(1)自身免疫性疾病:该类疾病可反复发热,部分自身免疫性疾病可累及中枢神经系统,且对抗生素治疗无效,但本例患儿无皮疹及关节肿痛,无肝脾大、无淋巴结肿大,C-反应蛋白、红细胞沉降率、血小板正常,自身抗体阴性,心脏彩超正常,故不支持该类疾病;(2)肿瘤性疾病:可长期反复发热,伴中枢神经系统受累,但本例患儿年龄小,血常规无明显异常,胸腹部CT、头颅CT、头颅MRI平扫增强均未发现肿瘤性疾病,可排除肿瘤性疾病;(3)自主神经功能紊乱:自主神经功能主要由下丘脑-垂体轴调控,其功能异常可导致机体泌汗及散热功能障碍出现反复发热,影响摄食中枢而导致肥胖,还可出现水电解质紊乱及垂体相关激素异常[1-4]。本例患儿肥胖,早期多汗,开始发热后则无汗,且体温呈安静或入睡后正常、活动等身体产热增加时增高的规律,院外发现低钠血症及促卵泡素稍高,因此需考虑下丘脑-垂体轴功能异常可能,需进一步复测垂体相关激素。患儿意识障碍、呕吐及颅内高压,血D-二聚体增高,头颅MRI示脑室周围白质对称性损害,需警惕颅内血栓性疾病等,需进一步作头颅血管影像检查;另外患儿肥胖伴呼吸异常,需进一步行睡眠监测明确有无呼吸-睡眠相关疾病。
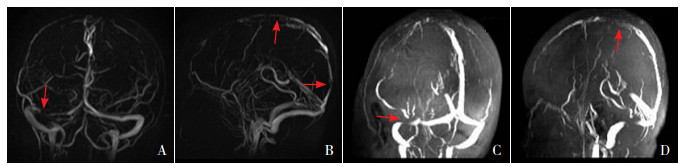
3 进一步处理进一步行垂体相关激素检测(胰岛素样生长因子、生长激素、泌乳素、促甲状腺激素、促卵泡素及黄体生成素),结果示泌乳素773 mIU/L(参考值102~496 mIU/L),余激素水平正常。核磁共振静脉造影(magnetic resonance venogram, MRV)提示右侧横窦、上矢状窦静脉血栓形成(图 2A~B)。睡眠监测结果符合低通气表现:共监测835 min,监测到低通气47次(最长持续时间87.3 s),平均血氧饱和度93%,有16 min血氧饱和度低于90%;未发现心脏停搏及其他严重心律失常。
|
图 2 患儿不同时期头颅核磁共振静脉造影结果 第1次MRV(入院第7天)显示横窦(A)及上矢状窦(B)血栓形成(箭头所示);图C~D示出院40 d后复查显示血栓长度明显缩短(箭头所示)。 |
诊断:(1)快速肥胖伴通气不足、下丘脑功能不全和自主神经调节异常综合征(rapid-onset obesity with hypoventilation, hypothalamic dysfunction, and autonomic dysregulation syndrome, ROHHADS)。ROHHADS诊断标准包括:①主要标准:既往健康儿童,在2~7岁之间出现的与中枢性通气不足相关的快速体重增加;②至少1个垂体功能障碍的证据:高泌乳素血症,中枢性甲状腺功能低下,水、电解质平衡紊乱,生长激素异常,肾上腺皮质功能不全或青春期疾病[2-4]。本例患儿的诊断依据:①既往健康3岁女童,半年来快速体重增长,且具有反复发热、泌汗异常及低通气等自主神经紊乱的症状;②有多次低钠血症、2次垂体激素异常(促卵泡素及泌乳素增高)。(2)颅内静脉血栓形成。诊断依据:①有惊厥、意识障碍及呕吐病史;②意识水平下降;③D-二聚体升高,颅内压增高,头颅MRI示脑室周围对称性损害,头颅MRV发现血栓形成。
5 临床经过入院后考虑患儿存在脓毒症和中枢神经系统感染。治疗上予无创呼吸机辅助呼吸,美罗培南抗感染及脱水降颅内压等对症支持治疗。治疗5 d后患儿呼吸好转脱离呼吸机,但仍反复发热,且意识障碍及惊厥无好转。治疗上停用抗生素,加强脱水降颅内压,同时予肝素、华法林抗凝促进血管再通,丙种球蛋白(2 g/kg)免疫调节治疗。进一步行24 h动态心电图未见异常。监测凝血功能,调整华法林剂量以维持国际标准化比率在2~3之间。通过上述治疗4 d后,患儿呕吐逐渐好转,意识清醒,复查腰穿颅内压正常后出院。院外继续口服华法林抗凝及口服促氮酰胺减少脑脊液生成预防颅内压增高。出院40 d后复查头颅MRI示既往脑白质病变显著减少(图 1D~F),MRV示上矢状窦及横窦血栓栓塞长度明显缩短(图 2C~D)。于家中控制热卡摄入,监测体重、呼吸,门诊定期复查凝血功能、心电图、睡眠监测。随访至出院2个月余,体重27 kg(体重指数29.29 kg/m2),无惊厥发作,意识渐恢复,但未达基线水平,智力运动持续进步,可独立行走,能与家长进行简单交流。
6 讨论ROHHADS是一种罕见的儿科多系统疾病,常累及内分泌、自主神经、心血管和呼吸道系统,临床异质性强,诊治不及时病死率较高[2]。该病1965年被首次报道,曾被命名为“伴下丘脑功能不全的迟发性中枢性低通气”,于2007年正式使用ROHHADS表示该病[2-4]。ROHHADS病因不详,多数学者认为可能是一种自身免疫性疾病或表观遗传性疾病[5-6]。约40%的患者伴神经节瘤,且研究显示至今报道患者均为儿童病例,未见成人患者报道,与其他睡眠呼吸异常性疾病主要发生于男孩不同,本病女孩更常见,女孩发病是男孩的2倍[7-9]。本例患儿未发现肿瘤发生,合并颅内静脉血栓形成,推测可能是以下因素影响了患儿颅内血流动力学及血液黏滞度,从而导致血栓形成[10-11]:(1)长期反复发热导致脱水,血液浓缩;(2)反复低钠血症,改变了血液的渗透压;(3)长期低通气,导致颅内压变化。本例患儿现虽无中枢神经系统肿瘤,但由于病程短,仍需在今后随访中进行胸腹部影像学检查监测肿瘤情况。
ROHHADS导致中枢性通气不足是由于自主神经功能异常,使机体在缺氧或二氧化碳潴留时不能代偿性的增快呼吸频率,从而导致通气不足。自主神经功能障碍同时也会导致反复发热,泌汗异常(多汗或无汗),心血管异常表现(心律失常、血压失调甚至心脏骤停)[2]。文献报道该病主要死亡原因是呼吸异常及心脏停搏[7, 12-13]。低通气几乎存在于被诊断的所有患者中,学者认为ROHHADS患者的主要死因可能是继发于呼吸骤停所致的心脏骤停,因此建议对伴有低氧血症患者的睡眠期给予呼吸支持,以改善患者生活质量并防止猝死[8-9]。本例患儿以2岁半后快速肥胖起病,早期为汗多、尿量多,后出现无汗及发热,且发热与活动相关,入院后监测发现低通气,均符合ROHHADS的临床表现。虽然本例患儿监测中未发现心律失常,但由于心脏骤停是该病的主要死亡原因之一,因此心肺功能监测仍是今后随访的重点监测项目,并建议家中给予睡眠呼吸支持。
肥胖通常是本病的首发症状,但在未出现其他症状前肥胖常易被家长及医生忽略。血钠异常常先于其他症状出现,本例患儿在诊治过程中也曾出现反复低钠血症。对于肥胖伴泌汗异常、长期发热及电解质紊乱患者,需考虑ROHHADS可能。儿童期的肥胖需与其他疾病相鉴别,如单纯性肥胖、Prader-Willi综合征、垂体结构异常等[9, 14]。单纯性肥胖除了肥胖外,一般无其他异常。而Prader-Willi综合征常起病早,表现为围生期异常、智力运动发育落后、染色体及基因检测可发现异常;垂体结构异常可借助影像学检查排除。
ROHHADS缺乏特异性治疗方法。虽然许多文献认为该病可能有免疫因素参与,但关于该病的免疫治疗经验目前仅限于个案报道,缺乏大样本对照研究[9, 15-16]。文献报道皮质激素、丙种球蛋白、环磷酰胺可改善患者症状[17-18]。虽然本例患儿给予丙种球蛋白治疗后病情迅速好转,但也可能是脱水降颅内压及血管再通的效果,关于ROHHADS免疫治疗的利弊还需在今后研究中进一步证实。ROHHADS的治疗强调多科协作,其中应重点评估是否存在严重低氧血症、心脏停搏及肿瘤。因此建议对于怀疑ROHHADS的患者,均应在多科协作下进行全面监测,尤其重点监测心肺功能及肿瘤发生。
7 结语总之,目前对于ROHHADS认识仍不足,延误诊断及治疗可能导致患儿出现严重呼吸、循环及神经系统并发症而死亡。对于不明原因发热、肥胖、低通气,伴或不伴中枢神经系统症状患者,均需考虑ROHHADS可能,需严密监测激素水平、心肺功能及肿瘤情况。早期诊断和规律随访可能会大大改善预后。
| [1] |
Chusid MJ. Fever of unknown origin in childhood[J]. Pediatr Clin North Am, 2017, 64(1): 205-230. DOI:10.1016/j.pcl.2016.08.014 (  0) 0) |
| [2] |
Ize-Ludlow D, Gray JA, Sperling MA, et al. Rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation presenting in childhood[J]. Pediatrics, 2007, 120(1): e179-e188. DOI:10.1542/peds.2006-3324 (  0) 0) |
| [3] |
Fishman LS, Samson JH, Sperling DR. Primary alveolar hypoventilation syndrome (Ondine's curse)[J]. Am J Dis Child, 1965, 110: 155-161. DOI:10.1001/archpedi.1965.02090030165011 (  0) 0) |
| [4] |
Katz ES, McGrath S, Marcus CL. Late-onset central hypoventilation with hypothalamic dysfunction: a distinct clinical syndrome[J]. Pediatr Pulmonol, 2000, 29(1): 62-68. DOI:10.1002/(SICI)1099-0496(200001)29:1<62::AID-PPUL10>3.0.CO;2-M (  0) 0) |
| [5] |
Barclay SF, Rand CM, Borch LA, et al. Rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation (ROHHAD): exome sequencing of trios, monozygotic twins and tumours[J]. Orphanet J Rare Dis, 2015, 10: 103. DOI:10.1186/s13023-015-0314-x (  0) 0) |
| [6] |
Lazea C, Sur L, Florea M. ROHHAD (rapid-onset obesity with hypoventilation, hypothalamic dysfunction, autonomic dysregulation) syndrome-what every pediatrician should know about the etiopathogenesis, diagnosis and treatment: a review[J]. Int J Gen Med, 2021, 14: 319-326. DOI:10.2147/IJGM.S293377 (  0) 0) |
| [7] |
Filippidou M, Petropoulou T, Botsa E, et al. ROHHAD syndrome-a still unrecognized cause of childhood obesity: report of three cases[J]. J Pediatr Endocrinol Metab, 2020, 33(10): 1341-1348. DOI:10.1515/jpem-2020-0111 (  0) 0) |
| [8] |
Ma GM, Chow JS, Taylor GA. Review of paraneoplastic syndromes in children[J]. Pediatr Radiol, 2019, 49(4): 534-550. DOI:10.1007/s00247-019-04371-y (  0) 0) |
| [9] |
Lee JM, Shin J, Kim S, et al. Rapid-onset obesity with hypoventilation, hypothalamic, autonomic dysregulation, and neuroendocrine tumors (ROHHADNET) syndrome: a systematic review[J]. Biomed Res Int, 2018, 2018: 1250721. (  0) 0) |
| [10] |
陶玺宬, 吴德, 周自云, 等. 儿童脑静脉窦血栓形成合并肺栓塞1例报告[J]. 中国当代儿科杂志, 2015, 17(1): 95-96. (  0) 0) |
| [11] |
方方, 邹丽萍. 颅内静脉窦血栓[J]. 中国当代儿科杂志, 2006, 8(3): 211-215. DOI:10.3969/j.issn.1008-8830.2006.03.012 (  0) 0) |
| [12] |
Özcan G, Özsu E, Şiklar Z, et al. A rare cause of sleep-disordered breathing: ROHHAD syndrome[J]. Front Pediatr, 2020, 8: 573227. DOI:10.3389/fped.2020.573227 (  0) 0) |
| [13] |
Selvadurai S, Benzon D, Voutsas G, et al. Sleep-disordered breathing, respiratory patterns during wakefulness and functional capacity in pediatric patients with rapid-onset obesity with hypothalamic dysfunction, hypoventilation and autonomic dysregulation syndrome[J]. Pediatr Pulmonol, 2021, 56(2): 479-485. DOI:10.1002/ppul.25199 (  0) 0) |
| [14] |
Barclay SF, Rand CM, Nguyen L, et al. ROHHAD and Prader-Willi syndrome (PWS): clinical and genetic comparison[J]. Orphanet J Rare Dis, 2018, 13(1): 124. DOI:10.1186/s13023-018-0860-0 (  0) 0) |
| [15] |
Giacomozzi C, Guaraldi F, Cambiaso P, et al. Anti-hypothalamus and anti-pituitary auto-antibodies in ROHHAD syndrome: additional evidence supporting an autoimmune etiopathogenesis[J]. Horm Res Paediatr, 2019, 92(2): 124-132. DOI:10.1159/000499163 (  0) 0) |
| [16] |
Cemeroglu AP, Eng DS, Most LA, et al. Rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation syndrome and celiac disease in a 13-year-old girl: further evidence for autoimmunity?[J]. J Pediatr Endocrinol Metab, 2016, 29(1): 97-101. (  0) 0) |
| [17] |
Jacobson LA, Rane S, McReynolds LJ, et al. Improved behavior and neuropsychological function in children with ROHHAD after high-dose cyclophosphamide[J]. Pediatrics, 2016, 138(1): e20151080. DOI:10.1542/peds.2015-1080 (  0) 0) |
| [18] |
Erensoy H, Ceylan ME, Evrensel A. Psychiatric symptoms in rapid-onset obesity with hypothalamic dysfunction, hypoventilation, and autonomic dysregulation syndrome and its treatment: a case report[J]. Chin Med J (Engl), 2016, 129(2): 242-243. DOI:10.4103/0366-6999.173550 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


