新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)是由于围生期窒息导致的新生儿脑部缺氧缺血性损害,是导致新生儿致残甚至死亡的主要原因,目前临床上针对HIBD无特异的治疗手段[1-2]。临床研究资料显示,尽管及时采取亚低温疗法,仍有部分围生期重度窒息新生儿发生不良结局,包括死亡、脑性瘫痪、智力障碍、癫痫等永久性神经损伤后遗症,给患儿家庭及社会带来巨大的经济负担[2-3]。导致HIBD的机制很复杂,包括能量消耗、线粒体损伤、兴奋性氨基酸及活性氧(reactive oxygen species, ROS)的产生和炎症反应等,所有这些机制都会导致不同类型的细胞死亡[2-4]。
铁死亡(ferroptosis)是近年来发现的一种新型细胞死亡方式,与许多疾病的病理生理过程密切相关[4-5]。2003年在一项大规模筛选各种化合物对肿瘤细胞杀伤作用的研究中,首次发现爱拉斯汀(erastin)可导致肿瘤细胞出现这种不同于传统细胞凋亡的新型死亡方式[6];2008年Yang等[7]发现化合物Ras选择性致死化合物(Ras-selective lethal compounds, RSL)3和RSL5,与erastin具有相同的作用,并且铁螯合剂去铁胺B-甲磺酸盐和抗氧化剂维生素E可以抑制这种细胞死亡;2012年首次出现用“ferroptosis”描述这种有铁离子依赖性、氧化型的全新细胞死亡模式,即铁死亡[8]。铁死亡在细胞形态上明显不同于凋亡、自噬和坏死性凋亡等其他细胞死亡方式,例如,铁死亡没有细胞凋亡的特征:如细胞萎缩、染色质浓缩、凋亡小体形成和核碎裂;没有细胞自噬的特征:如双膜自噬溶酶体形成;也不具有典型细胞坏死性凋亡的形态特征,如细胞质和细胞器肿胀及细胞膜破裂等[5, 9]。
铁死亡的形态和生化特点表现为细胞内铁离子过度沉积、膜脂质过氧化水平升高,线粒体皱缩、嵴减少及膜密度增厚等特点[10-11]。铁死亡在发病机制中也与其他细胞死亡方式明显不同,例如,凋亡主要通过细胞凋亡的膜受体途径和内质网细胞途径,导致含半胱氨酸的天冬氨酸蛋白水解酶激活,从而导致凋亡发生;自噬主要通过激活MAPK和mTOR信号通路发生;坏死性凋亡主要通过肿瘤坏死因子或Toll样受体3介导的信号通路,导致受体相互作用蛋白1、受体相互作用蛋白3和混合系列蛋白激酶样结构域激活引起[5, 9, 12]。而铁死亡是一种铁离子依赖性的新型程序性细胞死亡方式,主要由于铁代谢异常、脂质代谢异常、谷胱甘肽与谷胱甘肽过氧化物酶-4调控异常等引起[5]。而且,铁死亡不能被凋亡、自噬或坏死性凋亡等其他细胞死亡方式的特异性抑制剂抑制[13]。
越来越多的证据表明铁死亡与多种疾病的细胞损伤相关,如肿瘤、缺血再灌注损伤、脑卒中、神经退行性病变、心肌梗死、急性肾损伤、肝损伤等[11, 14-18],但铁死亡在HIBD发病机制中的作用及途径尚不明确,是目前HIBD发病机制研究的新热点。目前已知铁代谢异常、谷氨酸反向转运体功能异常和脂质过氧化物调控异常是导致铁死亡的主要原因[13-14, 19],而这些代谢异常也在HIBD发病机制中发挥重要作用[3-4],因此本文主要围绕与铁死亡及HIBD均密切相关的铁代谢异常、胱氨酸/谷氨酸反向转运体功能异常和脂质过氧化物调控异常的研究进展进行综述。
1 铁代谢异常与铁死亡铁是细胞铁死亡的必要组成部分[15]。细胞中的铁以两种形式存在:二价铁离子(Fe2+)和三价铁离子(Fe3+),含Fe2+的蛋白质一直作为辅助因子和催化剂参与各种氧化还原反应,而Fe3+是铁主要的储存和运输形式。循环中的Fe3+通过细胞膜转铁蛋白受体1进入细胞内,细胞内Fe3+通过铁还原酶被还原为Fe2+,而Fe2+通过细胞膜铁转运蛋白氧化成Fe3+,并将细胞内Fe2+释放到不稳定的铁池中[13, 20-21]。另外铁及其衍生物对线粒体电子传递链中产生ROS的酶和亚单位的功能至关重要,因为过量的铁原子可以向O2和H2O2提供电子,产生超氧阴离子和羟自由基,这两种自由基都可以通过氧化蛋白质、脂质和核酸来破坏细胞;并且过多的外源铁能够通过Fenton反应生成ROS导致铁死亡的发生[13, 21],也可作为含铁酶的辅助因子发挥作用,导致谷胱甘肽耗尽从而导致铁死亡发生[13, 22]。Erastin诱导的铁死亡中可以检测到外源铁增加和ROS积累,而这一过程可以被铁的鳌合剂抑制[4]。研究表明通过沉默铁代谢主要转录因子铁反应元件结合蛋白2基因,使细胞内铁含量降低,可以抑制erastin诱导的铁死亡[8]。此外,铁还是构成脂质过氧化作用中氧化酶亚基的重要成分。脂氧合酶可以通过细胞膜的过氧化作用来促进铁死亡发生,铁螯合剂(去铁胺和去铁酮)可以通过去除脂氧合酶催化过程中必须的铁来抑制铁死亡发生[20, 23]。因此铁参与脂质过氧化物积累和铁死亡发生过程,铁的输入、排出、储存和流通量都对细胞铁死亡有重要的影响[24]。
2 胱氨酸/谷氨酸反向转运体与铁死亡细胞膜胱氨酸/谷氨酸反向转运体是一种异二聚胱氨酸/谷氨酸反向转运蛋白,包括功能亚基溶质载体家族7成员11(solute carrier family 7,member 11,SLC7A11)和调节亚基溶质载体家族3成员2,它通过将谷氨酸转运至细胞外从而将胱氨酸摄入细胞内,进一步还原为半胱氨酸,合成细胞内主要的抗氧化剂谷胱甘肽,从而维持细胞内外氧化还原平衡[4, 13, 20]。谷胱甘肽作为最丰富的抗氧化剂,其功能是保护细胞免受ROS的损伤[25]。此外谷胱甘肽作为谷胱甘肽过氧化物酶4的辅助因子,对于抑制铁死亡是必需的[8, 13]。在合成谷胱甘肽所需的3个氨基酸中,其中半胱氨酸通常含量最少,因此半胱氨酸被认为是限制谷胱甘肽合成速率的关键氨基酸[26]。半胱氨酸可以通过转硫途径由蛋氨酸在某些细胞中合成,但是在其他许多细胞中,半胱氨酸的导入对于维持半胱氨酸和谷胱甘肽的水平并防止铁死亡至关重要[3, 26]。相反,由细胞膜胱氨酸/谷氨酸反向转运体抑制引起的谷胱甘肽耗竭与多种人类疾病有关,尤其是中枢神经系统疾病[8]。细胞膜胱氨酸/谷氨酸反向转运体依赖的抗氧化防御系统在受到一些化合物如erastin、谷氨酸、磺胺嘧啶和索拉非尼等抑制时,会通过消耗半胱氨酸,导致谷胱甘肽合成降低、谷胱甘肽过氧化物酶4失活、脂质代谢积累,最终导致细胞氧化损伤和细胞铁死亡的发生[4, 27-28]。而SLC7A11作为细胞膜胱氨酸/谷氨酸反向转运体的重要组成部分,沉默SLC7A11基因会使细胞对erastin诱导的铁坏死更加敏感[29]。因此胱氨酸/谷氨酸反向转运体,包括谷氨酸和谷氨酰胺等转运和生产的物质,都是铁死亡的关键调节因子[30]。
3 脂质过氧化物调控异常与铁死亡尽管铁死亡是最近发现的一种依赖于ROS的程序性细胞死亡形式,但其分子机制和生化功能仍知之甚少。其中脂质在能量供应和细胞内膜系统的组成中起关键作用,如磷脂(例如磷脂酰胆碱、心磷脂)的氧合作用促进细胞铁死亡发生[31-32]。脂质过氧化物主要通过细胞中的3个途径产生,所有这些途径都需要铁:(1)铁通过Fenton反应以非酶的方式产生的脂质ROS;(2)通过多不饱和脂肪酸的氧化和酯化反应生成的脂质过氧化物;(3)由铁催化方式的脂质自氧化[13]。
目前,人们认为ROS导致铁死亡的重要原因之一是脂膜的多不饱和脂肪酸在ROS的积累下转化为脂质过氧化物[33]。ROS的积累是由Fenton反应、烟酰胺腺嘌呤二核苷酸磷酸依赖性脂质过氧化和谷胱甘肽缺失引起的[34]。过量的ROS产生可能引起细胞氧化应激,并破坏DNA、蛋白质及脂质[35]。谷胱甘肽过氧化物酶4的失活会导致脂质过氧化物的积累,这是导致细胞铁死亡的关键信号[13]。在生理条件下,谷胱甘肽过氧化物酶4能将谷胱甘肽作为辅因子将脂质过氧化物还原为脂质醇,催化循环消耗2个谷胱甘肽分子,最终迅速去除多余的脂质过氧化物,防止铁死亡的发生;但是,当氧化损伤产生大量的脂质过氧化物或过量铁积累,导致谷胱甘肽消耗殆尽,进而促使谷胱甘肽依赖的谷胱甘肽过氧化物酶4活性下降,最终便会发生铁死亡现象[33, 36]。在Fe2+积累的情况下,脂质氢过氧化物可以被Fe2+还原,生成高反应性烷氧基,这些自由基可以通过脂质过氧化反应直接破坏相邻的多不饱和脂肪酸,引起大量与脂类相关的ROS积累,导致细胞内铁死亡的发生[37]。通过荧光探针二氯荧光素、2', 7'-二氯二氢荧光素二乙酸酯和脂质过氧化荧光探针等技术已经证明erastin诱导的铁死亡中存在脂质ROS的积累;RSL3诱导的铁死亡中通过结合或抑制谷胱甘肽过氧化物酶4,从而增加脂质ROS积累,导致脂质过氧化作用增强,进一步证明了ROS在铁死亡中的作用[4, 38]。
因此脂质过氧化在铁死亡中起主要作用,相反,抗氧化调节剂如谷胱甘肽过氧化物酶4、细胞膜胱氨酸/谷氨酸反向转运体等可以在不同水平上发挥作用,以限制铁死亡的氧化损伤[36]。并且研究发现了多种亲脂性抗氧化剂如生育酚、丁基化羟基甲苯、β-胡萝卜素、ferrostatin-1和liproxstatin-1等可作为erastin诱导细胞铁死亡的强抑制物[4]。鉴于铁死亡与氧化应激的相关性,氧化损伤和谷氨酸兴奋毒性所致细胞死亡的机制也是导致铁死亡的原因。
4 铁死亡与HIBDHIBD是新生儿死亡和长期残疾的最常见原因之一,发病率为2‰~3‰[1]。HIBD后神经细胞死亡是导致长期神经系统损伤的主要原因[39]。围生期HIBD诱导的细胞死亡在24~48 h达到峰值,但此病理过程可以持续数周,并且这种长时间细胞损伤最终导致大脑容量明显减少[4]。凋亡和坏死是脑细胞死亡的两个主要机制,但是越来越多的研究表明,其他不同细胞死亡形式同时发生或相继发生[40]。此外,当上游损害因素高于保护性反应的情况下,如果抑制了一种细胞死亡模式,则另一种死亡途径可能会介入[40]。已有研究证明凋亡、坏死、自噬和焦亡等几种类型的细胞死亡方式都与新生儿脑损伤关系密切[4, 41-42]。在发现铁死亡后,最近的研究也证明铁死亡和脑神经系统疾病之间关系密切[16, 38]。因此了解铁死亡在导致HIBD细胞死亡中的潜在分子机制,可为预防和治疗新生儿缺氧缺血性脑病提供新策略和新方法。
铁死亡在成年动物脑损伤中明确存在,不同的铁螯合剂及其类似物在预防这些疾病方面显示出巨大的潜力。实验研究表明对小鼠行大脑中动脉阻塞术后发现,脑组织中铁沉积增加,给予注射铁死亡特异性抑制剂liproxstatin-1后可以减轻脑梗死面积并且改善脑损伤小鼠认知功能;而给予铁死亡特异性抑制剂ferrostatin-1后,也能显著改善神经功能损伤,由此说明铁死亡加重了脑缺血再灌注损伤[15]。另外,在新生鼠HIBD模型中,也可以观察到神经元发生铁死亡,并且给予注射铁死亡抑制剂褪黑素后,能明显抑制神经元铁死亡,促进海马神经元存活,提高HIBD大鼠的学习和记忆能力;使用谷胱甘肽抑制剂RSL3后,可以抑制过氧化物4,促进铁死亡,消除褪黑素对HIBD的保护作用[38]。因此,铁死亡在HIBD中可能起重要作用。
在HIBD时,由于细胞内pH低,蛋白质结合的铁从其结合蛋白中释放出来,并快速在新生大鼠受损神经元和脑室周围白质积累;在新生鼠模型中铁超载导致脑组织氧化应激及脑室周围囊性白质病变[4]。在新生大鼠HIBD模型中,鼻内注射载脂蛋白(转铁蛋白的脂溶性形式),可以减轻脑白质损伤和神经元丢失,并且抑制星形胶质细胞增生,提示超负荷游离铁可以保护细胞免受HIBD氧化应激导致的损伤[43]。促红细胞生成素可通过多种机制起到神经保护作用,包括神经营养、抗氧化、抗凋亡等等,研究表明接受促红细胞生成素治疗的早产儿可以通过降低血清脂质过氧化而降低血清铁蛋白,因此促红细胞生成素也可能通过降低未结合铁和脂质过氧化物水平而抑制铁死亡的发生,从而起到神经保护作用[4, 44]。
过多的谷氨酸是引发铁死亡的主要因素之一。新生儿缺血缺氧时导致神经元和神经胶质细胞去极化,随后将兴奋性氨基酸(如谷氨酸)释放到细胞外,导致基底节区、丘脑及侧脑室等部位谷氨酸升高,并且在缺血缺氧损伤严重的婴儿脑脊液中可以检测出谷氨酸的升高[45]。此外,铁死亡是谷氨酸诱导的神经元细胞死亡的组成部分[46]。氧化作用中谷氨酸介导的细胞膜胱氨酸/谷氨酸反向转运体抑制是诱导铁死亡的主要原因,研究表明缺氧时新生儿脑室周围白质中谷胱甘肽减少,永生的海马神经元HT22细胞株在缺氧时也发现由谷氨酸毒性介导的细胞膜胱氨酸/谷氨酸反向转运体抑制和谷胱甘肽消耗[4]。天麻在治疗神经相关疾病中具有很强的抗氧化活性,研究证明,用天麻预处理HT22细胞可显著抑制谷氨酸诱导的细胞铁死亡的发生[46]。原代小胶质细胞在缺氧条件下,脂质过氧化作用增强,谷胱甘肽水平降低,而铁螯合剂去铁胺可以减少铁诱导的ROS及促炎细胞因子产生[6]。
足月婴儿的大脑富含多不饱和脂肪酸,但抗氧化剂含量低,因此特别容易受到自由基的攻击[47]。新生儿HIBD 12~48 h内时,氧自由基产生增加,并与细胞膜中的不饱和脂肪酸反应,然后导致神经毒性脂质过氧化物产生[47-48]。在围生期窒息新生儿的脐带血中脂质过氧化的最终产物丙二醛增高,并与HIBD损伤程度相关[49]。大量证据已经证明,抗氧化可以减少神经相关疾病中铁死亡的发生。例如天麻预处理抑制了谷氨酸诱导的HT22细胞中ROS的积累,增加超氧化物歧化酶活性,减少丙二醛含量,最终抑制神经元细胞铁死亡的发生[46];铁死亡特异性抑制剂ferrostatin-1可以通过降低脂质ROS的产生及环氧合酶2的表达,从而抑制神经元铁死亡的发生[50];抗氧化剂香芹酚通过降低缺血性脑组织中脂质过氧化物的水平,抑制海马神经元铁死亡的发生,从而改善脑缺血导致的学习和记忆能力损伤[51]。
虽然发育中大脑的细胞死亡机制与成人相比不完全相同,也没有明确的临床体内研究证明HIBD时铁死亡的发生,但是铁代谢、氨基酸代谢和脂质过氧化物调控异常等铁死亡相关机制在HIBD中起重要作用,因此铁死亡可能在HIBD中也起重要作用。
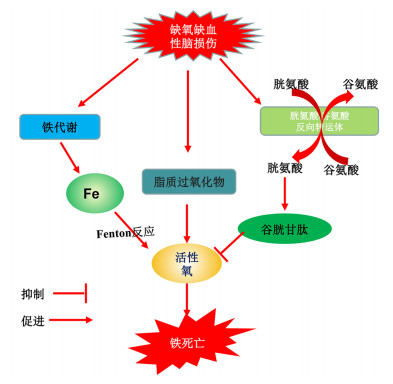
5 结语及展望铁死亡作为一种新型的可调控的细胞死亡方式,通过影响铁代谢、胱氨酸/谷氨酸反向转运体和脂质过氧化物等方面在HIBD的发生和发展过程中起重要作用,因此其具有成为治疗HIBD新靶点的潜力(图 1)。但我们对铁死亡的了解仍处于早期阶段,由于铁死亡的复杂性,导致对铁死亡在HIBD中发挥的具体机制及作用仍不完全清楚。因此,期望随着人们对铁死亡及HIBD之间的因果关系和作用机制的深入研究,临床上可能涌现出通过干预铁死亡而诊治HIBD的新途径和新方法,以减轻HIBD患儿家庭和社会所承受的沉重负担。
|
图 1 铁死亡在HIBD中的作用机制假设示意图 |
| [1] |
Finder M, Boylan GB, Twomey D, et al. Two-year neurodevelopmental outcomes after mild hypoxic ischemic encephalopathy in the era of therapeutic hypothermia[J]. JAMA Pediatr, 2020, 174(1): 48-55. DOI:10.1001/jamapediatrics.2019.4011 (  0) 0) |
| [2] |
Disdier C, Stonestreet BS. Hypoxic-ischemic-related cerebrovascular changes and potential therapeutic strategies in the neonatal brain[J]. J Neurosci Res, 2020, 98(7): 1468-1484. DOI:10.1002/jnr.24590 (  0) 0) |
| [3] |
Juul SE, Comstock BA, Heagerty PJ, et al. High-dose erythropoietin for asphyxia and encephalopathy (HEAL): a randomized controlled trial-background, aims, and study protocol[J]. Neonatology, 2018, 113(4): 331-338. DOI:10.1159/000486820 (  0) 0) |
| [4] |
Wu YN, Song J, Wang YF, et al. The potential role of ferroptosis in neonatal brain injury[J]. Front Neurosci, 2019, 13: 115. DOI:10.3389/fnins.2019.00115 (  0) 0) |
| [5] |
Li J, Cao F, Yin HL, et al. Ferroptosis: past, present and future[J]. Cell Death Dis, 2020, 11(2): 88. DOI:10.1038/s41419-020-2298-2 (  0) 0) |
| [6] |
Rathnasamy G, Ling EA, Kaur C. Iron and iron regulatory proteins in amoeboid microglial cells are linked to oligodendrocyte death in hypoxic neonatal rat periventricular white matter through production of proinflammatory cytokines and reactive oxygen/nitrogen species[J]. J Neurosci, 2011, 31(49): 17982-17995. DOI:10.1523/JNEUROSCI.2250-11.2011 (  0) 0) |
| [7] |
Yang WS, Stockwell BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15(3): 234-245. DOI:10.1016/j.chembiol.2008.02.010 (  0) 0) |
| [8] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 (  0) 0) |
| [9] |
Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541. DOI:10.1038/s41418-017-0012-4 (  0) 0) |
| [10] |
Song Y, Yang H, Lin R, et al. The role of ferroptosis in digestive system cancer[J]. Oncol Lett, 2019, 18(3): 2159-2164. (  0) 0) |
| [11] |
Tang DL, Kang R, Berghe TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5): 347-364. DOI:10.1038/s41422-019-0164-5 (  0) 0) |
| [12] |
Latunde-Dada GO. Ferroptosis: role of lipid peroxidation, iron and ferritinophagy[J]. Biochim Biophys Acta Gen Subj, 2017, 1861(8): 1893-1900. DOI:10.1016/j.bbagen.2017.05.019 (  0) 0) |
| [13] |
Lei PX, Bai T, Sun YL. Mechanisms of ferroptosis and relations with regulated cell death: a review[J]. Front Physiol, 2019, 10: 139. DOI:10.3389/fphys.2019.00139 (  0) 0) |
| [14] |
Li WJ, Feng GS, Gauthier JM, et al. Ferroptotic cell death and TLR4/Trif signaling initiate neutrophil recruitment after heart transplantation[J]. J Clin Invest, 2019, 129(6): 2293-2304. DOI:10.1172/JCI126428 (  0) 0) |
| [15] |
Tuo QZ, Lei P, Jackman KA, et al. Tau-mediated iron export prevents ferroptotic damage after ischemic stroke[J]. Mol Psychiatry, 2017, 22(11): 1520-1530. DOI:10.1038/mp.2017.171 (  0) 0) |
| [16] |
Hou LY, Huang RX, Sun FQ, et al. NADPH oxidase regulates paraquat and maneb-induced dopaminergic neurodegeneration through ferroptosis[J]. Toxicology, 2019, 417: 64-73. DOI:10.1016/j.tox.2019.02.011 (  0) 0) |
| [17] |
Park TJ, Park JH, Lee GS, et al. Quantitative proteomic analyses reveal that GPX4 downregulation during myocardial infarction contributes to ferroptosis in cardiomyocytes[J]. Cell Death Dis, 2019, 10(11): 835. DOI:10.1038/s41419-019-2061-8 (  0) 0) |
| [18] |
Hu ZX, Zhang H, Yi B, et al. VDR activation attenuate cisplatin induced AKI by inhibiting ferroptosis[J]. Cell Death Dis, 2020, 11(1): 73. DOI:10.1038/s41419-020-2256-z (  0) 0) |
| [19] |
Wang H, An P, Xie EJ, et al. Characterization of ferroptosis in murine models of hemochromatosis[J]. Hepatology, 2017, 66(2): 449-465. DOI:10.1002/hep.29117 (  0) 0) |
| [20] |
Zhou BR, Liu J, Kang R, et al. Ferroptosis is a type of autophagy-dependent cell death[J]. Semin Cancer Biol, 2020, 66: 89-100. DOI:10.1016/j.semcancer.2019.03.002 (  0) 0) |
| [21] |
Yan N, Zhang JJ. Iron metabolism, ferroptosis, and the links with Alzheimer's disease[J]. Front Neurosci, 2019, 13: 1443. (  0) 0) |
| [22] |
Yang WS, Kim KJ, Gaschler MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. Proc Natl Acad Sci U S A, 2016, 113(34): E4966-E4975. DOI:10.1073/pnas.1603244113 (  0) 0) |
| [23] |
Abdalkader M, Lampinen R, Kanninen KM, et al. Targeting Nrf2 to suppress ferroptosis and mitochondrial dysfunction in neurodegeneration[J]. Front Neurosci, 2018, 12: 466. DOI:10.3389/fnins.2018.00466 (  0) 0) |
| [24] |
Stockwell BR, Friedmann Angeli JP, Bayir H, et al. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 (  0) 0) |
| [25] |
Toyokuni S, Ito F, Yamashita K, et al. Iron and thiol redox signaling in cancer: an exquisite balance to escape ferroptosis[J]. Free Radic Biol Med, 2017, 108: 610-626. DOI:10.1016/j.freeradbiomed.2017.04.024 (  0) 0) |
| [26] |
Magtanong L, Dixon SJ. Ferroptosis and brain injury[J]. Dev Neurosci, 2018, 40(5-6): 382-395. DOI:10.1159/000496922 (  0) 0) |
| [27] |
Zhang Y, Tan H, Daniels JD, et al. Imidazole ketone erastin induces ferroptosis and slows tumor growth in a mouse lymphoma model[J]. Cell Chem Biol, 2019, 26(5): 623-633.e9. DOI:10.1016/j.chembiol.2019.01.008 (  0) 0) |
| [28] |
Yu HT, Guo PY, Xie XZ, et al. Ferroptosis, a new form of cell death, and its relationships with tumourous diseases[J]. J Cell Mol Med, 2017, 21(4): 648-657. DOI:10.1111/jcmm.13008 (  0) 0) |
| [29] |
Chang LC, Chiang SK, Chen SE, et al. Heme oxygenase-1 mediates BAY 11-7085 induced ferroptosis[J]. Cancer Lett, 2018, 416: 124-137. DOI:10.1016/j.canlet.2017.12.025 (  0) 0) |
| [30] |
Gao MH, Monian P, Quadri N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Mol Cell, 2015, 59(2): 298-308. DOI:10.1016/j.molcel.2015.06.011 (  0) 0) |
| [31] |
Kagan VE, Mao GW, Qu F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nat Chem Biol, 2017, 13(1): 81-90. DOI:10.1038/nchembio.2238 (  0) 0) |
| [32] |
Shah R, Shchepinov MS, Pratt DA. Resolving the role of lipoxygenases in the initiation and execution of ferroptosis[J]. ACS Cent Sci, 2018, 4(3): 387-396. DOI:10.1021/acscentsci.7b00589 (  0) 0) |
| [33] |
Mi YJ, Gao XC, Xu H, et al. The emerging roles of ferroptosis in Huntington's disease[J]. Neuromolecular Med, 2019, 21(2): 110-119. DOI:10.1007/s12017-018-8518-6 (  0) 0) |
| [34] |
Xie Y, Hou W, Song X, et al. Ferroptosis: process and function[J]. Cell Death Differ, 2016, 23(3): 369-379. DOI:10.1038/cdd.2015.158 (  0) 0) |
| [35] |
Mao HM, Zhao YH, Li HX, et al. Ferroptosis as an emerging target in inflammatory diseases[J]. Prog Biophys Mol Biol, 2020, 155: 20-28. DOI:10.1016/j.pbiomolbio.2020.04.001 (  0) 0) |
| [36] |
Conrad M, Pratt DA. The chemical basis of ferroptosis[J]. Nat Chem Biol, 2019, 15(12): 1137-1147. DOI:10.1038/s41589-019-0408-1 (  0) 0) |
| [37] |
Gaschler MM, Stockwell BR. Lipid peroxidation in cell death[J]. Biochem Biophys Res Commun, 2017, 482(3): 419-425. DOI:10.1016/j.bbrc.2016.10.086 (  0) 0) |
| [38] |
Gou ZX, Su XJ, Hu X, et al. Melatonin improves hypoxic-ischemic brain damage through the Akt/Nrf2/Gpx4 signaling pathway[J]. Brain Res Bull, 2020, 163: 40-48. DOI:10.1016/j.brainresbull.2020.07.011 (  0) 0) |
| [39] |
O'Brien CE, Santos PT, Kulikowicz E, et al. Hypoxia-ischemia and hypothermia independently and interactively affect neuronal pathology in neonatal piglets with short-term recovery[J]. Dev Neurosci, 2019, 41(1-2): 17-33. DOI:10.1159/000496602 (  0) 0) |
| [40] |
Thornton C, Leaw B, Mallard C, et al. Cell death in the developing brain after hypoxia-ischemia[J]. Front Cell Neurosci, 2017, 11: 248. (  0) 0) |
| [41] |
Li T, Li KN, Zhang S, et al. Overexpression of apoptosis inducing factor aggravates hypoxic-ischemic brain injury in neonatal mice[J]. Cell Death Dis, 2020, 11(1): 77. DOI:10.1038/s41419-020-2280-z (  0) 0) |
| [42] |
Zhou RX, Yang XY, Li XH, et al. Recombinant CC16 inhibits NLRP3/caspase-1-induced pyroptosis through p38 MAPK and ERK signaling pathways in the brain of a neonatal rat model with sepsis[J]. J Neuroinflammation, 2019, 16(1): 239. DOI:10.1186/s12974-019-1651-9 (  0) 0) |
| [43] |
Guardia Clausi M, Paez PM, Campagnoni AT, et al. Intranasal administration of aTf protects and repairs the neonatal white matter after a cerebral hypoxic-ischemic event[J]. Glia, 2012, 60(10): 1540-1554. DOI:10.1002/glia.22374 (  0) 0) |
| [44] |
Song J, Sun HQ, Xu FL, et al. Recombinant human erythropoietin improves neurological outcomes in very preterm infants[J]. Ann Neurol, 2016, 80(1): 24-34. DOI:10.1002/ana.24677 (  0) 0) |
| [45] |
Pu YL, Garg A, Corby R, et al. A positive correlation between alpha-glutamate and glutamine on brain 1H-MR spectroscopy and neonatal seizures in moderate and severe hypoxic-ischemic encephalopathy[J]. AJNR Am J Neuroradiol, 2008, 29(2): 216. DOI:10.3174/ajnr.A0798 (  0) 0) |
| [46] |
Jiang T, Cheng H, Su JJ, et al. Gastrodin protects against glutamate-induced ferroptosis in HT-22 cells through Nrf2/HO-1 signaling pathway[J]. Toxicol In Vitro, 2020, 62: 104715. DOI:10.1016/j.tiv.2019.104715 (  0) 0) |
| [47] |
Negro S, Benders MJNL, Tataranno ML, et al. Early prediction of hypoxic-ischemic brain injury by a new panel of biomarkers in a population of term newborns[J]. Oxid Med Cell Longev, 2018, 2018: 7608108. (  0) 0) |
| [48] |
Ramy N, Al Sharany W, Mohamed MA, et al. Lipid peroxides in the serum of asphyxiated neonates[J]. J Perinatol, 2016, 36(10): 849-852. DOI:10.1038/jp.2016.97 (  0) 0) |
| [49] |
El Bana SM, Maher SE, Gaber AF, et al. Serum and urinary malondialdehyde (MDA), uric acid, and protein as markers of perinatal asphyxia[J]. Electron Physician, 2016, 8(7): 2614-2619. DOI:10.19082/2614 (  0) 0) |
| [50] |
Li Q, Han XN, Lan X, et al. Inhibition of neuronal ferroptosis protects hemorrhagic brain[J]. JCI Insight, 2017, 2(7): e90777. DOI:10.1172/jci.insight.90777 (  0) 0) |
| [51] |
Guan XY, Li XL, Yang XJ, et al. The neuroprotective effects of carvacrol on ischemia/reperfusion-induced hippocampal neuronal impairment by ferroptosis mitigation[J]. Life Sci, 2019, 235: 116795. DOI:10.1016/j.lfs.2019.116795 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


