2. 中南大学湘雅公共卫生学院流行病与卫生统计系, 湖南长沙 410078;
3. 湖南省妇幼保健院国家卫健委出生缺陷研究与预防重点实验室, 湖南长沙 410008;
4. 湖南省儿童医院心胸外科,湖南长沙 410007
先天性心脏病(congenital heart disease,CHD)是指胚胎发育时期由于心脏及大血管的形成障碍而引起的局部解剖结构异常,或出生后应闭合的通道未闭合而引起的心脏、血管功能异常,是我国最常见的出生缺陷和婴幼儿非感染性死亡的主要原因。全球发病率为8.22‰[1],我国为8.98‰[2],发病呈逐年上升趋势[3]。此外,即使经过有效干预,CHD患者仍存在较高的心血管疾病及死亡风险,并可能在行为、认知、注意力和运动表现等方面存在功能缺陷[4-5]。同其他复杂疾病一样,CHD病因涉及遗传和环境因素。流行病学证据显示围孕期增补叶酸或含叶酸的多种维生素能有效降低CHD的发生风险[6],但这种危险降低的机制并不清楚。调查与叶酸代谢、吸收和转运相关酶基因的遗传变异有助于解释叶酸相关出生缺陷的发生机制。许多学者已经将焦点集中于影响叶酸代谢的酶基因上,包括5, 10亚甲基四氢叶酸还原酶基因、蛋氨酸合酶还原酶基因、胱硫醚β合酶基因等[7-8]。然而,在机体利用叶酸过程中,除上述与叶酸代谢有关的酶外,尚有叶酸转运过程中涉及到的受体及载体,如叶酸受体和还原叶酸载体(reduced folate carrier,RFC)也在叶酸吸收转运进入细胞过程中发挥关键作用[9]。因此,RFC基因的突变或表达异常可能成为孕母叶酸正常代谢过程的重要影响因素。值得注意的是,虽然有研究显示RFC基因单核苷酸多态性(single nucleotide polymorphism,SNP)与CHD发生存在关联[10],但这些研究只关注了该基因的一个位点(rs1051266)。RFC基因上除了已经关注的位点外,尚有其他SNP位点。本研究首次关注母亲RFC基因多个位点(rs10483080、rs2236484、rs3788190、rs3788189、rs12483377、rs2330183)与子代CHD的关联,能为CHD遗传易感因素研究提供流行病学依据,也为揭示叶酸预防出生缺陷的潜在作用机制提供线索。
1 资料与方法 1.1 研究对象采用以医院为基础的病例对照研究,招募2017年11月至2020年3月在湖南省儿童医院心胸外科就诊的683例CHD婴儿的母亲为病例组。诊断的CHD亚型包括:房间隔缺损、室间隔缺损、房室隔缺损、动脉导管未闭、主肺动脉隔缺损、法洛四联症、完全大动脉转位。招募同期因感冒、腹泻、外伤等就诊于同一家医院并排除任何畸形的740例婴儿的母亲为对照组。
1.2 纳入与排除标准所有CHD患儿均为单纯性CHD,排除其他系统畸形,均符合临床诊断标准,并且经心脏彩超或术中探查证实。对照组患儿经体检初筛及心脏彩超证实心脏结构、功能均正常,且无染色体异常及系统性畸形等疾病。研究对象需满足以下标准:(1)了解本项目并签署知情同意,愿意配合本课题调查研究;(2)彼此无亲缘关系;(3)完成调查问卷并愿意提供血标本用于本课题基因SNP检测;(4)汉族;(5)单胎受孕。本研究排除辅助生殖技术受孕、多胎受孕或患有精神障碍性疾病不能配合完成调查的产妇。为了降低对孕前或孕期环境暴露的回忆偏倚,本研究也排除产后超过1年的产妇。
1.3 问卷调查本研究使用统一的问卷调查表,所有调查员经过统一培训,以访谈的形式对研究对象进行流行病学问卷调查。调查内容包括:产妇基本社会人口学特征(孕龄、文化程度、家庭年收入、民族、户籍等)、出生缺陷家族史、个人先天畸形史、家族近亲婚配史、既往不良妊娠史(自然流产、死胎或死产、早产、低出生体重、妊娠糖尿病、妊娠高血压等)、围孕期感冒和发热史、围孕期生活行为史(主动吸烟、二手烟暴露、饮酒史等)、围孕期叶酸补充情况、围孕期环境污染物接触史等。围孕期定义为怀孕前3个月至怀孕后12周。为防止回忆偏倚,本研究结合孕母妇幼保健手册,以进一步确认围孕期相关暴露信息。
1.4 基因多态性检测完成问卷后,采集产妇5 mL静脉血用于基因SNP检测。本研究选择RFC基因作为备检基因,并参考已发表的文献[11]所介绍的方法来选择相关候选位点。检索NCBI和HapMap数据库,查询并核实RFC基因主要的SNP位点,要求选择tanSNP时r2所设的阈值不小于0.8,且最小等位基因频率(minor allele frequency,MAF)不低于10%。最终,6个位点(rs10483080、rs2236484、rs3788190、rs3788189、rs12483377、rs2330183)被确定为本研究的待检位点。采用QIAamp DNA Mini Kit(Qiagen,Valencia,CA,USA)提取血细胞中的DNA,用紫外分光光度计测定DNA溶液的浓度和纯度。应用MassARRAY飞行时间质谱对6个位点的SNP进行检测,具体检测工作由博淼生物科技(北京)有限公司完成。
1.5 统计学分析采用EpiData 3.1软件建立数据库,应用SPSS 22.0软件进行统计学分析。计数资料采用率或构成比(%)描述,组间比较采用卡方检验或Fisher确切概率法;等级资料比较采用Wilcoxon秩和检验。对对照组人群基因型分布频率进行哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)检验(如果P > 0.01,说明对照样本符合HWE)。采用logistic回归模型计算优势比(odds ratio,OR)和95%置信区间(confidence interval,CI),以评估RFC基因SNP与CHD的关联性。采用基因模型选择(genetic model selection,GMS)的方法判定各位点与疾病关联的遗传模型[当哈迪-温伯格不平衡趋势检验(Hardy-Weinberg disequilibrium trend test,HWDTT)ZHWDTT < -1.645时,判定为显性模型;ZHWDTT > 1.645时,判定为隐性模型;ZHWDTT > -1.645或ZHWDTT < 1.645时,判定为加性模型]。利用Haploview 4.2软件计算各位点之间的r2值,r2 > 0.8表明两个位点之间存在连锁不平衡;同时,利用四配子检验的方法构建单倍型,并评估各单倍型与CHD发生的关联。采用广义多因子降维法探讨各位点间交互作用与CHD发生的关联。涉及多重比较时,采用错误发现率(false discovery rate,FDR)校正的方法调整P值以控制假阳性率,得到校正P值(QFDR),并以QFDR≤0.05作为差异有统计学意义的判定标准。
2 结果 2.1 两组基线资料比较病例组和对照组产妇户籍、文化程度、家庭年收入、家族出生缺陷史和近亲婚配史、既往不良妊娠史(死胎或死产、妊娠糖尿病、妊娠高血压)及围孕期感冒或发热史、叶酸补充、不良生活习惯(主动或被动吸烟、饮酒)和环境污染物接触史方面比较差异有统计学意义(P < 0.05),这些因素将作为后续多因素分析的混杂因素进行控制,见表 1。
| 表 1 病例组和对照组的基线资料比较[例(%)] |
|
|
HWE检验显示,对照组人群RFC基因有1个位点(rs10483080)的基因型分布不符合HWE(P < 0.001),因此后续分析中不纳入该位点(表 2)。多因素logistic回归分析显示,在调整表 1基线资料比较中差异有统计学意义的混杂因素后,母亲RFC基因的两个位点rs2236484和rs2330183的多态性与CHD风险存在关联(表 3)。在位点rs2236484上,携带AG(OR=1.91,95%CI:1.45~2.51;QFDR < 0.001)或GG(OR=1.96,95%CI:1.40~2.75;QFDR < 0.001)基因型的母亲与携带AA基因型相比,子代CHD的风险显著增加;该位点的显性模型(OR=1.93,95%CI:1.48~2.50;QFDR < 0.001)和加性模型(OR=1.43,95%CI:1.21~1.69;QFDR < 0.001)与CHD风险存在关联。在位点rs2330183上,携带CT(OR=1.39,95%CI:1.06~1.83;QFDR=0.045)基因型的母亲与携带CC基因型比较显著增加了子代CHD的风险;该位点显性模型(OR=1.39,95%CI:1.07~1.79;QFDR=0.030)与CHD风险存在关联。
| 表 2 母亲RFC基因型分布频数及HWE检验(例) |
|
|
| 表 3 母亲RFC基因多态性与CHD关联的logistic回归分析 |
|
|
基于HWDTT,利用病例组和对照组在各位点不同基因型频率,计算各位点对应的统计量ZHWDTT,并通过与C=1.645相比,判定各位点的遗传模型,结果见表 4。可见,母亲RFC基因与子代CHD风险存在关联的两个位点rs2236484和rs2330183的遗传模型均为显性模型。
| 表 4 各位点遗传模型分析 |
|
|
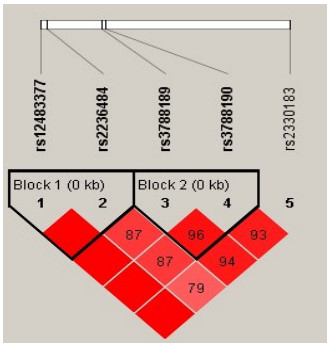
连锁不平衡分析显示,母亲RFC基因的两个位点rs3788189和rs3788190之间存在连锁不平衡(r2=0.916),提示两个位点间强关联(表 5)。单倍型分析显示,RFC基因的5个位点共形成2个单倍型块(Block)。Block1涉及两个位点rs12483377和rs2236484,构成3种单倍型:G-A、G-G和A-G。Block2涉及两个位点rs3788189和rs3788190,构成3种单倍型:G-A、T-G和G-G(图 1)。在Block1中,母亲携带单倍型G-G(OR=1.21,95%CI:1.03~1.41)显著增加子代CHD的风险;在Block2中,母亲携带单倍型T-G(OR=1.25,95%CI:1.07~1.46)显著增加子代CHD的风险(表 6)。
| 表 5 基因位点连锁不平衡检验 |
|
|
|
图 1 RFC基因各位点连锁不平衡图 图中红色方框代表位点连锁不平衡的程度,颜色越深表示位点之间连锁不平衡强度越强。框中数值为连锁不平衡指标的具体值,接近于100,提示两位点之间连锁不平衡强度越强;接近于0,则提示两位点连锁不平衡强度越弱,即趋向于遗传平衡。数字1~5分别对应数字上方的位点rs号。 |
| 表 6 单倍型分析及其在病例组和对照组中的分布情况 |
|
|
采用广义多因子降维法分析RFC基因各位点间的交互作用。结果显示,2个位点(rs2236484和rs2330183)的一阶交互作用、3个位点(rs2236484、rs3788189和rs2330183)的二阶交互作用、4个位点(rs2236484、rs3788189、rs12483377和rs2330183)的三阶交互作用可能与CHD的发生风险存在关联(P=0.001),见表 7。
| 表 7 RFC基因各位点间交互作用分析 |
|
|
母亲妊娠前后增补叶酸或含叶酸的维生素可以有效降低神经管畸形、唇腭裂及CHD的发病风险[6, 12-13]。因此,围孕期增补叶酸已成为预防神经管畸形等先天缺陷的一级预防措施。然而,妊娠期增补叶酸可以降低出生缺陷发生风险的机制仍不清楚。研究影响叶酸的细胞吸收、转运及代谢的遗传变异能帮助解释一部分叶酸相关出生缺陷的发病机制。目前,国内外的研究大多只关注叶酸代谢相关基因的遗传变异对CHD的影响。本研究分析了母亲RFC基因的6个SNP与子代CHD的关联。结果表明,RFC基因rs2236484和rs2330183位点的多态性与子代CHD的发生显著相关。RFC基因位于21号染色体(21q22.2-22.3),编码分子量在80~120 kDa间的膜蛋白,对还原叶酸具有高亲和力[14]。RFC主要的生理功能是与叶酸受体共同作用完成叶酸从组织到细胞内的转运,介导叶酸在肠道的吸收,以维持细胞内的叶酸浓度[15]。作为叶酸转运的主要载体,还原叶酸载体促进叶酸向胎盘的转移,有利于DNA合成和细胞增生,对胚胎的生长和分化具有重要意义[16]。已有研究表明RFC基因多态性与血浆中叶酸水平降低和同型半胱氨酸水平升高显著相关[14]。因此,RFC基因突变或异常表达可能导致RFC酶活性降低,RFC转运叶酸能力下降,叶酸的正常代谢受到影响进而导致组织发育异常,从而增加CHD的风险[17]。
既往关于RFC基因多态性与疾病的研究多集中在神经管畸形和颅面畸形[9, 18-19],仅有3项研究评估了其与CHD的关联[10, 20-21]。但是这些研究都只关注了RFC基因上的一个位点rs1051266(A80G),结果表明rs1051266位点突变与子代CHD、神经管畸形及颅面畸形等出生缺陷的高患病风险存在关联[10, 20-21]。本研究首次关注了RFC基因上多个位点(rs10483080、rs2236484、rs3788190、rs3788189、rs12483377、rs2330183)与子代CHD的关系,为揭示RFC基因的遗传变异与CHD发病机制的关系提供潜在的线索。此外,本研究还对各位点的遗传模型进行了筛选并在分析单个位点基因多态性的基础上进行了单倍型分析。由于在复杂疾病的研究中很难事先明确基因的遗传模式,且错误的遗传模型会降低分析的检验效能,因此对单个位点的遗传模型进行筛选能更清晰地明确基因在疾病发生中的作用[22-23]。RFC基因各位点的遗传模型分析结果显示,与子代CHD发生相关的rs2236484和rs2330183位点均为显性模型。单倍型是等位基因的线性排列,具有整体遗传的趋势[24]。在基因与疾病的关联分析中结合单倍型有助于更精准地定位致病基因。RFC基因的5个位点共形成2个单倍型块,Block1中的单倍型G-G与Block2中的单倍型T-G均显著增加子代CHD的风险。
本研究的局限性:第一,作为一项以医院为基础的病例对照研究,本研究在资料的收集上不可避免地存在回忆偏倚。为了减少这种偏倚,选择1岁以内儿童的母亲作为研究对象并结合孕母妇幼保健手册确认围孕期相关暴露信息。第二,本研究只纳入活产住院的CHD患者,那些因为CHD流产的病例并未纳入,这可能导致选择性偏倚。第三,由于样本量的限制,本研究未对RFC基因多态性与不同CHD亚型的关联进行评估。
综上所述,母亲RFC基因两个位点(rs2236484和rs2330183)的遗传变异与子代CHD的发生风险升高显著相关,并且该基因各位点之间在CHD的发生中存在交互作用,这为CHD遗传易感因素的研究提供了新的流行病学证据,也为揭示叶酸预防出生缺陷的潜在作用机制提供线索。然而,RFC基因的遗传变异如何影响CHD发生的潜在机制仍不明确,未来需要开展更多研究。
志谢: 本研究得到了湖南省儿童医院心胸外科的全力支持。该科室工作人员在繁忙的工作中承担了收集病例资料及收集标本的任务,同时为我们进行现场调查提供支持。在此,我们对该科室工作人员表示诚挚的感谢!
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Liu YJ, Chen S, Zühlke L, et al. Global birth prevalence of congenital heart defects 1970-2017:updated systematic review and meta-analysis of 260 studies[J]. Int J Epidemiol, 2019, 48(2): 455-463. DOI:10.1093/ije/dyz009 PMID: 30783674. (  0) 0) |
| [2] |
Zhao QM, Liu F, Wu L, et al. Prevalence of congenital heart disease at live birth in China[J]. J Pediatr, 2019, 204: 53-58. DOI:10.1016/j.jpeds.2018.08.040 PMID: 30270157. (  0) 0) |
| [3] |
Zhao LJ, Chen LZ, Yang TB, et al. Birth prevalence of congenital heart disease in China, 1980-2019:a systematic review and meta-analysis of 617 studies[J]. Eur J Epidemiol, 2020, 35(7): 631-642. DOI:10.1007/s10654-020-00653-0 PMID: 32519018. (  0) 0) |
| [4] |
Wang TT, Chen LZ, Yang TB, et al. Congenital heart disease and risk of cardiovascular disease: a meta-analysis of cohort studies[J]. J Am Heart Assoc, 2019, 8(10): e012030. DOI:10.1161/JAHA.119.012030 PMID: 31070503. (  0) 0) |
| [5] |
Willinger L, Brudy L, Meyer M, et al. Prognostic value of non-acute high sensitive troponin-T for cardiovascular morbidity and mortality in adults with congenital heart disease: a systematic review[J]. J Cardiol, 2021. DOI: 10.1016/j.jjcc.2021.02.008. PMID: 33678488. Epub ahead of print.
(  0) 0) |
| [6] |
Qu YJ, Lin S, Zhuang J, et al. First-trimester maternal folic acid supplementation reduced risks of severe and most congenital heart diseases in offspring: a large case-control study[J]. J Am Heart Assoc, 2020, 9(13): e015652. DOI:10.1161/JAHA.119.015652 PMID: 32613868. (  0) 0) |
| [7] |
Shi H, Yang SW, Liu Y, et al. Study on environmental causes and SNPs of MTHFR, MS and CBS genes related to congenital heart disease[J]. PLoS One, 2015, 10(6): e0128646. DOI:10.1371/journal.pone.0128646 PMID: 26035828. (  0) 0) |
| [8] |
Li YH, Diao JY, Li JQ, et al. Association of maternal dietary intakes and CBS gene polymorphisms with congenital heart disease in offspring[J]. Int J Cardiol, 2021, 322: 121-128. DOI:10.1016/j.ijcard.2020.08.018 PMID: 32800907. (  0) 0) |
| [9] |
Imani MM, Mozaffari HR, Sharifi R, et al. Polymorphism of reduced folate carrier 1(A80G) and non-syndromic cleft lip/palate: a systematic review and meta-analysis[J]. Arch Oral Biol, 2019, 98: 273-279. DOI:10.1016/j.archoralbio.2018.12.005 PMID: 30579244. (  0) 0) |
| [10] |
Shaw GM, Zhu HP, Lammer EJ, et al. Genetic variation of infant reduced folate carrier (A80G) and risk of orofacial and conotruncal heart defects[J]. Am J Epidemiol, 2003, 158(8): 747-752. DOI:10.1093/aje/kwg189 PMID: 14561664. (  0) 0) |
| [11] |
Shaw GM, Lu W, Zhu HP, et al. 118 SNPs of folate-related genes and risks of spina bifida and conotruncal heart defects[J]. BMC Med Genet, 2009, 10: 49. DOI:10.1186/1471-2350-10-49 PMID: 19493349. (  0) 0) |
| [12] |
Viswanathan M, Treiman KA, Kish-Doto J, et al. Folic acid supplementation for the prevention of neural tube defects an updated evidence report and systematic review for the US Preventive Services Task Force[J]. JAMA, 2017, 317(2): 190-203. DOI:10.1001/jama.2016.19193 PMID: 28097361. (  0) 0) |
| [13] |
Zhou YL, Sinnathamby V, Yu YM, et al. Folate intake, markers of folate status and oral clefts: an updated set of systematic reviews and meta-analyses[J]. Birth Defects Res, 2020, 112(19): 1699-1719. DOI:10.1002/bdr2.1827 PMID: 33118705. (  0) 0) |
| [14] |
Chango A, Emery-Fillon N, de Courcy GP, et al. A polymorphism (80G- > A) in the reduced folate carrier gene and its associations with folate status and homocysteinemia[J]. Mol Genet Metab, 2000, 70(4): 310-315. DOI:10.1006/mgme.2000.3034 PMID: 10993718. (  0) 0) |
| [15] |
裴丽君, 李竹. 还原叶酸载体基因(RFC1)与神经管和颅面畸形病因学关系的研究进展[J]. 遗传, 2004, 26(2): 239-243. DOI:10.3321/j.issn:0253-9772.2004.02.022 PMID: 15639995. (  0) 0) |
| [16] |
Eudy JD, Spiegelstein O, Barber RC, et al. Identification and characterization of the human and mouse SLC19A3 gene: a novel member of the reduced folate family of micronutrient transporter genes[J]. Mol Genet Metab, 2000, 71(4): 581-590. DOI:10.1006/mgme.2000.3112 PMID: 11136550. (  0) 0) |
| [17] |
弟娟娟, 王金桃, 丁玲, 等. 还原叶酸载体基因多态性与宫颈癌关系的病例对照研究[J]. 中华流行病学杂志, 2009, 30(2): 189-191. DOI:10.3760/cma.j.issn.0254-6450.2009.02.022 PMID: 19565885. (  0) 0) |
| [18] |
O'leary VB, Pangilinan F, Cox C, et al. Reduced folate carrier polymorphisms and neural tube defect risk[J]. Mol Genet Metab, 2006, 87(4): 364-369. DOI:10.1016/j.ymgme.2005.09.024 PMID: 16343969. (  0) 0) |
| [19] |
Soghani B, Ebadifar A, Khorram Khorshid HR, et al. The study of association between reduced folate carrier 1(RFC1) polymorphism and non-syndromic cleft lip/palate in Iranian population[J]. Bioimpacts, 2017, 7(4): 263-268. DOI:10.15171/bi.2017.31 PMID: 29435434. (  0) 0) |
| [20] |
裴丽君, 任爱国, 郝玲, 等. 还原叶酸载体基因多态性与先天性心脏病和唇腭裂关联的研究[J]. 中华流行病学杂志, 2004, 25(12): 1063-1067. DOI:10.3760/j.issn:0254-6450.2004.12.013 PMID: 15769366. (  0) 0) |
| [21] |
Wang BJ, Liu MJ, Yan WH, et al. Association of SNPs in genes involved in folate metabolism with the risk of congenital heart disease[J]. J Matern Fetal Neonatal Med, 2013, 26(18): 1768-1777. DOI:10.3109/14767058.2013.799648 PMID: 23701284. (  0) 0) |
| [22] |
孙盼盼. rs2241766及rs266729位点与2型糖尿病关联的遗传模式推导[D]. 郑州: 郑州大学, 2018.
(  0) 0) |
| [23] |
Balding DJ. A tutorial on statistical methods for population association studies[J]. Nat Rev Genet, 2006, 7(10): 781-791. DOI:10.1038/nrg1916 PMID: 16983374. (  0) 0) |
| [24] |
李岩. DIP2基因家族单核苷酸多态性与孤独症谱系障碍及其临床表型的关联研究[D]. 长春: 吉林大学, 2020.
(  0) 0) |
 2021, Vol. 23
2021, Vol. 23


