迟发型败血症(late-onset sepsis,LOS)是指生后72 h以后发生的败血症,是极低出生体重儿在救治过程中面临的一个严峻问题,体重越低,胎龄越小,其发病率越高[1-4]。极低出生体重儿的LOS发生率为21%~30%,超低出生体重儿LOS发生率高达30%~40%[1-4]。LOS不仅增加极低出生体重儿的住院费用和住院时间,还增加其病死率和发病率[1, 5-6]。因此,如何减少LOS的发生在极低出生体重儿的救治中至关重要。
益生菌可调节消化道微生物的构成,促进消化道结构、功能完善和调节机体免疫,目前在预防坏死性小肠结肠炎、促进喂养、预防感染等方面得到广泛应用[7]。为降低极低出生体重儿LOS的发生率,目前已有不少关于益生菌预防极低出生体重儿或早产儿LOS的Meta分析[8-12]。虽然这些研究提示益生菌能显著降低极低出生体重儿或早产儿LOS的发生率,但是这些研究中纳入文献的败血症类型并不十分统一。大部分纳入文献的败血症类型为培养证实的败血症,但也有部分纳入没有明确说明败血症类型的研究[13-14],或者纳入文献包含的败血症数据为临床/确定败血症的总发生率[15]。这种不区分败血症类型的Meta分析可能会降低结果的可信度。本研究纳入研究结局包含明确类型新生儿LOS的文献进行Meta分析,进一步评估益生菌对预防极低出生体重儿LOS的有效性。
1 资料与方法 1.1 文献纳入标准和排除标准纳入标准:(1)国内外以中英文发表的临床随机对照试验(randomized controlled trial,RCT);(2)研究对象为出生体重≤1 500 g的新生儿;(3)研究方法为在相同的治疗基础上,干预组给予益生菌治疗,对照组给予安慰剂或空白对照;(4)研究结局包含明确类型或定义的LOS(生后 > 72 h发生的败血症);(5)原始数据提供或通过计算可得到相对危险度(relative risk,RR)及95%可信区间(confidence interval,CI);(6)若有重复文献,只纳入最早发表的文献。
排除标准:(1)报道信息太少、缺乏全文及无法利用的研究;(2)合并先天畸形或特殊先天性感染暴露风险的研究。
鉴于目前国际上关于新生儿败血症的诊断标准尚未统一[16],因此本研究根据国内外常用的新生儿败血症诊断标准[16],把新生儿败血症分为临床败血症和确定败血症。临床败血症指无菌腔液培养阴性的全身炎症反应综合征,而确定败血症则为无菌腔液培养阳性证实的全身炎症反应综合征。
1.2 文献检索策略计算机检索PubMed、Web of Science、Cochrane Library、万方数据库、中国知网、中国生物医学文献数据库等6个数据库,检索时间均为建库至2020年9月30日。
英文数据库的检索策略以PubMed为例:用((low birth weight)OR(very low birth weight)OR(extremely low birth weight)OR(preterm OR premature))AND(probiotic OR lactobacillus OR bifidobacterium OR saccharomyces OR Streptococcus)进行检索。对于Web of Science和Cochrane Library数据库,以类似的方式进行检索。同时手工检索所有纳入文献的参考文献。
中文数据库的检索策略以万方数据库为例:用“益生菌AND(败血症OR脓毒症OR脓毒血症)AND(低出生体重儿OR早产儿)”进行检索。对于中国知网和中国生物医学文献数据库,以类似的方式进行检索。同时手工检索所有纳入文献的参考文献。
1.3 文献筛选、质量评价及资料提取由2名研究人员根据文献纳入和排除标准独立进行文献筛选。使用Jadad量表对纳入文献进行质量评价:1~2分为低质量文献,3~5分为高质量文献[17]。并完成研究对象基本特征、干预措施、研究结局等资料的提取。此过程如遇争议则通过讨论决定,必要时由第3名研究人员加入讨论决定。当文献资料缺乏或不全时尽量联系作者补充,如果联系作者后仍无法获得足够信息的文献则予以排除。
1.4 统计学分析使用RevMan 5.4和Stata(SE)16软件分别进行Meta分析和发表偏倚评价。使用I2检验和Q检验对纳入数据进行一致性评价。若I2 < 50%且Q检验P > 0.1,认为各研究间一致性较好,使用固定效应模型进行合并分析;若I2≥50%或Q检验P≤0.1,认为各研究间存在异质性,尽可能评估异质性来源并进行分层分析,无法排除异质性则采用随机效应模型进行合并分析。使用Begg法、Egger法对发表偏倚进行评价。计数资料采用RR及其95%CI为效应指标。P < 0.05表示有统计学意义。
2 结果 2.1 文献检索结果和纳入文献的基本情况共检索出949篇文献,最终纳入31篇[15, 18-47]。总计纳入病例数6 866例,其中益生菌组3 490例,对照组3 376例。文献筛选流程见图 1。

|
图 1 文献筛选流程图 |
纳入的31篇RCT文献中,4篇报道了临床LOS结局[31, 33, 41-42],28篇报道了确定LOS结局[18-29, 31-45, 47],5篇报道了临床/确定LOS(临床LOS与确定LOS的集合)结局[15, 30, 33, 42, 46]。其中高质量文献27篇[19-34, 36-44, 46-47],低质量文献4篇[15, 18, 35, 45]。纳入文献的基本情况见表 1。
| 表 1 纳入文献的基本情况 |
|
|
4篇文献[31, 33, 41-42]对临床LOS的结局进行了报道,且均为高质量文献。各研究间一致性较好(I2=0%,P=0.50),采用固定效应模型进行分析。Meta分析结果显示,与对照组相比,益生菌组临床LOS的发生风险较低(RR=0.79,95%CI:0.66~0.94,P=0.009),见图 2。
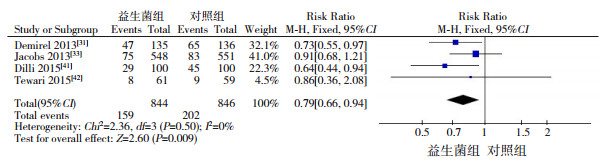
|
图 2 益生菌对临床LOS的影响 |
28篇文献[18-29, 31-45, 47]对确定LOS的结局进行了报道,其中高质量文献25篇[19-29, 31-34, 36-44, 47],低质量文献3篇[18, 35, 45]。各研究间存在异质性(I2=35%,P=0.04),采用随机效应模型进行分析。Meta分析结果显示,益生菌组确定LOS发生风险与对照组相比差异无统计学意义(RR=0.88,95%CI:0.78~1.00,P=0.06)(图 3)。各研究间异质性可能来源包括胎龄、出生体重、益生菌种类、喂养方式、文献质量等因素,并根据这些因素进行分层分析。分层分析结果显示,益生菌组纯母乳喂养者其确定LOS发生风险低于对照组(RR=0.77,95%CI:0.62~0.96,P=0.02),但胎龄、出生体重、益生菌种类、文献质量等因素的分层分析均提示益生菌组与对照组确定LOS的发生风险差异无统计学意义(表 2)。

|
图 3 益生菌对确定LOS的影响 |
| 表 2 益生菌对确定LOS影响的异质性因素的分层分析 |
|
|
5篇文献[15, 30, 33, 42, 46]对临床/确定LOS的结局进行了报道,其中高质量文献4篇[30, 33, 42, 46],低质量文献1篇[15]。各研究间一致性较好(I2=43%,P=0.14),采用固定效应模型进行分析。Meta分析结果显示,与对照组相比,益生菌组临床/确定LOS发生风险较低(RR=0.79,95%CI:0.67~0.94,P=0.007),见图 4。剔除低质量文献[15]进行分析,并没有改变合并结局和森林图方向(RR=0.828,95%CI:0.688~0.996,P=0.045)。
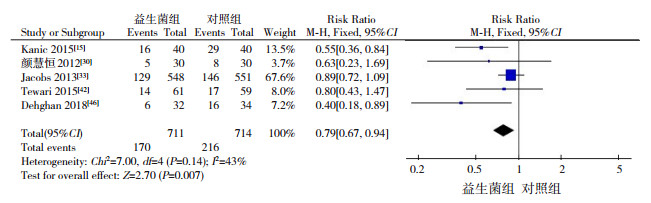
|
图 4 益生菌对临床/确定LOS的影响 |
在益生菌对临床LOS的影响(Begg法P=0.734,Egger法P=0.933)、益生菌对确定LOS的影响(Begg法P=0.228,Egger法P=0.337)(图 5)及益生菌对临床/确定LOS的影响(Begg法P=0.806,Egger法P=0.151)的发表偏倚检验中,均提示无明显发表偏倚。
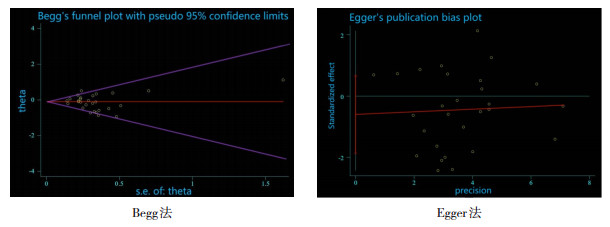
|
图 5 益生菌对确定LOS的影响的发表偏倚检验 Begg法和Egger法检验均提示无明显发表偏倚。 |
本研究纳入的31篇文献中,高质量文献27篇,低质量文献4篇,以高质量文献为主。在Meta分析过程中文献质量的高低并未改变合并的结局和森林图方向,而且同时采用Begg法和Egger法评估发表偏倚均提示无明显的发表偏倚。
本研究显示益生菌能显著降低极低出生体重儿临床LOS、临床/确定LOS的发生风险,但在确定LOS中没有观察到类似的结局。由此推断,临床/确定LOS的显著差异性结局可能主要来源于临床LOS方面的影响。此外,在临床LOS和临床/确定LOS的Meta分析过程中,由于两者的纳入文献数目均较少,分别只有4篇和5篇,且纳入文献之间的益生菌使用种类差异较大,故在本研究中没能通过益生菌种类的分层分析寻找出对临床LOS、临床/确定LOS有价值的益生菌。因此,仍然需要更多的RCT去评估益生菌预防极低出生体重儿临床LOS及临床/确定LOS的有效性。
目前,有不少已发表的Meta分析[8-12]均提示益生菌能显著降低极低出生体重儿或早产儿LOS的发生率。本Meta分析得出的确定LOS的结果与之并不一致。主要原因可能是本研究通过文献纳入标准和以败血症类型为分层标准的分析方法,排除了类型不明确的LOS和临床LOS对确定LOS合并结果的影响。在益生菌对确定LOS影响的异质性因素的分层分析中,显示益生菌能显著降低纯母乳喂养的极低出生体重儿确定LOS的发生风险,但不能显著降低其他喂养方式的确定LOS的发生风险,这与Aceti等[8]、Zhang等[9]的研究结果一致。同时,有系统评价表明,与配方奶喂养相比,单纯的母乳喂养并不能显著降低极低出生体重儿确定LOS的发生率[48]。由此推断,预防极低出生体重儿确定LOS的发生可能需要益生菌和母乳共同作用。
由于目前国际上缺乏新生儿败血症诊断的统一标准,而各指南中新生儿败血症诊断依据之间差异的本质是目前没有对新生儿全身炎症反应综合征进行准确定义[16]。因此在本研究中,各纳入文献对败血症的描述和定义并不一致,本研究仅能通过无菌腔液培养是否阳性进行败血症分类的方式,尽可能降低因败血症诊断差异所带来的异质性。通过无菌腔液培养是否阳性进行败血症分类符合目前大部分新生儿败血症诊断标准的分类方式。但是仍然需要尽快统一新生儿败血症的诊断标准,这样才能更好地评估益生菌在预防极低出生体重儿LOS的有效性,为临床工作提供更有说服力的循证医学支持。
综上所述,当前证据表明,益生菌可降低极低出生体重儿临床LOS和临床/确定LOS的发生风险,以及纯母乳喂养的极低出生体重儿确定LOS的发生风险,但仍需要更多的RCT及统一的新生儿败血症诊断标准进一步确定益生菌对预防极低出生体重儿LOS的有效性。
| [1] |
Stoll BJ, Hansen N, Fanaroff AA, et al. Late-onset sepsis in very low birth weight neonates: the experience of the NICHD Neonatal Research Network[J]. Pediatrics, 2002, 110(2 Pt 1): 285-291. DOI:10.1542/peds.110.2.285 PMID: 12165580. (  0) 0) |
| [2] |
Makhoul IR, Sujov P, Smolkin T, et al. Epidemiological, clinical, and microbiological characteristics of late-onset sepsis among very low birth weight infants in Israel: a national survey[J]. Pediatrics, 2002, 109(1): 34-39. DOI:10.1542/peds.109.1.34 PMID: 11773539. (  0) 0) |
| [3] |
Strunk T, Doherty D, Jacques A, et al. Histologic chorioamnionitis is associated with reduced risk of late-onset sepsis in preterm infants[J]. Pediatrics, 2012, 129(1): e134-e141. DOI:10.1542/peds.2010-3493 PMID: 22157134. (  0) 0) |
| [4] |
Tsai MH, Hsu JF, Chu SM, et al. Incidence, clinical characteristics and risk factors for adverse outcome in neonates with late-onset sepsis[J]. Pediatr Infect Dis J, 2014, 33(1): e7-e13. DOI:10.1097/INF.0b013e3182a72ee0 PMID: 23899966. (  0) 0) |
| [5] |
Hornik CP, Fort P, Clark RH, et al. Early and late onset sepsis in very-low-birth-weight infants from a large group of neonatal intensive care units[J]. Early Hum Dev, 2012, 88(Suppl 2): S69-S74. DOI:10.1016/S0378-3782(12)70019-1 PMID: 22633519. (  0) 0) |
| [6] |
Payne NR, Carpenter JH, Badger GJ, et al. Marginal increase in cost and excess length of stay associated with nosocomial bloodstream infections in surviving very low birth weight infants[J]. Pediatrics, 2004, 114(2): 348-355. DOI:10.1542/peds.114.2.348 PMID: 15286215. (  0) 0) |
| [7] |
甘馨, 李娟. 益生菌在早产儿的应用进展[J]. 中国当代儿科杂志, 2016, 18(9): 909-914. DOI:10.7499/j.issn.1008-8830.2016.09.023 PMID: 27655553. (  0) 0) |
| [8] |
Aceti A, Maggio L, Beghetti I, et al. Probiotics prevent late-onset sepsis in human milk-fed, very low birth weight preterm infants: systematic review and meta-analysis[J]. Nutrients, 2017, 9(8): 904. DOI:10.3390/nu9080904 PMID: 28829405. (  0) 0) |
| [9] |
Zhang GQ, Hu HJ, Liu CY, et al. Probiotics for preventing late-onset sepsis in preterm neonates: a PRISMA-compliant systematic review and meta-analysis of randomized controlled trials[J]. Medicine (Baltimore), 2016, 95(8): e2581. DOI:10.1097/MD.0000000000002581 PMID: 26937897. (  0) 0) |
| [10] |
Sun J, Marwah G, Westgarth M, et al. Effects of probiotics on necrotizing enterocolitis, sepsis, intraventricular hemorrhage, mortality, length of hospital stay, and weight gain in very preterm infants: a meta-analysis[J]. Adv Nutr, 2017, 8(5): 749-763. DOI:10.3945/an.116.014605 PMID: 28916575. (  0) 0) |
| [11] |
Rao SC, Athalye-Jape GK, Deshpande GC, et al. Probiotic supplementation and late-onset sepsis in preterm infants: a meta-analysis[J]. Pediatrics, 2016, 137(3): e20153684. DOI:10.1542/peds.2015-3684 PMID: 26908700. (  0) 0) |
| [12] |
郭明, 唐晓宇, 叶远, 等. 益生菌预防早产儿坏死性小肠结肠炎的系统评价和Meta分析[J]. 中国循证儿科杂志, 2016, 11(6): 401-409. DOI:10.3969/j.issn.1673-5501.2016.06.001 (  0) 0) |
| [13] |
Braga TD, da Silva GA, de Lira PI, et al. Efficacy of Bifidobacterium breve and Lactobacillus casei oral supplementation on necrotizing enterocolitis in very-low-birth-weight preterm infants: a double-blind, randomized, controlled trial[J]. Am J Clin Nutr, 2011, 93(1): 81-86. DOI:10.3945/ajcn.2010.29799 PMID: 20980486. (  0) 0) |
| [14] |
Saengtawesin V, Tangpolkaiwalsak R, Kanjanapattankul W. Effect of oral probiotics supplementationin the prevention of necrotizing enterocolitis among very low birth weight preterm infants[J]. J Med Assoc Thai, 2014, 97(Suppl 6): S20-S25. PMID: 25391168. (  0) 0) |
| [15] |
Kanic Z, Micetic Turk D, Burja S, et al. Influence of a combination of probiotics on bacterial infections in very low birthweight newborns[J]. Wien Klin Wochenschr, 2015, 127(Suppl 5): S210-S215. DOI:10.1007/s00508-015-0845-0 (  0) 0) |
| [16] |
史源. 新生儿败血症诊断及治疗专家共识(2019版)解读[J]. 中华实用儿科临床杂志, 2020, 35(11): 801-804. DOI:10.3760/cma.j.cn101070-20200224-00231 (  0) 0) |
| [17] |
Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary?[J]. Control Clin Trials, 1996, 17(1): 1-12. DOI:10.1016/0197-2456(95)00134-4 PMID: 8721797. (  0) 0) |
| [18] |
Kitajima H, Sumida Y, Tanaka R, et al. Early administration of Bifidobacterium breve to preterm infants: randomised controlled trial[J]. Arch Dis Child Fetal Neonatal Ed, 1997, 76(2): F101-F107. DOI:10.1136/fn.76.2.f101 PMID: 9135288. (  0) 0) |
| [19] |
Bin-Nun A, Bromiker R, Wilschanski M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates[J]. J Pediatr, 2005, 147(2): 192-196. DOI:10.1016/j.jpeds.2005.03.054 PMID: 16126048. (  0) 0) |
| [20] |
Lin HC, Su BH, Chen AC, et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants[J]. Pediatrics, 2005, 115(1): 1-4. DOI:10.1542/peds.2004-1463 PMID: 15629973. (  0) 0) |
| [21] |
Manzoni P, Mostert M, Leonessa ML, et al. Oral supplementation with Lactobacillus casei subspecies rhamnosus prevents enteric colonization by Candida species in preterm neonates: a randomized study[J]. Clin Infect Dis, 2006, 42(12): 1735-1742. DOI:10.1086/504324 PMID: 16705580. (  0) 0) |
| [22] |
Lin HC, Hsu CH, Chen HL, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight preterm infants: a multicenter, randomized, controlled trial[J]. Pediatrics, 2008, 122(4): 693-700. DOI:10.1542/peds.2007-3007 PMID: 18829790. (  0) 0) |
| [23] |
Rougé C, Piloquet H, Butel MJ, et al. Oral supplementation with probiotics in very-low-birth-weight preterm infants: a randomized, double-blind, placebo-controlled trial[J]. Am J Clin Nutr, 2009, 89(6): 1828-1835. DOI:10.3945/ajcn.2008.26919 PMID: 19369375. (  0) 0) |
| [24] |
Samanta M, Sarkar M, Ghosh P, et al. Prophylactic probiotics for prevention of necrotizing enterocolitis in very low birth weight newborns[J]. J Trop Pediatr, 2009, 55(2): 128-131. DOI:10.1093/tropej/fmn091 PMID: 18842610. (  0) 0) |
| [25] |
Hikaru H, Koichi K, Yayoi Y, et al. Bifidobacteria prevents preterm infants from developing infection and sepsis[J]. Int J Probiotics Prebiotics, 2010, 5: 33-36. (  0) 0) |
| [26] |
Mihatsch WA, Vossbeck S, Eikmanns B, et al. Effect of bifidobacterium lactis on the incidence of nosocomial infections in very-low-birth-weight infants: a randomized controlled trial[J]. Neonatology, 2010, 98(2): 156-163. DOI:10.1159/000280291 PMID: 20234140. (  0) 0) |
| [27] |
Sari FN, Dizdar EA, Oguz S, et al. Oral probiotics: Lactobacillus sporogenes for prevention of necrotizing enterocolitis in very low-birth weight infants: a randomized, controlled trial[J]. Eur J Clin Nutr, 2011, 65(4): 434-439. DOI:10.1038/ejcn.2010.278 PMID: 21245887. (  0) 0) |
| [28] |
Al-Hosni M, Duenas M, Hawk M, et al. Probiotics-supplemented feeding in extremely low-birth-weight infants[J]. J Perinatol, 2012, 32(4): 253-259. DOI:10.1038/jp.2011.51 PMID: 21546942. (  0) 0) |
| [29] |
Rojas MA, Lozano JM, Rojas MX, et al. Prophylactic probiotics to prevent death and nosocomial infection in preterm infants[J]. Pediatrics, 2012, 130(5): e1113-e1120. DOI:10.1542/peds.2011-3584 PMID: 23071204. (  0) 0) |
| [30] |
颜慧恒. 益生菌对早产极低出生体重儿系统水平细胞因子的影响及临床意义[D]. 广州: 广州医学院, 2012.
(  0) 0) |
| [31] |
Demirel G, Erdeve O, Celik IH, et al. Saccharomyces boulardii for prevention of necrotizing enterocolitis in preterm infants: a randomized, controlled study[J]. Acta Paediatr, 2013, 102(12): e560-e565. DOI:10.1111/apa.12416 PMID: 24028629. (  0) 0) |
| [32] |
Fernández-Carrocera LA, Solis-Herrera A, Cabanillas-Ayón M, et al. Double-blind, randomised clinical assay to evaluate the efficacy of probiotics in preterm newborns weighing less than 1500 g in the prevention of necrotising enterocolitis[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(1): F5-F9. DOI:10.1136/archdischild-2011-300435 PMID: 22556209. (  0) 0) |
| [33] |
Jacobs SE, Tobin JM, Opie GF, et al. Probiotic effects on late-onset sepsis in very preterm infants: a randomized controlled trial[J]. Pediatrics, 2013, 132(6): 1055-1062. DOI:10.1542/peds.2013-1339 PMID: 24249817. (  0) 0) |
| [34] |
Serce O, Benzer D, Gursoy T, et al. Efficacy of Saccharomyces boulardii on necrotizing enterocolitis or sepsis in very low birth weight infants: a randomised controlled trial[J]. Early Hum Dev, 2013, 89(12): 1033-1036. DOI:10.1016/j.earlhumdev.2013.08.013 PMID: 24041815. (  0) 0) |
| [35] |
李莹莹, 黄启凌, 朱峰, 等. 口服益生菌预防极低出生体质量儿坏死性小肠结肠炎的临床观察[J]. 安徽医学, 2014, 35(9): 1210-1212. DOI:10.3969/j.issn.1000-0399.2014.09.012 (  0) 0) |
| [36] |
Oncel MY, Sari FN, Arayici S, et al. Lactobacillus Reuteri for the prevention of necrotising enterocolitis in very low birthweight infants: a randomised controlled trial[J]. Arch Dis Child Fetal Neonatal Ed, 2014, 99(2): F110-F115. DOI:10.1136/archdischild-2013-304745 PMID: 24309022. (  0) 0) |
| [37] |
Patole S, Keil AD, Chang A, et al. Effect of Bifidobacterium breve M-16V supplementation on fecal bifidobacteria in preterm neonates: a randomised double blind placebo controlled trial[J]. PLoS One, 2014, 9(3): e89511. DOI:10.1371/journal.pone.0089511 PMID: 24594833. (  0) 0) |
| [38] |
Roy A, Chaudhuri J, Sarkar D, et al. Role of enteric supplementation of probiotics on late-onset sepsis by candida species in preterm low birth weight neonates: a randomized, double blind, placebo-controlled trial[J]. N Am J Med Sci, 2014, 6(1): 50-57. DOI:10.4103/1947-2714.125870 PMID: 24678479. (  0) 0) |
| [39] |
Totsu S, Yamasaki C, Terahara M, et al. Bifidobacterium and enteral feeding in preterm infants: cluster-randomized trial[J]. Pediatr Int, 2014, 56(5): 714-719. DOI:10.1111/ped.12330 PMID: 24617812. (  0) 0) |
| [40] |
Van Niekerk E, Kirsten GF, Nel DG, et al. Probiotics, feeding tolerance, and growth: a comparison between HIV-exposed and unexposed very low birth weight infants[J]. Nutrition, 2014, 30(6): 645-653. DOI:10.1016/j.nut.2013.10.024 PMID: 24613436. (  0) 0) |
| [41] |
Dilli D, Aydin B, Fettah ND, et al. The propre-save study: effects of probiotics and prebiotics alone or combined on necrotizing enterocolitis in very low birth weight infants[J]. J Pediatr, 2015, 166(3): 545-551.e1. DOI:10.1016/j.jpeds.2014.12.004 PMID: 25596096. (  0) 0) |
| [42] |
Tewari VV, Dubey SK, Gupta G. Bacillus clausii for prevention of late-onset sepsis in preterm infants: a randomized controlled trial[J]. J Trop Pediatr, 2015, 61(5): 377-385. DOI:10.1093/tropej/fmv050 PMID: 26246087. (  0) 0) |
| [43] |
Costeloe K, Hardy P, Juszczak E, et al. Bifidobacterium breve BBG-001 in very preterm infants: a randomised controlled phase 3 trial[J]. Lancet, 2016, 387(10019): 649-660. DOI:10.1016/S0140-6736(15)01027-2 PMID: 26628328. (  0) 0) |
| [44] |
Hays S, Jacquot A, Gauthier H, et al. Probiotics and growth in preterm infants: a randomized controlled trial, PREMAPRO study[J]. Clin Nutr, 2016, 35(4): 802-811. DOI:10.1016/j.clnu.2015.06.006 PMID: 26220763. (  0) 0) |
| [45] |
Güney-Varal İ, Köksal N, Özkan H, et al. The effect of early administration of combined multi-strain and multi-species probiotics on gastrointestinal morbidities and mortality in preterm infants: a randomized controlled trial in a tertiary care unit[J]. Turk J Pediatr, 2017, 59(1): 13-19. DOI:10.24953/turkjped.2017.01.003 PMID: 29168358. (  0) 0) |
| [46] |
Dehghan K, Karimi S, Alilu L. The effect of probiotics on late-onset sepsis in very preterm infants: a randomized clinical trial[J]. Int J Pediatr, 2018, 6(10): 8371-8379. DOI:10.22038/ijp.2018.31304.2768 (  0) 0) |
| [47] |
Wejryd E, Marchini G, Frimmel V, et al. Probiotics promoted head growth in extremely low birthweight infants in a double-blind placebo-controlled trial[J]. Acta Paediatr, 2019, 108(1): 62-69. DOI:10.1111/apa.14497 PMID: 29999201. (  0) 0) |
| [48] |
Miller J, Tonkin E, Damarell RA, et al. A systematic review and meta-analysis of human milk feeding and morbidity in very low birth weight infants[J]. Nutrients, 2018, 10(6): 707. DOI:10.3390/nu10060707 PMID: 29857555. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23

