2. 湖南师范大学第一附属医院/湖南省人民医院肿瘤科, 湖南长沙 410005
儿童神经母细胞瘤(neuroblastoma,NB)占儿童恶性肿瘤的6%~10%,是目前婴幼儿时期最常见的恶性颅外实体肿瘤,其导致的病死率占儿童恶性肿瘤的15% [1]。NB的特点表现为起病隐匿、恶性度高、病情进展迅速、早期即容易发生远处转移。大部分患儿确诊时已属于晚期,远期预后差。即使在某些发达国家,晚期患儿的长期生存率不超过50%。近年来,多学科联合治疗(multi-disciplinary team,MDT)在儿童实体肿瘤治疗中被广泛推广。其中放射治疗(简称放疗)是目前我国提高高危NB生存率的突破口之一。高危组巩固治疗阶段,手术、术后化疗或自体干细胞移植后使用放疗已被证实可以降低局部复发率[2]。近些年,放疗技术突飞猛进,调强适形放疗(intensity-modulated radiotherapy,IMRT)、三维适形放疗、影像指引放疗等精准放疗技术逐渐应用于临床[3]。精准放疗要求精确的定位、计划设计、剂量计算、精准执行,它包括三维图像处理技术、高精度的剂量计算算法、尖端的直线加速器系列技术等[4]。该技术不但具有高精准性,能有效保护周围组织器官,同时还能提高局控率从而提高生存率。国内外已有大量数据证实了IMRT的可靠性[5]。并且IMRT在肾脏保护方面的剂量优势[6],使得其更加适用于以腹膜后原发为主的儿童NB。
本研究分析湖南省人民医院儿童血液肿瘤科从2018年4月至2020年12月收治确诊并完成IMRT的高危组NB患儿。对其临床资料,包括实验室检查结果、放疗剂量、镇静方式及固定方法等进行回顾性分析。对NB放疗的临床经验进行总结,对精准放疗的安全性、有效性进行评估,为进一步优化NB的诊治,提高NB患儿的生存率提供参考依据。
1 资料与方法 1.1 研究对象回顾性选取2018年4月至2020年12月湖南省人民医院儿童血液肿瘤科诊断为NB的高危患儿24例为研究对象,所有患儿年龄均小于14岁,均接受IMRT治疗。NB的诊断标准参照《儿童神经母细胞瘤诊疗专家共识》[7],危险度分层参照美国儿童肿瘤协作组危险度分组系统[8]。
1.2 资料收集收集24例接受IMRT治疗的NB高危患儿的临床资料。其中包括年龄、性别、实验室检查结果、放疗辐射范围、放疗次数、放疗单次剂量,以及治疗期间出现的不良反应及疾病转归等。本研究已征得家属同意并获得湖南省人民医院医学伦理委员会批准[(2018)科研伦审第(71)号]。
1.3 放射治疗(1)放疗部位:所有患儿均进行了原发瘤灶放疗。部分患儿同时进行了残留区或转移瘤灶区放疗。
(2)放疗时间:①自体造血干细胞移植术后第28~42天进行放疗。②未进行干细胞移植的患儿于化疗结束后第21~28天进行放疗。
(3)放疗范围:根据电子计算机断层扫描、核磁共振成像、正电子发射计算机断层显像进行靶区勾画,本中心以原发腹腔NB为主,均为术后行放射治疗,为保护正常组织,残留病灶计划靶区=临床靶区[肿瘤靶区(手术后残留病灶)+1~2 cm]+5 mm;原发病灶计划靶区=临床靶区[肿瘤靶区(诱导化疗后,手术前的肿瘤区域)+1~2 cm]+5 mm。
(4)放疗剂量:如患儿肿瘤完全切除,则放疗剂量为21.6 Gy/12次;若术后有残留,手术残留区需另加量14.4 Gy/8次。
(5)放疗不良反应评价:根据美国国立癌症研究所常见不良反应事件评价标准(CTCAE 5.0版)[9],对不良事件强度进行分级。其中主要包括骨髓抑制、胃肠道反应、重要器官的急慢性放射损伤等。
(6)放疗镇静及心理支持:大年龄患儿通过沟通及心理支持完成放疗。对于低龄及部分无法配合放疗的患儿,首先规律放疗时间,其次需剥夺睡眠,口服10%水合氯醛(0.3~0.5 mL/kg)、右美托咪定滴鼻(2 μg/kg)或静脉使用咪达唑仑(0.1~0.3 mg/kg)镇静完成治疗。
1.4 随访随访截至2020年12月28日或发生终点事件(死亡),多数患儿长期门诊随访,少数患儿进行电话随访。随访内容为:患儿生存情况、不良反应及实验室检查结果。
1.5 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,计数资料以例数或百分率(%)表示,Kaplan-Meier法进行生存分析。
2 结果 2.1 一般资料24例接受放疗的高危NB患儿放疗类型均为IMRT,其中男14例,女10例;年龄39~114个月,平均年龄(65±23)个月,中位年龄59个月。原发瘤灶23例位于腹部,1例位于纵隔;初诊时存在远处淋巴结转移20例,骨转移2例(颅骨1例,股骨1例),肝脏转移1例,骨髓转移1例,肺部转移1例。放疗时患儿中位年龄41.5个月,6例(25%)患儿进行了残留灶或转移灶放疗。
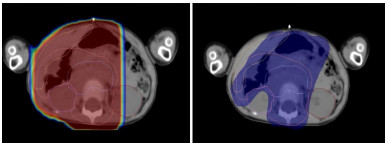
2.2 放疗靶区IMRT通过计算机优化采用多野等中心及逆向设计治疗计划,先将照射野变成多个子野,然后依靠多叶光栅等手段调节每个子野,使得靶区适形性更高,是3D适形放疗的下一步发展。逆向计划过程,首先确定靶区和周围需要保护的器官的形状、位置,需要给予的照射和限制剂量大小,确定所需要形成的三维剂量分布,从而确定合适的照射方式和计划。图 1为某患儿放疗计划靶区图,显示IMRT与传统放疗计划的轴向比较。右图为IMRT计划,相较于左图传统放疗计划,其在计划靶区周围具有较高的保形性,减少肾脏的照射,有效地保护了脏器。
|
图 1 IMRT与传统放疗计划比较 患儿女,3岁。左图红色区域为常规放疗计划靶区;右图蓝色区域为IMRT计划靶区,右侧肾脏及周围正常组织得以保护。 |
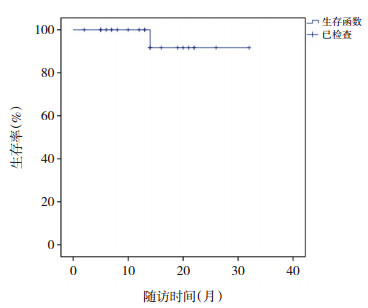
24例接受IMRT的高危NB患儿,原发部位放疗辐射剂量范围为14.4~36.0 Gy,平均剂量为(22±3)Gy,每日剂量为1.8~2.0 Gy;总次数8~20次,平均次数11.9次;随访中位时间为13.5个月。至随访结束时,23例(96%)疾病稳定,1例死亡。分析死亡原因:患儿为Ⅳ期高危儿,NB原发部位为腹膜后肾上腺,且伴右侧股骨为主的多发骨转移;联合化疗及手术后对原发部位行IMRT治疗,放疗结束随访14个月后出现骨转移灶复发,其原发部位未见肿瘤组织,家属放弃治疗后死亡。另18例患儿无事件生存,5例带瘤生存,局部控制率为78%,具体生存曲线见图 2。
|
图 2 24例NB高危患儿生存曲线图 |
24例高危NB患儿完成IMRT,放疗过程中3例出现咳嗽,2例出现腹泻,1例出现呕吐。放疗后2周,血肌酐范围值为2.3~70.1 μmol/L,平均值为(24±13)μmol/L,丙氨酸氨基转移酶范围值为9.1~65.3 U/L,平均值为(29±14)U/L,均基本正常。根据CTCAE 5.0版评估,放疗开始后1~2周出现骨髓抑制Ⅲ度10例,Ⅳ度2例;放疗开始后3~4周出现骨髓抑制Ⅲ度4例,Ⅳ度1例,具体详见表 1。至随访结束,所有患儿未出现肝脏、肾脏等脏器功能损害。
| 表 1 24例患儿放疗后骨髓抑制情况 [例(%)] |
|
|
NB发病率高,占儿童恶性肿瘤的8%~10%,仅次于急性淋巴细胞白血病及神经系统肿瘤。根据美国儿童肿瘤协作组统计,每年新发NB患儿超过650/1 000 000[10],且因其异质性导致临床症状与实际病情有明显差异,所以起病较隐匿,绝大多数患儿诊断时已远处转移,属于高危。NB病理类型主要为小圆细胞瘤,对放疗敏感,放疗能有效提高高危NB患儿的局部控制率[11]。我中心精准放疗类型主要为IMRT,根据本组24例接受IMRT患儿数据分析,至随访结束,23例(96%)疾病稳定,与既往研究报道的局部控制率84%~100%相符,从而验证IMRT对NB局部控制率的有效性[12]。
IMRT的短期不良反应包括恶心、呕吐、骨髓抑制、黏膜炎等。根据本中心研究表明,短期不良反应主要为骨髓抑制,一般在放疗开始后1~2周出现,放疗开始后3~4周逐渐恢复。通过血肌酐、丙氨酸氨基转移酶等实验室检查,暂未发现有重要脏器功能损害,从而证实IMRT短期安全性是可靠的。根据Sidell等[13]学者建议,考虑到本中心随访中位时间为13.5个月,时间较短,因此无法从我们的数据中得出IMRT是否增加二次恶性肿瘤的风险,所以在儿童患者中运用IMRT治疗时,必须谨慎考虑这一点。特别是对于扩展的放射治疗领域,例如颅内或覆盖区域,其中将包含大量正常组织。同时后续我们还需关注患儿骨骼生长、内分泌系统等。应用Kaplan-Meier法计算24例行IMRT患儿的生存率,证实IMRT能有效提高生存率,近期疗效显著。对于部分头部转移的NB患儿施行放疗,使用螺旋断层放疗技术模式(Tomo therapy,TOMO)能更好地保护儿童脑部组织。TOMO是目前最先进的放疗技术,它拥有肿瘤适形性更高,肿瘤剂量强度调节更加精确,肿瘤周围正常组织剂量调节更细等特点,能更有效地保护儿童生长发育。但目前国内有TOMO儿童放疗条件的医院非常稀少,治疗费用也十分高昂,无法大规模推广应用。
目前NB患儿无法完成放疗的主要原因是低龄儿童依从性低,所以放疗前镇静是儿童放疗成功的关键。有效、简易的镇静方式,可以减少患儿的恐惧和痛苦,有助于放疗的顺利完成。本中心从2018年开始探索放疗镇静的有效方法。目前主要通过儿童睡眠剥夺及包括水合氯醛、右美托咪定及咪达唑仑等镇静药物单独或联合使用,可以达到满意的镇静效果,且近远期无不良反应。其中水合氯醛、咪达唑仑广泛应用于临床,而右美托咪定是一种高选择性α2肾上腺素能受体激动剂,具有给药方式简单,对肾、脑等重要器官不良反应轻微,且不抑制呼吸等优势[14]。目前我中心共完成放疗镇静280例次,主要通过儿童睡眠剥夺及多种途径使用1种或多种镇静药物顺利完成放疗。除药物镇静方法,儿童放疗全程的心理支持也十分重要。首先是放疗需要单独进行,放疗前了解和熟悉放疗环境能让患儿放松心情,降低恐惧;其次通过言语鼓励,创造臆想空间,奖励机制等方法可进一步增加非镇静下患儿的放疗成功率,最后是放疗后对镇静苏醒及非镇静患儿的心理支持[15]。结合头颈肩面罩和热塑体模的固定技术,可使患儿高效、安全地完成连续放疗。
近年来,NB通过手术切除、联合化疗、放疗、免疫治疗等综合治疗的方式,生存率较前有了很大的提高,但总体生存率仍低于欧美国家的70%~78%[16]。所以精准放疗是提高我国NB生存率的发展方向。最新研究也表明,将靶向治疗药物(包括小分子、放射线核素和免疫治疗)整合到现代治疗方案中是NB未来治疗发展的方向,同时也有助于发现预测性的生物标志物。通过密切监测生物标志物,有望在未来为特定人群带来更有效、不良反应更小的治疗[17]。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Schulte JH, Schulte S, Heukamp LC, et al. Targeted therapy for neuroblastoma: ALK inhibitors[J]. Klin Padiatr, 2013, 225(6): 303-308. DOI:10.1055/s-0033-1357132 PMID: 24166094. (  0) 0) |
| [2] |
申文江, 申戈. 儿童神经母细胞瘤的放射治疗[J]. 中国小儿血液与肿瘤杂志, 2014, 19(2): 57-60. DOI:10.3969/j.issn.1673-5323.2014.02.001 (  0) 0) |
| [3] |
查元梓, 吴晔明, 陆冬青, 等. 儿童神经母细胞瘤三维适形放射治疗与调强放射治疗剂量学比较[J]. 中国医学物理学杂志, 2016, 33(2): 181-184. DOI:10.3969/j.issn.1005-202X.2016.02.015 (  0) 0) |
| [4] |
张晓智, 杨蕴一, 孙宇晨, 等. 精准放疗的现状与进展[J]. 西安交通大学学报(医学版), 2020, 41(5): 633-638. DOI:10.7652/jdyxb202005001 (  0) 0) |
| [5] |
Yang R, Xu S, Jiang W, et al. Integral dose in three-dimensional conformal radiotherapy, intensity-modulated radiotherapy and helical tomotherapy[J]. Clin Oncol (R Coll Radiol), 2009, 21(9): 706-712. DOI:10.1016/j.clon.2009.08.002 PMID: 19713087. (  0) 0) |
| [6] |
Nazmy MS, Khafaga Y. Clinical experience in pediatric neuroblastoma intensity modulated radiotherapy[J]. J Egypt Natl Canc Inst, 2012, 24(4): 185-189. DOI:10.1016/j.jnci.2012.10.001 PMID: 23159289. (  0) 0) |
| [7] |
中国抗癌协会小儿肿瘤专业委员会, 中华医学会小儿外科学分会肿瘤外科学组. 儿童神经母细胞瘤诊疗专家共识[J]. 中华小儿外科杂志, 2015, 36(1): 3-7. DOI:10.3760/cma.j.issn.0253-3006.2015.01.002 (  0) 0) |
| [8] |
Cohn SL, Pearson AD, London WB, et al. The International Neuroblastoma Risk Group (INRG) classification system: an INRG task force report[J]. J Clin Oncol, 2009, 27(2): 289-297. DOI:10.1200/JCO.2008.16.6785 PMID: 19047291. (  0) 0) |
| [9] |
Basch E, Becker C, Rogak LJ, et al. Composite grading algorithm for the National Cancer Institute's Patient - Reported Outcomes version of the Common Terminology Criteria for Adverse Events (PRO-CTCAE)[J]. Clin Trials, 2021, 18(1): 104-114. DOI:10.1177/1740774520975120 PMID: 33258687. (  0) 0) |
| [10] |
Howlader N, Noone AM, Yu MD, et al. Use of imputed population-based cancer registry data as a method of accounting for missing information: application to estrogen receptor status for breast cancer[J]. Am J Epidemiol, 2012, 176(4): 347-356. DOI:10.1093/aje/kwr512 PMID: 22842721. (  0) 0) |
| [11] |
Gillis AM, Sutton E, Dewitt KD, et al. Long-term outcome and toxicities of intraoperative radiotherapy for high-risk neuroblastoma[J]. Int J Radiat Oncol Biol Phys, 2007, 69(3): 858-864. DOI:10.1016/j.ijrobp.2007.04.006 PMID: 17517478. (  0) 0) |
| [12] |
Dubois SG, Chesler L, Groshen S, et al. Phase I study of vincristine, irinotecan, and 131I-metaiodobenzylguanidine for patients with relapsed or refractory neuroblastoma: a new approaches to neuroblastoma therapy trial[J]. Clin Cancer Res, 2012, 18(9): 2679-2686. DOI:10.1158/1078-0432.CCR-11-3201 PMID: 22421195. (  0) 0) |
| [13] |
Sidell N. Retinoic acid-induced growth inhibition and morphologic differentiation of human neuroblastoma cells in vitro[J]. J Natl Cancer Inst, 1982, 68(4): 589-596. DOI:10.1093/jnci/68.4.589 PMID: 7040765. (  0) 0) |
| [14] |
Thiele CJ, Reynolds CP, Israel MA. Decreased expression of N-myc precedes retinoic acid-induced morphological differentiation of human neuroblastoma[J]. Nature, 1985, 313(6001): 404-406. DOI:10.1038/313404a0 PMID: 3855502. (  0) 0) |
| [15] |
Matthay KK, Villablanca JG, Seeger RC, et al. Treatment of high-risk neuroblastoma with intensive chemotherapy, radiotherapy, autologous bone marrow transplantation, and 13-cis-retinoicacid[J]. N Engl J Med, 1999, 341(16): 1165-1173. DOI:10.1056/NEJM199910143411601 PMID: 10519894. (  0) 0) |
| [16] |
Sait S, Modak S. Anti-GD2 immunotherapy for neuroblastoma[J]. Expert Rev Anticancer Ther, 2017, 17(10): 889-904. DOI:10.1080/14737140.2017.1364995 PMID: 28780888. (  0) 0) |
| [17] |
Mody R, Naranjo A, Van RC, et al. Irinotecan-temozolomide with temsirolimus or dinutuximab in children with refractory or relapsed neuroblastoma (COG ANBL1221): an open-label, randomised, phase 2 trial[J]. Lancet Oncol, 2017, 18(7): 946-957. DOI:10.1016/S1470-2045(17)30355-8 PMID: 28549783. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


