2. 中南大学湘雅二医院儿童医学中心, 湖南长沙 410013
应用合成类糖皮质激素(synthetic glucocorticoids,sGCs)促进胎儿肺成熟,降低早产儿发生新生儿呼吸窘迫综合征风险和严重程度,已有近40年历史[1-2]。近年来,应用sGCs治疗早产儿支气管肺发育不良也逐渐被广泛接受[3-4],这有效地提高了早产儿的生存率,并逐渐成为治疗新生儿呼吸系统疾病的重要手段之一。但围生期应用sGCs对发育中的脑长期潜在的不良影响被持续关注[5]。研究发现,妊娠期接受糖皮质激素治疗的儿童,其发生远期神经系统不良影响的概率明显增高。本研究团队前期所做的一项Meta分析同样表明早产儿生后应用地塞米松治疗后,在学龄前期智商值显著降低[6]。相关动物实验研究表明,胎儿期应用地塞米松(dexamethasone,DEX)干预能引起雄性子代成年期认知损害[7],也可能跟成年期焦虑行为相关[8]。因此,深入了解sGCs对发育中脑的影响机制对临床合理应用sGCs有重要意义。
脑发育是由神经元细胞增殖、迁移和分化组成的高度程序化过程,而神经元迁移是以Lissencephaly 1(LIS1)蛋白为核心的一个信号通路调控过程[9]。LIS1与多种微管运动蛋白形成复合物,将细胞骨架蛋白与放射性胶质细胞的细胞外基质相连接,控制神经元精确转位移行[10]。因为神经元细胞存在细长的突起,故相比于其他细胞更加依赖于一个微管运动系统去执行正常细胞功能。神经元胞浆Dynein和Dynactin作为LIS1蛋白信号通路中的关键微管运动蛋白,直接参与到神经元迁移、逆向轴突运输、神经营养因子信号传导等过程[11-13]。本课题组前期研究已发现皮质醇干扰体外培养胎鼠大脑皮质神经元LIS1表达[14]。如果Dynein和Dynactin蛋白存在缺陷或突变,可能会导致神经元细胞功能异常。sGCs是否也直接作用于Dynein和Dynactin蛋白,影响神经元迁移,从而干扰正常的脑发育和脑功能。本研究通过应用DEX干预体外培养胎鼠大脑皮质神经元,研究胞浆Dynein重链(Dynein heavy chain,DHC)和Dynactin的表达变化,进一步阐明sGCs对发育中脑损害的机制。
1 材料与方法 1.1 原代胎鼠大脑皮质神经元的制备及实验分组取妊娠16~17 d的Sprague-Dawley大鼠(购自湖南斯莱克景达实验动物有限公司),无菌条件下分离胎鼠大脑皮质,解剖显微镜下去除脑膜。胰蛋白酶消化后的组织置于含10%胎牛血清(杭州天杭生物科技股份有限公司)的DMEM培养液中,制备细胞悬液,以5×105/mL细胞悬液接种至铺有多聚赖氨酸的培养瓶中,置于37℃、5%CO2培养箱中。体外培养24~48 h后用含10%胎牛血清的DMEM培养液全量换液,5 d时使用含1×10-5 mol/L阿糖胞苷的培养液培养24 h后,以含10%胎牛血清的DMEM培养液全量换液,每3~4 d半量换液1次,体外培养7~9 d加入DEX。依据前期预实验结果和DEX终浓度分为对照组(未施加DEX)、0.1 μmol/L组与1.0 μmol/L组,分别于DEX干预后1 d、3 d和7 d收集细胞。
1.2 实时荧光定量PCR检测DHC和Dynactin mRNA表达收集各组细胞,用RNA提取试剂盒(Thermo Scientific,美国)提取总RNA,使用Nanodrop 2000超微量分光光度计(Thermo,美国)测定总RNA浓度和纯度,OD260/OD280比值均在1.8~2.0之间。按照EvoM-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司)说明书进行反转录,cDNA于-20℃保存备用。
实时荧光定量PCR操作按照TB GreenⓇ Premix Ex TaqTMⅡ试剂盒(TakaRa,日本)说明书进行,反应体系的组成为TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)10 μL、PCR上下游引物各0.8 μL、ROX参比染料0.4 μL、cDNA模板2 μL和灭菌用水6 μL,引物序列见表 1。应用ABI 7500型实时荧光定量PCR仪(PE Applied Bio,美国)进行PCR扩增,循环参数为95℃预变性30 s;95℃变性3 s,60℃退火30 s,循环40次。每次反应时标准品、待测样本及阴性对照均做双管同时进行,作溶解曲线以检测非特异扩增。内参基因和目的基因的mRNA在每次PCR扩增后均做标准曲线,mRNA相对表达量以2-△△Ct表示,△Ct(n)=Ct目的基因(n)-Ct内参基因(n),△△CT(n)=△Ct(n)-△Ct(1),n为循环数。每组收集4份RNA标本,每份RNA标本设3个平行管,检测后取平均值。整个实验独立重复3次。
| 表 1 引物序列 |
|
|
移除培养液,用预冷的PBS冲洗3次。加入200 μL细胞裂解液[10 mmol/L羟乙基哌嗪乙硫磺酸(pH 7.9)、1.5 mmol/L MgCl2、10 mmol/L KCl、0.5 mmol/L二硫苏糖醇、0.2 mmol/L苯甲基磺酰氟、0.06%细胞组织裂解液-40],冰上裂解20 min后,收集于离心管中。使用超声细胞破碎仪粉碎打匀细胞,冰上静置5 min后,4℃ 13 300 r/min离心10 min,取上清液。应用微量板全波段酶标仪采用紫外吸收法测定蛋白浓度。蛋白标本加入1/4体积的5×加样缓冲液[0.25 mol/L三羟甲基氨基甲烷(pH 6.8)、10%十二烷基磺酸钠、0.005%溴酚蓝、50%甘油、5% β-巯基乙醇],采用10%十二烷基磺酸钠-聚丙烯凝胶电泳分离,每条泳道按20 μg/20 μL上样,其中旁边两孔加入蛋白Marker标记。电泳结束后用半干法转蛋白至聚偏二氟乙烯膜,于5%脱脂奶中封闭1 h。分别加一抗溶液[兔抗大鼠DHC单克隆抗体(Abcam,英国)1∶1 000,兔抗大鼠Dynactin单克隆抗体(Abcam,英国)1∶2 000,内参照为兔抗大鼠β-actin多克隆抗体(Protein Tech,美国)1∶5 000] 4℃孵育过夜,用20%吐温-20配置的等渗缓冲盐溶液洗膜后,加入辣根过氧化物酶标记的相应二抗[山羊抗兔多克隆抗体(Protein Tech,美国)1∶1 000]室温孵育2 h,用20%吐温-20配置的等渗缓冲盐溶液充分洗膜后,将膜置于保鲜膜上,滤纸去除残液,加入适量的化学发光检测试剂,覆盖保鲜膜,采用数字凝胶成像分析系统进行扫描,使用Image J系统分析条带灰度值,将目的蛋白与β-actin蛋白灰度值的比值作为目的蛋白相对表达量。每组收集5份标本,每份标本设3个平行管,检测后取平均值。整个实验独立重复4次。
1.4 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法。P < 0.05为差异有统计学意义。
2 结果 2.1 DEX对体外培养胎鼠大脑皮质神经元DHC mRNA及其蛋白的表达影响对照组、0.1 μmol/L组、1.0 μmol/L组在DEX干预后1 d、3 d和7 d,体外培养神经元DHC mRNA表达水平差异无统计学意义(P > 0.05)。DEX干预后1 d、3 d和7 d,对照组、0.1 μmol/L组和1.0 μmol/L组间体外培养神经元DHC mRNA表达水平差异无统计学意义(P > 0.05)。见表 2。
| 表 2 DEX干预后体外培养胎鼠大脑皮质神经元DHC mRNA表达水平比较 (x±s,n=3) |
|
|
Western blot法结果显示,对照组、0.1 μmol/L组在DEX干预后1 d、3 d和7 d,体外培养神经元DHC蛋白表达水平差异无统计学意义(P > 0.05);1.0 μmol/L组在DEX干预后7 d神经元DHC的蛋白表达明显高于1 d、3 d(P < 0.05)。DEX干预后1 d和3 d,对照组、0.1 μmol/L组和1.0 μmol/L组间体外培养神经元DHC蛋白表达差异无统计学意义(P > 0.05)。DEX干预后7 d,对照组和0.1 μmol/L组间神经元DHC蛋白表达差异无统计学意义(P > 0.05);1.0 μmol/L组神经元DHC蛋白表达明显高于对照组和0.1 μmol/L组(P < 0.05)。见表 3,图 1。
| 表 3 DEX干预后体外培养胎鼠大脑皮质神经元DHC蛋白表达比较 (x±s,n=4) |
|
|

|
图 1 Western blot法检测DEX对胎鼠大脑皮质神经元DHC蛋白相对表达电泳图 1:对照组;2:0.1 μmol/L组;3:1.0 μmol/L组。 |
对照组、0.1 μmol/L组、1.0 μmol/L组在DEX干预后1 d、3 d和7 d,体外培养神经元Dynactin mRNA表达水平差异无统计学意义(P > 0.05)。DEX干预后1 d、3 d和7 d,对照组、0.1 μmol/L组和1.0 μmol/L组间体外培养神经元Dynactin mRNA表达水平差异无统计学意义(P > 0.05)。见表 4。
| 表 4 DEX干预后胎鼠大脑皮质神经元Dynactin mRNA表达比较 (x±s,n=3) |
|
|
Western blot法结果显示,DEX干预后,对照组、0.1 μmol/L组在3 d和7 d时体外培养神经元Dynactin蛋白表达均高于1 d时(P < 0.05);对照组7 d时神经元Dynactin蛋白表达高于3 d时(P < 0.05);0.1 μmol/L组7 d时神经元Dynactin蛋白表达低于3 d时(P < 0.05)。1.0 μmol/L组在DEX干预后1 d、3 d和7 d神经元Dynactin蛋白表达差异无统计学意义(P > 0.05)。DEX干预1 d时,体外培养大脑皮质神经元Dynactin蛋白表达在3组间差异无统计学意义(P > 0.05)。在3 d和7 d时,0.1 μmol/L组及1.0 μmol/L组大脑皮质神经元Dynactin蛋白表达均明显低于对照组(P < 0.05);且7 d时,1.0 μmol/L组大脑皮质神经元内Dynactin蛋白表达低于0.1 μmol/L组(P < 0.05)。见表 5,图 2。
| 表 5 DEX干预后体外培养胎鼠大脑皮质神经元Dynactin蛋白表达比较 (x±s,n=4) |
|
|
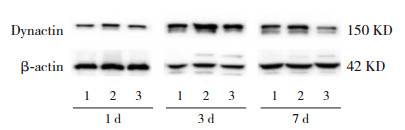
|
图 2 Western blot法检测DEX对胎鼠大脑皮质神经元Dynactin蛋白相对表达电泳图 1:对照组;2:0.1 μmol/L组;3:1.0 μmol/L组。 |
由于存在细长的突起,神经元要执行正常功能,较其他细胞更依赖于一个正常运作的微管转运系统,而微管运动蛋白及其辅助蛋白的异常与人类神经疾病密切相关[15-18]。胞浆动力蛋白Dynein复合体属于细胞内转运的一大类微管运动蛋白,Dynein是一种1.4 MDa复合体,具有向微管末端运输物质的功能。每个Dynein复合体包括两个亚单位,每个亚单位包括1个DHC、1个中间链、1个轻中间链和3个不同的轻链组成[19-21],其中DHC含有运动域,在神经元细胞迁移过程中,胞浆DHC与LIS1结合,形成Dynein-LIS1-核分布蛋白E类同源物1(nuclear distribution E homolog-like 1,Ndel1)复合物[22-23];Dynactin蛋白是Dynein蛋白的一个重要辅助运动蛋白[24-25],促进Dynein-LIS1-Ndel1在细胞骨架中移动,两种蛋白调节神经元细胞的转位迁移过程[26-29]。
本研究显示在1.0 μmol/L DEX干预7 d时,体外培养胎鼠大脑皮质神经元DHC蛋白表达增高,而在3 d及7 d时,0.1 μmol/L组及1.0 μmol/L组大脑皮质神经元内Dynactin蛋白表达均明显低于对照组。有研究报道DHC和Dynactin基因突变与大脑皮质发育异常、小头畸形等先天性神经系统疾病相关[15-18, 30-31],提示DHC和Dynactin表达异常将可能影响Dynein-LIS1-Ndel1复合物形成及Dynein-LIS1-Ndel1复合物在细胞骨架上的迁移过程,而这个过程与神经元细胞的移位和迁移密切相关,因此推测DEX可能干扰胞浆动力蛋白Dynein和Dynactin的表达,从而影响到发育期神经元的功能。
一般认为sGCs通过与靶细胞的相关受体相结合后,转入细胞核内,结合到激素反应单元,调节靶基因表达。sGCs对相关基因表达影响出现的时间报道各不相同。多篇文献报道新生鼠接受DEX后30 min海马区c-fos基因表达即发生改变[32-33];而罗森林等[14]报道应用皮质酮后,体外培养胎鼠大脑皮质神经元LIS1表达仅在干预后7 d时发生显著改变。本研究表明在应用DEX后1 d时,DHC及Dynactin蛋白表达变化不显著,在DEX干预3 d时,Dynactin蛋白表达开始出现下调,而干预7 d时,两种蛋白表达均表现出显著性差异,提示DEX对神经元迁移相关蛋白表达的影响非即刻发生,而且仅在高浓度DEX干预时,更易表现出对DHC和Dynactin蛋白表达水平的显著性影响。本研究探讨DEX对DHC和Dynactin蛋白表达的影响时,结果提示在DEX干预7 d后1.0 μmol/L组神经元DHC蛋白表达明显高于1 d、3 d时;对照组、0.1 μmol/L组、1.0 μmol/L组在DEX干预3 d、7 d时Dynactin蛋白表达差异有统计学意义。但本实验结果系4次独立重复实验结果平均值统计,考虑若比较同组不同时间蛋白表达量变化,则该结果可能存在一定程度系统误差,故不做讨论。DEX对DHC和Dynactin蛋白表达呈现浓度依赖性及时间依赖性。短期、小剂量应用DEX是否从对神经元迁移角度是安全的,需要进一步研究。
本研究发现DEX对体外培养胎鼠大脑皮质神经元DCH和Dynactin mRNA表达的影响,在所选定的浓度和时间点均无显著性差异,与蛋白表达的变化不匹配,这可能与DEX对两种蛋白表达的影响非在转录水平,而在mRNA翻译至蛋白的过程有关,体现出DEX对脑内蛋白表达调节的复杂性,但也可能与选择的研究时间点使结果产生偏倚有关。
总之,DEX影响体外培养胎鼠大脑皮质神经元DHC和Dynactin蛋白表达,这种影响与剂量的高低、作用时间的长短有关。
利益冲突声明:所有作者均声明不存在利益冲突。
| [1] |
Liggins GC, Howie RN. A controlled trial of antepartum glucocorticoid treatment for prevention of the respiratory distress syndrome in premature infants[J]. Pediatrics, 1972, 50(4): 515-525. PMID: 4561295. (  0) 0) |
| [2] |
Hallman M. The story of antenatal steroid therapy before preterm birth[J]. Neonatology, 2015, 107(4): 352-357. DOI:10.1159/000381130 PMID: 26044103. (  0) 0) |
| [3] |
Doyle LW, Cheong JL, Ehrenkranz RA, et al. Early (< 8 days) systemic postnatal corticosteroids for prevention of bronchopulmonary dysplasia in preterm infants[J]. Cochrane Database Syst Rev, 2017, 10(10): CD001146. DOI:10.1002/14651858.CD001146.pub5 PMID: 29063585. (  0) 0) |
| [4] |
Doyle LW, Cheong JL, Ehrenkranz RA, et al. Late (> 7 days) systemic postnatal corticosteroids for prevention of bronchopulmonary dysplasia in preterm infants[J]. Cochrane Database Syst Rev, 2017, 10(10): CD001145. DOI:10.1002/14651858.CD001145.pub4 PMID: 29063594. (  0) 0) |
| [5] |
Scott SM, Rose SR. Use of glucocorticoids for the fetus and preterm infant[J]. Clin Perinatol, 2018, 45(1): 93-102. DOI:10.1016/j.clp.2017.11.002 PMID: 29406009. (  0) 0) |
| [6] |
Zhang RL, Bo T, Shen L, et al. Effect of dexamethasone on intelligence and hearing in preterm infants: a meta-analysis[J]. Neural Regen Res, 2014, 9(6): 637-645. DOI:10.4103/1673-5374.130085 PMID: 25206867. (  0) 0) |
| [7] |
Nürnberg E, Horschitz S, Schloss P, et al. Basal glucocorticoid receptor activation induces proliferation and inhibits neuronal differentiation of human induced pluripotent stem cell-derived neuronal precursor cells[J]. J Steroid Biochem Mol Biol, 2018, 182: 119-126. DOI:10.1016/j.jsbmb.2018.04.017 PMID: 29751108. (  0) 0) |
| [8] |
Chen QF, Wang FF, Zhang YC, et al. Neonatal DEX exposure leads to hyperanxious and depressive-like behaviors as well as a persistent reduction of BDNF expression in developmental stages[J]. Biochem Biophys Res Commun, 2020, 527(1): 311-316. DOI:10.1016/j.bbrc.2020.04.084 PMID: 32446386. (  0) 0) |
| [9] |
Hippenmeyer S. Molecular pathways controlling the sequential steps of cortical projection neuron migration[J]. Adv Exp Med Biol, 2014, 800: 1-24. DOI:10.1007/978-94-007-7687-6_1 PMID: 24243097. (  0) 0) |
| [10] |
Dantas TJ, Carabalona A, Hu DJ, et al. Emerging roles for motor proteins in progenitor cell behavior and neuronal migration during brain development[J]. Cytoskeleton (Hoboken), 2016, 73(10): 566-576. DOI:10.1002/cm.21293 PMID: 26994401. (  0) 0) |
| [11] |
Shi L, Muthusamy N, Smith D, et al. Dynein binds and stimulates axonal motility of the endosome adaptor and NEEP21 family member, calcyon[J]. Int J Biochem Cell Biol, 2017, 90: 93-102. DOI:10.1016/j.biocel.2017.07.005 PMID: 28734834. (  0) 0) |
| [12] |
Bercier V, Hubbard JM, Fidelin K, et al. Dynactin1 depletion leads to neuromuscular synapse instability and functional abnormalities[J]. Mol Neurodegener, 2019, 14(1): 27. DOI:10.1186/s13024-019-0327-3 PMID: 31291987. (  0) 0) |
| [13] |
Carter AP, Diamant AG, Urnavicius L. How dynein and dynactin transport cargos: a structural perspective[J]. Curr Opin Struct Biol, 2016, 37: 62-70. DOI:10.1016/j.sbi.2015.12.003 PMID: 26773477. (  0) 0) |
| [14] |
罗森林, 薄涛, 刘通, 等. 皮质酮对体外培养发育中胎鼠脑皮层神经元迁移蛋白LIS1表达的影响[J]. 中国当代儿科杂志, 2017, 19(9): 1008-1013. DOI:10.7499/j.issn.1008-8830.2017.09.015 PMID: 28899473. (  0) 0) |
| [15] |
Chen YL, Xu YF, Li GQ, et al. Exome sequencing identifies de novo DYNC1H1 mutations associated with distal spinal muscular atrophy and malformations of cortical development[J]. J Child Neurol, 2017, 32(4): 379-386. DOI:10.1177/0883073816683083 PMID: 28193117. (  0) 0) |
| [16] |
Olenick MA, Dominguez R, Holzbaur ELF. Dynein activator Hook1 is required for trafficking of BDNF-signaling endosomes in neurons[J]. J Cell Biol, 2019, 218(1): 220-233. DOI:10.1083/jcb.201805016 PMID: 30373907. (  0) 0) |
| [17] |
Francis F, Cappello S. Neuronal migration and disorders - an update[J]. Curr Opin Neurobiol, 2021, 66: 57-68. DOI:10.1016/j.conb.2020.10.002 PMID: 33096394. (  0) 0) |
| [18] |
Scoto M, Rossor AM, Harms MB, et al. Novel mutations expand the clinical spectrum of DYNC1H1-associated spinal muscular atrophy[J]. Neurology, 2015, 84(7): 668-679. DOI:10.1212/WNL.0000000000001269 PMID: 25609763. (  0) 0) |
| [19] |
Tirumala NA, Ananthanarayanan V. Role of dynactin in the intracellular localization and activation of cytoplasmic dynein[J]. Biochemistry, 2020, 59(2): 156-162. DOI:10.1021/acs.biochem.9b00772 PMID: 31591892. (  0) 0) |
| [20] |
Htet ZM, Gillies JP, Baker RW, et al. LIS1 promotes the formation of activated cytoplasmic dynein-1 complexes[J]. Nat Cell Biol, 2020, 22(5): 518-525. DOI:10.1038/s41556-020-0506-z PMID: 32341549. (  0) 0) |
| [21] |
Allan VJ. Cytoplasmic dynein[J]. Biochem Soc Trans, 2011, 39(5): 1169-1178. DOI:10.1042/BST0391169 PMID: 21936784. (  0) 0) |
| [22] |
Nicholas MP, Höök P, Brenner S, et al. Control of cytoplasmic dynein force production and processivity by its C-terminal domain[J]. Nat Commun, 2015, 6: 6206. DOI:10.1038/ncomms7206 PMID: 25670086. (  0) 0) |
| [23] |
Hoogenraad CC, Akhmanova A. Bicaudal D family of motor adaptors: linking dynein motility to cargo binding[J]. Trends Cell Biol, 2016, 26(5): 327-340. DOI:10.1016/j.tcb.2016.01.001 PMID: 26822037. (  0) 0) |
| [24] |
Martín-Cófreces NB, Sánchez-Madrid F. Sailing to and docking at the immune synapse: role of tubulin dynamics and molecular motors[J]. Front Immunol, 2018, 9: 1174. DOI:10.3389/fimmu.2018.01174 PMID: 29910809. (  0) 0) |
| [25] |
Levy JR, Holzbaur EL. Cytoplasmic dynein/dynactin function and dysfunction in motor neurons[J]. Int J Dev Neurosci, 2006, 24(2-3): 103-111. DOI:10.1016/j.ijdevneu.2005.11.013 PMID: 16406469. (  0) 0) |
| [26] |
Egan MJ, Tan K, Reck-Peterson SL. Lis1 is an initiation factor for dynein-driven organelle transport[J]. J Cell Biol, 2012, 197(7): 971-982. DOI:10.1083/jcb.201112101 PMID: 22711696. (  0) 0) |
| [27] |
Clark GD. Platelet-activating factor acetylhydrolase and brain development[J]. Enzymes, 2015, 38: 37-42. DOI:10.1016/bs.enz.2015.09.009 PMID: 26612645. (  0) 0) |
| [28] |
Aiken J, Moore JK, Bates EA. TUBA1A mutations identified in lissencephaly patients dominantly disrupt neuronal migration and impair dynein activity[J]. Hum Mol Genet, 2019, 28(8): 1227-1243. DOI:10.1093/hmg/ddy416 PMID: 30517687. (  0) 0) |
| [29] |
Gonçalves JC, Dantas TJ, Vallee RB. Distinct roles for dynein light intermediate chains in neurogenesis, migration, and terminal somal translocation[J]. J Cell Biol, 2019, 218(3): 808-819. DOI:10.1083/jcb.201806112 PMID: 30674581. (  0) 0) |
| [30] |
Heinrich G, Lum T. Fish neurotrophins and Trk receptors[J]. Int J Dev Neurosci, 2000, 18(1): 1-27. DOI:10.1016/s0736-5748(99)00071-4 PMID: 10708902. (  0) 0) |
| [31] |
Hoang HT, Schlager MA, Carter AP, et al. DYNC1H1 mutations associated with neurological diseases compromise processivity of dynein-dynactin-cargo adaptor complexes[J]. Proc Natl Acad Sci U S A, 2017, 114(9): E1597-E1606. DOI:10.1073/pnas.1620141114 PMID: 28196890. (  0) 0) |
| [32] |
Lanshakov DA, Sukhareva EV, Kalinina TS, et al. Dexamethasone-induced acute excitotoxic cell death in the developing brain[J]. Neurobiol Dis, 2016, 91: 1-9. DOI:10.1016/j.nbd.2016.02.009 PMID: 26873551. (  0) 0) |
| [33] |
Sukhareva EV, Dygalo NN, Kalinina TS. Influence of dexamethasone on the expression of immediate early genes c-fos and c-jun in different regions of the neonatal brain[J]. Mol Biol (Mosk), 2016, 50(2): 266-271. DOI:10.7868/S0026898416020257 PMID: 27239846. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


