2. 安徽医科大学附属省儿童医院影像中心, 合肥安徽 230000;
3. 安徽医科大学附属省儿童医院新生儿外科, 合肥安徽 230000
卡梅综合征(Kasabach-Merritt syndrome,KMS),又称巨大血管瘤-血小板减少综合征,最早由Kasabach和Merritt于1940年报道[1],1997年Sarkar将KMS改为卡梅现象(Kasabach-Merritt phenomenon)[2]。KMS约占血管瘤病例的1%,好发于新生儿和婴幼儿,约80%患者在出生后1年内出现,病死率为10%~37%[3]。特点是迅速增大的血管瘤、持续的血小板减少伴出血倾向,引起患儿关节肢体功能障碍,严重的可导致内脏出血及全身弥散性血管内凝血[4],故早期诊断及选择有效治疗方案尤为重要。新生儿KMS疾病凶险,易出现反复甚至死亡,深部血管瘤容易漏诊,对激素不敏感者成为临床治疗的难点。近年来随着对KMS研究的深入,有报道使用长春新碱、普萘洛尔、西罗莫司及动脉栓塞介入干预治疗该疾病[5-7],虽具有较好临床疗效,但临床经验较少。本研究对安徽医科大学附属省儿童医院2016年1月至2020年12月收治的16例KMS新生儿的临床资料进行回顾性分析,为KMS的诊疗提供经验。
1 资料与方法 1.1 研究对象选择安徽医科大学附属省儿童医院2016年1月至2020年12月收治的16例KMS新生儿为研究对象。均符合KMS诊断标准[8]:(1)短期内迅速增大的血管瘤伴出血倾向;(2)血小板计数 < 100×109/L;(3)B超、CT、MRI等检查提示血管增强性肿块及血管腔内血栓形成;(4)排除其他原因导致的血小板减少症。
1.2 临床资料收集回顾性分析16例患儿的临床资料,包括性别、发病年龄、血管瘤部位及大小,实验室检查结果,B超、CT、MRI等影像学检查结果,治疗方法及预后。
1.3 治疗方案根据病情严重程度及治疗反应分别采取不同的治疗方案[8]:(1)内科保守治疗:所有患儿入院后均首选口服泼尼松2 mg/(kg·d),禁食者静脉滴注甲泼尼龙2 mg/(kg·d);(2)根据血管瘤的浸润深度、部位、范围进行手术切除(钝性+锐性剥离切除术);(3)局部介入动脉栓塞治疗:在全身麻醉下,采用Seldinger技术穿刺右股动脉,置入4F小儿鞘,常规肝素化用Cobra2导管插入左锁骨下动脉,并推进血管瘤供血动脉,向内注射博来霉素3 USP+碘化油2 mL+地塞米松1 mL混合物进行动脉栓塞;(4)西罗莫司0.025 mg/(kg·d)口服。对症治疗:有持续出血或血小板计数 < 10×109/L的患儿接受静脉滴注丙种球蛋白和甲泼尼龙冲击治疗[10 mg/(kg·d)];出现全身弥散性血管内凝血患儿加用冷沉淀或复合凝血酶原等对症支持处理。
1.4 疗效评定根据治疗4周后血管瘤变化(通过标尺和B超测量)、血小板计数变化、凝血功能情况进行评定。(1)好转:血管瘤消失或瘤体变软变小,血小板计数和凝血功能恢复正常。(2)无效:血管瘤未见缩小或持续增大,血小板计数及凝血功能未恢复正常[5]。随访内容:血管瘤大小变化、血小板及凝血功能检查、后续治疗及生存情况等,平均随访时间(8.6±1.8)个月。有效率(%)=好转例数/总例数×100。
1.5 统计学分析采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以均数±标准差(x±s)表示,不符合正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示;计数资料以例数或百分率(%)表示。
2 结果 2.1 一般情况16例新生儿,男13例(81%),女3例(19%);入院年龄为1 h至10 d,胎龄(38.5±1.2)周,足月儿15例(94%),早产儿1例(6%);新生儿平均体重为(3 246±345)g。见表 1。
| 表 1 16例KMS患儿基本资料及治疗4周后血管瘤情况 |
|
|
16例患儿中,13例(81%)为皮肤血管瘤(头面部2例、躯干5例、四肢6例),3例(19%)为肝脏血管瘤,见表 1。皮肤血管瘤呈紫色或暗红色病变,肿胀明显,张力增高,皮肤温度稍增高,边界不清,质地坚硬(图 1A)。大量出血点和瘀斑10例(62%),肺炎5例(31%),反应差3例(19%),心力衰竭、休克1例(6%)。
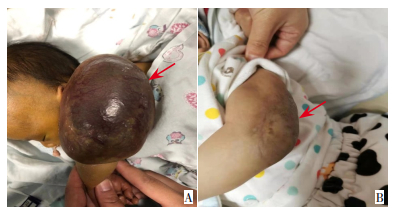
|
图 1 病例7左上肢血管瘤治疗前后对比 A:治疗前左上肢有15 cm×8 cm×8 cm紫红色肿块,触之质硬;B:经治疗6个月后血管瘤完全消失。箭头所指为血管瘤位置。 |
16例患儿入院时均有不同程度的血小板减少,中位血小板计数20.00(10.50,53.75)×109/L,范围(1~90)×109/L。16例患儿均完成凝血功能检查,中位凝血酶原时间16.10(14.65,95.48)s,稍延长(大于正常值3 s至正常范围高限2倍)8例,明显延长(大于正常范围高限2倍)4例,提示出血时间延长;活化部分凝血酶原时间[57.00(36.90,86.00)s],稍延长(大于正常值10 s至正常范围高限2倍)6例,明显延长(大于正常范围高限2倍)4例,提示内源性凝血功能障碍。16例患儿中位纤维蛋白原为0.85(0.40,1.07)g/L,均降低。12例患儿检测了D-二聚体,中位数为29.50(23.23,70.05)mg/L,均升高。
2.4 治疗效果糖皮质激素治疗对44%(7/16)患儿有效,4例复发,最终有效率19%(3/16);2例经手术治疗均有效;3例使用西罗莫司治疗,1例有效;6例经动脉栓塞联合西罗莫司治疗均有效。
16例患儿入院后均接受糖皮质激素治疗,7例(44%)治疗3~8 d后血小板计数开始增加,16~22 d后血小板计数及凝血功能恢复正常,瘤体缩小(20±3)%,其中3例血小板计数及凝血功能在接下来1年内保持正常,瘤体逐渐消退,另外4例(3例因病情严重和经济困难停止治疗后死亡,1例患儿转外院治疗)出现血小板计数下降,瘤体增大或破裂出血。3例(19%)接受西罗莫司治疗,1例治疗4周后瘤体缩小58.8%,血小板计数及凝血功能恢复正常;2例瘤体无明显变软缩小,血小板计数无明显回升,联合博来霉素动脉栓塞治疗4周后瘤体缩小(43.7±0.4)%,血小板计数及凝血功能恢复正常。4例(25%)单独接受博来霉素动脉栓塞4周后(图 2~3),瘤体缩小(52.0±3.4)%,病例7治疗后效果显著,随访半年后瘤体完全消失(图 1B),血小板计数及凝血功能恢复正常。2例(13%)接受外科钝性+锐性剥离切除术,术中完整切除全部瘤体,术后无感染及复发,血小板计数及凝血功能恢复正常,其中1例(病例4)术后病理结果为卡波西样血管内皮瘤(Kaposiform hemangioendothelioma,KHE)(图 4)。各病例治疗前情况见表 1。
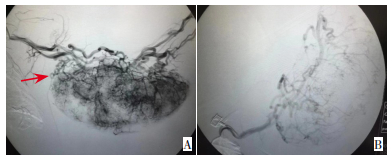
|
图 2 病例7左上肢血管瘤动脉栓塞介入前后对比 A:治疗前动脉造影提示左上肢血管瘤供血动脉(箭头所指位置);B:经动脉栓塞介入治疗后,血管瘤供血动脉被栓塞,说明此次动脉栓塞介入治疗有效。 |
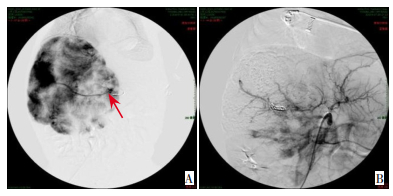
|
图 3 病例15肝脏血管瘤动脉栓塞介入治疗前后对比 A:治疗前动脉造影提示肝脏血管瘤供血动脉(箭头所指位置);B:经动脉栓塞介入治疗后,血管瘤供血动脉被栓塞,说明此次动脉栓塞介入治疗有效。 |
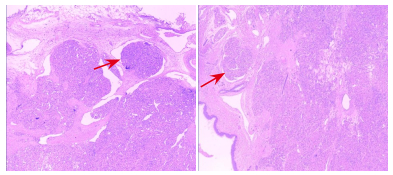
|
图 4 病例4左大腿血管瘤外科术后病理组织苏木精-伊红染色(×100) 箭头所指细胞呈巢状及团块状分布,肿瘤细胞大小一致,分界不清,肿瘤组织间见大小不一,形状不规则的腔隙样结构,提示卡波西样血管内皮瘤。 |
KMS是一种罕见的血管瘤并发症,与KHE和丛状血管瘤有关,约70% KHE病例中可以发现KMS[6],病死率高达10%~37%[3]。本研究中死亡3例,病死率为19%,与报道一致[3]。本研究结果显示,KMS的临床表现与血管瘤入侵的位置、深度、大小均有关。13例患儿血管瘤位于皮肤、肌肉,局部病变为青紫色或紫罗兰色斑块,与周围组织边界不清,引起局部疼痛和肌肉关节活动障碍;3例肝脏血管瘤患儿入院胸部X线均提示心影增大,1例(病例16)很快出现心力衰竭;死亡3例(均为本研究早期病例),血管瘤体积均较大,与Schmid等[9]研究一致。肝脏及腹膜后血管瘤合并血管畸形时易出现静脉回流增加,加重心脏容量负荷,是导致心力衰竭[10]及压迫症状等临床并发症的主要原因。本研究中69%患儿血小板计数 < 30×109/L,属重度血小板减少,100%活化部分凝血酶原时间延长,100%纤维蛋白原降低,100%(12/12)D-二聚体增高。5例患儿治疗初期在血小板持续减低时D-二聚体始终显著增高,最高达80 ng/L,治疗后血小板计数恢复正常时,D-二聚体也恢复正常。是否D-二聚体愈高则病情愈重,因样本量有限,无法分析血小板与D-二聚体之间的关系。目前认为血小板减少是由于循环血小板被畸形血管瘤捕获和激活,导致血小板被过度消耗导致[11]。在KMS中,由于血小板消耗性减少可进一步导致纤维蛋白原消耗性减少,导致微血管溶血性贫血、凝血功能异常、D-二聚体显著增加,出血时间和凝血时间明显延长。值得一提的是,活化的血小板可通过诱导凝血使血管瘤体积增大,捕获和消耗血小板能力增强,出血风险增大,所以血小板输注仅适用于血小板计数 < 30×109/L伴有出血倾向或术前临时增加血小板计数,但不作常规使用[12]。临床上如果患儿反复出现重度血小板减少,除了基本的血常规和凝血功能检查,腹腔和胸腔的影像学检查也应及时完善,做到早诊断、早评估、早治疗。
KMS主要治疗目的为控制血小板减少、恢复凝血功能和促进血管瘤完全消退[13]。目前诊疗共识指出全身用药是治疗KMS的首选方法,常用药物有糖皮质激素、西罗莫司、长春新碱等[8]。糖皮质激素可以抑制纤溶和血栓形成,刺激骨髓造血,增加血小板释放到血液中,降低抗血小板抗体水平,增加血小板计数,然而仅对30%~50% KMS患儿有效[14]。本研究中糖皮质激素治疗有效率为44%,因此,更有效的治疗方法是必要的。西罗莫司是一种新型的大环内酯类免疫抑制剂,具有免疫抑制和一定的抑制肿瘤增生效果。自从2010年西罗莫司用于治疗KHE以来,多个研究报道了西罗莫司用于治疗KMS和KHE的成功案例[6, 15-17]。西罗莫司治疗KMS的用药方式为口服,临床易推广,实用性强,相对安全,缺点是长期使用患儿将暴露于免疫抑制的风险中,易继发感染,故其治疗安全有效剂量及停药指征仍需重点关注。用药剂量是影响疗效的关键因素,西罗莫司血药浓度波动很大,剂量的微量变化就有可能导致血药浓度成倍改变,根据既往文献报道,其目标浓度应在8~15 ng/mL范围内[13],故治疗需密切监测血药浓度并及时调整剂量,停药指征为血管瘤大小稳定、血小板计数及凝血功能正常,用药期限不超过3年。西罗莫司对于新生儿未来生长发育的影响尚不能有效评估,需长期随访。本研究中3例糖皮质激素治疗无效患儿继续接受西罗莫司治疗,1例治疗4周后瘤体缩小58.8%,血小板计数及凝血功能恢复正常,未出现口腔溃疡、血尿、肝肾功能异常等严重免疫抑制;2例瘤体无明显变软缩小,血小板计数未上升至正常,联合博来霉素动脉栓塞治疗4周后瘤体缩小(43.7±0.4)%,血小板计数及凝血功能恢复正常。长春新碱虽抗肿瘤作用较好,但新生儿用药可引起神经病变、骨髓抑制和消化道不良反应,本研究中无接受长春新碱治疗的病例。
本研究中共6例患儿接受博来霉素动脉栓塞治疗,其中2例1次完成动脉栓塞治疗患儿术后出现低热,3例患儿分2次(间隔时间不等,分别为13、38、42 d)完成动脉栓塞治疗,术后未出现发热、脓毒血症、骨髓抑制或神经毒性等不良反应,均对促进血管瘤消退发挥了良好效果,血小板计数在栓塞后2~5 d开始增加,10~16 d后血小板计数恢复正常,凝血功能恢复正常。博来霉素可抑制肿瘤细胞DNA的合成并使其DNA链断裂,影响肿瘤细胞代谢功能,加速肿瘤细胞变性坏死,可有效控制症状和促进血管瘤的消退[7, 18-19]。由于新生儿的血管很细,操作难度大,且动脉栓塞可能引起发热、局部深在性坏死和疤痕,甚至诱发脓毒血症,故新生儿动脉栓塞存在一定困难和风险,需较高的专业技术且单次注射剂量不宜过大。本研究中仅有2例血管瘤位于大腿和腰骶部KMS患儿接受手术切除治疗,术后均恢复良好,未见创面感染和复发。手术切除血管瘤瘤体虽被认为是KMS的根治方法,但存在术中高出血风险、术后高感染风险及遗留巨大疤痕组织,不适用头面部瘤体等不良因素,故不作为KMS首选治疗方案[20]。
综上所述,KMS临床表现多样,深部病灶起病隐匿,进展迅速,故早期诊断至关重要。手术切除血管瘤有较好疗效,但具有明显局限性,不作为KMS首选治疗方案。对于激素治疗效果不佳的KMS患儿,可以根据医院及患儿情况酌情选择西罗莫司和动脉栓塞治疗。本研究为单中心资料,样本量较少,无法比较西罗莫司及动脉栓塞的优劣。经积极治疗,KMS患儿预后良好。
| [1] |
Kasabach HH, Merritt KK. Capillary hemangioma with extensive purpura: report of a case[J]. Am J Dis Child, 1940, 59(3): 1063-1070. DOI:10.1001/archpedi.1940.01990160135009 (  0) 0) |
| [2] |
Sarkar M, Mulliken JB, Kozakewich HP, et al. Thrombocytopenic coagulopathy (Kasabach-Merritt phenomenon) is associated with Kaposiform hemangioendothelioma and not with common infantile hemangioma[J]. Plast Reconstr Surg, 1997, 100(6): 1377-1386. DOI:10.1097/00006534-199711000-00001 PMID: 9385948. (  0) 0) |
| [3] |
Radović SV, Kolinović M, Ljubić D. Propranolol in the preoperative treatment of Kasabach-Merritt syndrome: a case report[J]. J Med Case Rep, 2017, 11(1): 308. DOI:10.1186/s13256-017-1475-0 PMID: 29073926. PMCID: PMC5658992. (  0) 0) |
| [4] |
O'Rafferty C, O'Regan GM, Irvine AD, et al. Recent advances in the pathobiology and management of Kasabach-Merritt phenomenon[J]. Br J Haematol, 2015, 171(1): 38-51. DOI:10.1111/bjh.13557 PMID: 26123689. (  0) 0) |
| [5] |
Ji Y, Chen SY, Yang KY, et al. Kaposiform hemangioendothelioma: current knowledge and future perspectives[J]. Orphanet J Rare Dis, 2020, 15(1): 39. DOI:10.1186/s13023-020-1320-1 PMID: 32014025. PMCID: PMC6998257. (  0) 0) |
| [6] |
Wang Y, Kong LL, Sun BH, et al. Sirolimus for Kaposiform hemangioendothelioma with Kasabach-Merritt phenomenon in two infants[J]. J Craniofac Surg, 2020, 31(4): 1074-1077. DOI:10.1097/SCS.0000000000006301 PMID: 32176003. (  0) 0) |
| [7] |
Wang P, Zhou W, Tao L, et al. Clinical analysis of Kasabach-Merritt syndrome in 17 neonates[J]. BMC Pediatr, 2014, 14: 146. DOI:10.1186/1471-2431-14-146 PMID: 24920221. PMCID: PMC4088914. (  0) 0) |
| [8] |
中华医学会整形外科分会血管瘤和脉管畸形学组. 血管瘤和脉管畸形的诊断及治疗指南(2019版)[J]. 组织工程与重建外科杂志, 2019, 15(5): 277-317. DOI:10.3969/j.issn.1673-0364.2019.05.001 (  0) 0) |
| [9] |
Schmid I, Klenk AK, Sparber-Sauer M, et al. Kaposiform hemangioendothelioma in children: a benign vascular tumor with multiple treatment options[J]. World J Pediatr, 2018, 14(4): 322-329. DOI:10.1007/s12519-018-0171-5 PMID: 30054848. (  0) 0) |
| [10] |
郭丹, 刘红, 吴海兰, 等. 新生儿卡梅现象九例临床分析[J]. 中华新生儿科杂志(中英文), 2018, 33(3): 200-204. DOI:10.3760/cma.j.issn.2096-2932.2018.03.011 (  0) 0) |
| [11] |
黄绍良, 陈纯, 周敦华. 实用小儿血液病学[M]. 北京: 人民卫生出版社, 2014: 409-412.
(  0) 0) |
| [12] |
Cabrera TB, Speer AL, Greives MR, et al. Sirolimus for Kaposiform hemangioendothelioma and Kasabach-Merritt phenomenon in a neonate[J]. AJP Rep, 2020, 10(4): e390-e394. DOI:10.1055/s-0040-1718901 PMID: 33214934. PMCID: PMC7669432. (  0) 0) |
| [13] |
Blei F. Kaposiform hemangioendothelioma: therapeutic efficacy for an enigmatic diagnosis[J]. Pediatr Blood Cancer, 2015, 62(4): 551-552. DOI:10.1002/pbc.25365 PMID: 25559734. (  0) 0) |
| [14] |
Yao W, Li K, Wang ZP, et al. Comparison of efficacy and safety of corticosteroid and vincristine in treating Kaposiform hemangioendothelioma and tufted angioma: a multicenter prospective randomized controlled clinical trial[J]. J Dermatol, 2021, 48(5): 576-584. DOI:10.1111/1346-8138.15767 PMID: 33608936. (  0) 0) |
| [15] |
Lackner H, Karastaneva A, Schwinger W, et al. Sirolimus for the treatment of children with various complicated vascular anomalies[J]. Eur J Pediatr, 2015, 174(12): 1579-1584. DOI:10.1007/s00431-015-2572-y PMID: 26040705. (  0) 0) |
| [16] |
单禹华, 褚珺, 胡明, 等. 西罗莫司治疗婴幼儿难治性卡-梅综合症的可行性分析[J]. 组织工程与重建外科杂志, 2017, 13(5): 244-247. DOI:10.3969/j.issn.1673-0364.2017.05.002 (  0) 0) |
| [17] |
张高磊, 高莹, 刘燕, 等. 难治性卡波希样血管内皮细胞瘤及卡梅综合征十例临床分析[J]. 中华儿科杂志, 2017, 55(9): 700-704. DOI:10.3760/cma.j.issn.0578-1310.2017.09.015 PMID: 28881518. (  0) 0) |
| [18] |
Guo L, Wu CH, Song D, et al. Transcatheter arterial sclerosing embolization for the treatment of giant propranolol-resistant infantile hemangiomas in the parotid region[J]. J Vasc Interv Radiol, 2021, 32(2): 293-298. DOI:10.1016/j.jvir.2020.09.029 PMID: 33221193. (  0) 0) |
| [19] |
Brill R, Uller W, Huf V, et al. Additive value of transarterial embolization to systemic sirolimus treatment in Kaposiform hemangioendothelioma[J]. Int J Cancer, 2021, 148(9): 2345-2351. DOI:10.1002/ijc.33406 PMID: 33231291. (  0) 0) |
| [20] |
Wu YH, Qiu RL, Zeng LX, et al. Effective surgical treatment of life-threatening huge vascular anomalies associated with thrombocytopenia and coagulopathy in infants unresponsive to drug therapy[J]. BMC Pediatr, 2020, 20(1): 187. DOI:10.1186/s12887-020-02093-x PMID: 32340603. PMCID: PMC7187498. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


