变应性疾病,又称过敏性疾病,根据WHO,35%的世界人口有过敏性疾病[1],过敏原检测已广泛用于过敏性疾病的病因诊断。
目前过敏原的检测广义上分为体外和体内方法,两者结果不可替代[2]。体外方法多为全定量检测[3]。体内方法以皮肤试验最为常见,美国变态反应哮喘和免疫联合会及欧洲变态反应和临床免疫学会推荐:经皮皮肤点刺试验(skin prick test, SPT)是诊断IgE介导的变态反应疾病的主要检测方法,也是选择过敏原免疫治疗的首选方法[4]。1865年,英国医生Charles Harrison Blackley用花粉颗粒在自己的前臂进行了最早的SPT,证实花粉是导致自己变应性鼻炎(AR)的病因[5]。SPT具有操作简便、设备简单,一次可测定多种过敏原,短时间内报告结果,安全性好等优点,已广泛应用于临床诊断和流行病学调查等。
目前国内普遍应用单点刺针进行SPT,尚未应用多头点刺设备进行儿童过敏原SPT。而国外自20世纪70年代,皮肤测试设备历经不断改进,朝着使用多头设备的趋势发展[6],已在儿童和成人中应用[7]。多头点刺器有多种,Multi-Test Ⅱ(美国Lincoln Diagnostics公司)为常用的多头点刺器之一,Multi-Test Ⅱ与Multi-Test相比其测试头有更小的尖头集簇[8]。Multi-Test Ⅱ为联排等间距设计,一次可进行8种过敏原的点刺,操作简便,提高了点刺效率,并增加了患儿的配合度。
1 资料与方法 1.1 研究对象选取2017年3~9月在北京儿童医院过敏反应科就诊并符合本研究病例选择标准的87例患儿为研究对象,年龄范围3~18岁,所有患儿已被诊断为过敏性疾病,诊断依据患儿临床病史、症状、体征、实验室检测结果等[9-12]。本研究得到首都医科大学附属北京儿童医院伦理委员会的批准,并由家长签署知情同意书。
1.2 病例选择标准入选标准:(1)患儿配合良好。(2)患儿前臂无疤痕、丘疹、药疹等。
排除标准:(1)药物禁忌:患者检测前3 d未停用第一代抗组胺类药物及含第一代抗组胺成分类药物,检测前7 d未停用第二代抗组胺类药物和糖皮质激素类药物。(2)禁忌人群:皮肤划痕症阳性患者,前臂因患荨麻疹或湿疹而无法点刺者,急性发作或加重的哮喘患者。
剔除标准:(1)过敏原点刺试验中阳性对照为阴性。(2)无任何记录者。(3)仅有过敏原体内试验结果或者仅有sIgE结果。
1.3 观察方法所有患儿完成户尘螨、粉尘螨、链格孢、猫毛皮屑、狗毛皮屑和豚草花粉共6种过敏原的体内和体外检测。体内过敏原试验中,每位患儿右侧前臂屈侧应用Multi-Test Ⅱ方法检测,左侧前臂屈侧应用单点刺针方法进行点刺试验,两种方法使用相同的过敏原点刺液,20 min后观察结果,每侧操作完毕均行VAS评估。
1.4 体内过敏原试验及结果判读标准体内试验所用阳性对照、阴性对照、户尘螨、粉尘螨、链格孢、猫毛皮屑、狗毛皮屑和豚草花粉均由北京新华联协和药业有限责任公司提供,磷酸组胺为阳性对照,浓度为5 mg/mL,缓冲盐水-甘油为阴性对照,试验由2位经培训的专业人员完成。
单点刺针方法检测步骤及结果判读标准:用75%酒精消毒左侧前臂屈侧皮肤,待干后按顺序滴上过敏原点刺液,用点刺针通过液滴垂直刺入皮肤,深度为1 mm,以不出血为宜,一般按压3 s,使针尖下面有少量试液进入皮肤,不同的液滴需更换新点刺针,20 min后观察皮肤风团大小。“-”阴性:小于阳性对照的1/3;“+”阳性:为阳性对照的1/3及以上;“2+”中阳性:为阳性对照的2/3及以上;“3+”强阳性:与阳性对照基本相同;“4+”极强阳性:> 阳性对照[13]。
Multi-Test Ⅱ方法检测步骤及结果判读标准:从包装中取出Multi-Test Ⅱ,将Multi-Test Ⅱ垂直放入装有过敏原提取物和对照溶液的Dipwell托盘内,充分沾取过敏原点刺液后,于患儿右侧前臂屈侧左右上下晃动,晃动时不要离开皮肤,操作完毕将Multi-Test Ⅱ废弃,结果依照厂家提供的说明书进行判读。
1.5 VAS评估方法向患者说明0分代表无痛,10分代表最严重的疼痛,用一条游动标尺标10个刻度,两端分别为“0分”端和“10分”端,刻度一面背向患者,让患者根据自己所感受的疼痛程度移动游动标尺,标尺所处位置代表患者疼痛程度,评分值可精确到小数点后一位[14]。
1.6 体外过敏原试验及结果判读标准入选者于皮肤试验当日抽取静脉血4~5 mL,离心后取血清,应用荧光酶联免疫法进行sIgE浓度的测定。分级标准如下:血清sIgE < 0.35 kUA/L者为阴性;血清sIgE≥0.35 kUA/L者为阳性,依sIgE含量高低又可分为6级:sIgE浓度在0.35 kUA/L~者为1级;sIgE浓度在0.70 kUA/L~者为2级;sIgE浓度在3.5 kUA/L~者为3级;sIgE浓度在17.5 kUA/L~者为4级;sIgE浓度在50.0~100.0 kUA/L者为5级;sIgE浓度 > 100.0 kUA/L者为6级[15]。
1.7 统计学分析应用SPSS 19.0统计软件对数据进行统计学分析。服从正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用配对t检验;不服从正态分布的计量资料用中位数(范围)表示,两组间比较采用Wilcoxon符号秩和检验。计数资料用率(%)表示,多组间比较采用χ2检验。计算灵敏度、特异度、阳性预测值、阴性预测值和准确度。以灵敏度为纵坐标,1-特异度为横坐标绘制受试者工作特征曲线(receiver operating characteristic curve, ROC),计算相应的ROC曲线下面积(AUC)及95%可信区间。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况87例患儿中,男59例(68%),女28例(32%),平均年龄7.7±2.5岁。其中鼻炎合并哮喘患儿51例(59%),过敏性鼻炎、过敏性鼻-结膜炎、过敏性结膜炎患儿18例(21%),单纯哮喘患儿14例(16%),湿疹患儿2例(2%),丘疹性荨麻疹患儿1例(1%),咳嗽变异性哮喘患儿1例(1%)。Multi-Test Ⅱ方法阳性检出率前三位依次为狗毛皮屑、豚草花粉、户尘螨;单点刺针方法阳性检出率前三位依次为粉尘螨、豚草花粉、户尘螨;荧光酶联免疫方法阳性检出率前三位依次为豚草花粉、链格孢、户尘螨和粉尘螨;3种方法阳性检出率比较差异无统计学意义(P > 0.05)(表 1)。Multi-Test Ⅱ和单点刺针方法阳性对照平均风团大小分别为4.8±1.7 mm、3.8±1.2 mm,差异有统计学意义(P < 0.05),提示Multi-Test Ⅱ引起的皮肤风团反应更强。
| 表 1 3种方法对6种过敏原的阳性检出率比较[例(%)] |
|
|
以单点刺针方法结果为相对标准,以Multi-Test Ⅱ检测结果≥“+”为阳性判断界值,评估6种过敏原的灵敏度和特异度(表 2);Multi-Test Ⅱ方法灵敏度为72.7%,特异度为78.2%,阳性预测值为60.6%,阴性预测值为86.1%,准确度为76.4%。
| 表 2 以单点刺针方法为标准Multi-Test Ⅱ方法的诊断价值 |
|
|
应用ROC进行诊断价值评估,从图 1可以看出,Multi-Test Ⅱ方法诊断过敏原致敏的AUC为0.788,95%可信区间为:0.742~0.833。当Multi-Test Ⅱ方法阳性界值为1.25 mm时,灵敏度和特异度最佳,分别为74.3%、74.1%。

|
图 1 以单点刺针方法为标准Multi-Test Ⅱ方法诊断过敏原致敏的ROC分析 |
以荧光酶联免疫方法结果为相对标准,以Multi-Test Ⅱ检测结果≥“+”为阳性判断界值,评估6种过敏原的灵敏度和特异度(表 3);Multi-Test Ⅱ方法灵敏度为73.4%,特异度为77.5%,阳性预测值为58.6%,阴性预测值为87.0%,准确度为76.2%。
| 表 3 以荧光酶联免疫方法为标准Multi-Test Ⅱ方法的诊断价值 |
|
|
应用ROC进行诊断价值评估,从图 2可以看出,Multi-Test Ⅱ方法诊断过敏原致敏的AUC为0.802,95%的可信区间为:0.756~0.848。当Multi-Test Ⅱ方法阳性界值为1.25 mm时,灵敏度和特异度最佳,分别为75.9%、73.6%。
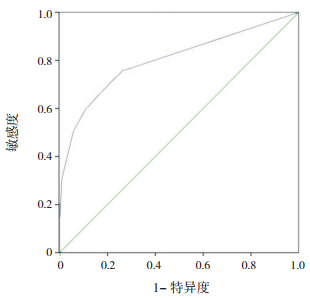
|
图 2 以荧光酶联免疫方法为标准Multi-Test Ⅱ方法诊断过敏原致敏的ROC分析 |
83例患儿进行了体内过敏原检测两种方法VAS评分,结果显示Multi-Test Ⅱ法和单点刺针法VAS评分值分别为1.60(0~8.10)分、3.20(0.2~10.0)分,差异有统计学意义(Z=2694.5,P < 0.05)。
3 讨论SPT作为一种快速、简便、灵敏的方法已在儿童过敏性疾病中广泛应用,对于点刺装置的选择已开展了广泛的讨论与研究[16-17],既往我国有学者对不同尘螨过敏原点刺液进行研究[18],而本研究是评价不同针具的应用。结果表明对于户尘螨、链格孢,Multi-Test Ⅱ的灵敏度和特异度较高,对于粉尘螨、猫毛皮屑,其灵敏度较低、特异度高,对于狗毛皮屑、豚草花粉其灵敏度高而特异度较低。目前过敏原SPT的评判标准尚未统一,可能存在不同评判标准导致结果的差异,因此需严格按照厂家提供的说明书进行判读。也有研究指出SPT的结果受到操作者的操作技术、点刺装置、点刺部位、过敏原提取液的浓度、药物等各种因素影响[19],本研究由2位经培训的专业人员进行操作,前期已行重复性分析。
此外,国外有研究以鼻腔激发试验为金标准,梯牧草过敏原使用Multi-Test Ⅱ进行点刺的灵敏度和特异度分别为87%和86%[20],而在另一项研究中链格孢过敏原同样使用Multi-Test Ⅱ进行点刺试验其灵敏度和特异度则不足50%[21],这些发现可能提示不同过敏原的皮肤反应性具有差异。有研究表明多头点刺针与单头针具相比更易产生假阴性的反应[22],一项对两种单头(Greer Pick, Duotip-Test)和两种多头(Multi-Test Ⅱ, OMNI)点刺针具的比较研究中表明单头比多头有更高的灵敏度[23]。一项前瞻性双盲的临床研究表明,不同点刺针具在不同部位具有不同的反应性,多头针具在背部皮肤点刺的反应性较强,单头针具在前臂的反应性更强[4],表明不同针具在相同部位灵敏度不同。
本研究中Multi-Test Ⅱ与单点刺针方法比较阳性对照平均风团较大,表明其在皮肤上有更大的反应性。国外多以风团≥3 mm为阳性[24],两种方法分别依据其标准进行结果判读,Multi-Test Ⅱ和单点刺针方法阳性检出例数分别为188、165项次,达到阳性3~4级分别为19、98项次,故本研究定性分析了点刺试验结果,并未进行级别相关性分析。
本研究以体内单点刺针方法和荧光酶联免疫方法结果为标准,有研究表明应用CAP系统对我国常见的尘螨、蒿属花粉、律草花粉、猫毛屑、链格孢酶5种过敏原进行分析,结果显示,除链格孢酶以外的4种sIgE检测的敏感度均大于91%,特异度均大于93%,与临床诊断之间的一致性(调整一致性)均大于91%[25],其是业内公认的过敏原体外检测的金标准[26]。在过敏原选择方面,由于Multi-Test Ⅱ数量的限制,本研究未对春季花粉进行评价。
本研究使用AUC综合评价Multi-Test Ⅱ的灵敏度和特异度,结果显示AUC均高于0.78,表明有较好的诊断价值。传统使用的单点刺针,要求受试者固定上臂的位置配合度高,在低龄儿童中难以实施,Multi-Test Ⅱ为联排等间距设计(间距2 cm×2.5 cm×8个),一次可进行8种过敏原的点刺,使检测操作步骤的效率加快同时大幅度降低配合度要求,并增加低龄儿童检测成功率,Multi-Test Ⅱ方法也具有较好的患儿接受度。
临床过敏性疾病的诊断需临床病史和体内体外过敏原检测结果相结合[11-12]。而Multi-Test Ⅱ目前还未在国内广泛使用,对于本研究之外的过敏原的灵敏度和特异度还需要更多临床数据和研究团队进行更深一步的探讨。
| [1] |
Rizzo MC, Solé D, Rizzo A, et al. Atopic disease in Brazilian children-eiologic multicentric study[J]. J Pediatr (Rio J), 1995, 71(1): 31-35. DOI:10.2223/JPED.699 (  0) 0) |
| [2] |
Sekerel BE, Sahiner UM, Bousquet J, et al. Practical guide to skin prick tests in allergy to aeroallergens:some concerns[J]. Allergy, 2012, 67(3): 442. DOI:10.1111/all.2012.67.issue-3 (  0) 0) |
| [3] |
向莉. 过敏原检测在儿科临床应用[J]. 中国实用儿科杂志, 2009, 24(11): 840-843. (  0) 0) |
| [4] |
Carr WW, Martin B, Howard RS, et al. Comparison of test devices for skin prick testing[J]. J Allergy Clin Immunol, 2005, 116(2): 341-346. DOI:10.1016/j.jaci.2005.03.035 (  0) 0) |
| [5] |
Bernstein DI. The skin prick test:"more than meets the eye"[J]. Ann Allergy Asthma Immunol, 2004, 92(6): 587-588. DOI:10.1016/S1081-1206(10)61422-6 (  0) 0) |
| [6] |
Dykewicz MS, Lemmon JK, Keaney DL. Comparison of the Multi-Test Ⅱ and Skintestor Omni allergy skin test devices[J]. Ann Allergy Asthma Immunol, 2007, 98(6): 559-562. DOI:10.1016/S1081-1206(10)60735-1 (  0) 0) |
| [7] |
Maniglia SF, Tsuru FM, Santos VC, et al. Sensitization profile to allergens in patients using Multi-Test Ⅱ[J]. Int Arch Otorhinolaryngol, 2014, 18(4): 391-397. DOI:10.1055/s-00025477 (  0) 0) |
| [8] |
Simons JP, Rubinstein EN, Kogut VJ, et al. Comparison of Multi-Test Ⅱ skin prick testing to intradermal dilutional testing[J]. Otolaryngol Head Neck Surg, 2004, 130(5): 536-544. DOI:10.1016/j.otohns.2004.02.005 (  0) 0) |
| [9] |
中华医学会皮肤性病学分会免疫学组. 湿疹诊疗指南(2011年)[J]. 中华皮肤科杂志, 2011, 44(1): 5-6. (  0) 0) |
| [10] |
中华医学会皮肤性病学分会免疫学组. 中国荨麻疹诊疗指南(2014版)[J]. 中国实用乡村医生杂志, 2015, 22(17): 45-47. DOI:10.3969/j.issn.1672-7185.2015.17.026 (  0) 0) |
| [11] |
中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组. 变应性鼻炎诊断和治疗指南(2015年, 天津)[J]. 中华耳鼻咽喉头颈外科杂志, 2016, 51(1): 6-24. DOI:10.3760/cma.j.issn.1673-0860.2016.01.004 (  0) 0) |
| [12] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 (  0) 0) |
| [13] |
王夕娟. 变应性鼻炎吸入物过敏原皮肤点刺试验结果分析[J]. 中国实用医药, 2014, 9(13): 8-10. (  0) 0) |
| [14] |
李雪薇. 护理评估在视觉模拟评分中的临床应用[J]. 现代医药卫生, 2016, 32(12): 1912-1913. (  0) 0) |
| [15] |
Glovsky MM. Measuring allergen-specifc IgE:where have we been and where are we going?[J]. Methods Mol Biol, 2007, 378: 205-219. DOI:10.1007/978-1-59745-323-3 (  0) 0) |
| [16] |
Masse MS, Granger Vallée A, Chiriac A, et al. Comparison of five techniques of skin prick tests used routinely in Europe[J]. Allergy, 2011, 66(11): 1415-1419. DOI:10.1111/all.2011.66.issue-11 (  0) 0) |
| [17] |
Dykewicz MS, Dooms KT, Chassaing DL. Comparison of the Multi-Test Ⅱ and Comfor Ten allergy skin test devices[J]. Allergy Asthma Proc, 2011, 32(3): 198-202. DOI:10.2500/aap.2011.32.3441 (  0) 0) |
| [18] |
孙劲旅, 王瑞琦, 尹佳, 等. 几种户尘螨过敏原点刺液的临床评价[J]. 基础医学与临床, 2009, 29(6): 631-635. (  0) 0) |
| [19] |
Oppenheimer J, Nelson HS. Skin testing:a survey of allergists[J]. Ann Allergy Asthma Immunol, 2006, 96(1): 19-23. DOI:10.1016/S1081-1206(10)61034-4 (  0) 0) |
| [20] |
Krouse JH, Sadrazodi K, Kerswill K. Sensitivity and specificity of prick and intradermal testing in predicting response to nasal provocation with timothy grass antigen[J]. Otolaryngol Head Neck Surg, 2004, 131(3): 215-219. DOI:10.1016/j.otohns.2004.03.024 (  0) 0) |
| [21] |
Krouse JH, Shah AG, Kerswill K. Skin testing in predicting response to nasal provocation with alternaria[J]. Laryngoscope, 2004, 114(8): 1389-1393. DOI:10.1097/00005537-200408000-00013 (  0) 0) |
| [22] |
Nelson HS, Lahr J, Buchmeier A, et al. Evaluation of devices for skin prick testing[J]. J Allergy Clin Immunol, 1998, 101(2 Pt 1): 153-156. (  0) 0) |
| [23] |
Yoon IK, Martin BL, Carr WW. A comparison of two singleheaded and two multi-headed allergen skin test devices[J]. Allergy Asthma Proc, 2006, 27(6): 473-478. DOI:10.2500/aap.2006.27.2937 (  0) 0) |
| [24] |
Heinzerling L, Mari A, Bergmann KC, et al. The skin prick test-European standards[J]. Clin Transl Allergy, 2013, 3(1): 3. DOI:10.1186/2045-7022-3-3 (  0) 0) |
| [25] |
王瑞琦, 张宏誉. CAP系统检测过敏原特异性IgE抗体的方法学评价[J]. 临床检验杂志, 2007, 25(2): 109-110. (  0) 0) |
| [26] |
Crameri R. Global atlas of allergy[M]. Zurich: European Academy of Allergy and Clinical Immunology, 2014: 166-167.
(  0) 0) |
 2018, Vol. 20
2018, Vol. 20


