注意缺陷多动障碍(attention deficit hyperac-tivity disorder, ADHD)是一种常见的慢性神经发育障碍性疾病,按照临床表现分为注意力缺陷型、多动-冲动型、混合型三个亚型[1]。在全球范围内,患病率约3.4%[2]。ADHD起病于儿童期,但其临床表现可持续到青春期,乃至成年,不仅影响个人健康状况和发展,而且也给患者家庭、学校、社会带来诸多不利影响。国外研究和本课题组均发现ADHD患儿皮质醇水平较正常儿童低[3-4],但皮质醇水平对ADHD的影响尚未完全阐明。下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴是人体最重要的神经内分泌轴之一,其终产物主要是糖皮质激素(glucocorticoid, GC),GC主要通过和糖皮质激素受体(glucocorticoid receptor, GR)结合发挥生物学作用,皮质醇是人类分泌的主要GC[5]。GC/GR对ADHD的影响是近年来研究的热点。本实验通过行为学测试观察药物干预前自发性高血压大鼠(SHR)、Wistar Kyoto(WKY)和Sprague-Dawley(SD)大鼠在开场实验和Lat迷宫中的表现及应用GR激动剂地塞米松(dexamethasone, DEX)或GR抑制剂米非司酮(mifepristone, RU486)前后SHR行为学的变化,探讨ADHD亚型理想的动物模型及GR功能对ADHD大鼠的影响,以期为ADHD的基础研究和治疗提供更多的理论依据。
1 材料与方法 1.1 实验动物清洁级生后21 d(postnatal day, P21)雄性SHR 24只(体重50±3 g)、WKY大鼠8只(体重48±4 g)、SD大鼠8只(体重50±4 g),均由福州吴氏实验动物中心提供。以上大鼠均置于洁净环境中自由进食饲料和饮用自来水,室温控制于23±2℃,湿度保持在约56%,12 h间断照明,24 h定期进行紫外杀菌消毒和排风,避免强光和强声刺激。实验动物的使用严格遵循《实验动物管理条例》相关规定。
1.2 实验分组和干预方法将P21的SHR随机分成GR激动剂组、GR抑制剂组和SHR组(n=8);P21的WKY大鼠和SD大鼠各8只作为对照,即为WKY组和SD组。参照文献,GR激动剂组每日给予DEX(北京双鹤药业股份有限公司)0.5 mg/kg[6];GR抑制剂组每日给予RU486(北京中杉金桥生物技术有限公司)54 mg/kg[7];SHR组、WKY组和SD组均每日给予0.5 mL/kg生理盐水。各组大鼠均于每日清晨8 : 00左右采用腹腔注射给药,1 d 1次,连续用药14 d。
1.3 行为学测试入组的所有大鼠均进行行为学评估。各组大鼠行为学测试时间均安排在每天上午8 : 00~11 : 00,分别在大鼠给药前(P21)和给药后(P35)各测试1次。同时具备明显的自发活动和非选择性注意力缺陷的大鼠作为ADHD混合型的动物模型,以注意力缺陷为主要表现的大鼠作为ADHD注意力缺陷型的动物模型,以自发活动为主要表现的大鼠则作为ADHD多动-冲动型的动物模型。
1.4 开场实验实验参考文献[8],实验装置为一个高约40 cm、底约60 cm×60 cm的黑木箱,利用线条将箱子底部分为9个20 cm×20 cm的小方块。每次实验开始前用75%无水乙醇消毒黑木箱后用清水擦拭3遍,电吹风吹干,保持箱子干净整洁且无特殊味道。将摄像机放置于黑木箱正上方,以便能完全拍摄大鼠所有行动路径为准。测试时,先将大鼠轻轻从笼子中提取出来,同时轻轻抖去其身上的垫料,轻柔地将大鼠放入中央的格子中,开始拍摄和计时,每只大鼠每天测试1次,时间设定为5 min,观察大鼠在5 min内穿越的格子数、直立次数和理毛次数。穿越格子数以超过身长一半穿越方块边界线为1格,直立次数为双侧前脚离开底面为直立1次。通过观察大鼠在开场实验中穿越的格子数、直立次数和理毛次数来评价大鼠的自发活动水平,水平运动主要反映大鼠活动水平,垂直运动主要与大鼠对周围环境的好奇度相关。
1.5 Lat迷宫实验参考文献[8],实验装置为一个高40 cm、底为60 cm×60 cm的黑木箱,中间放置一个30 cm×30 cm的透明有机玻璃箱,从而在内外两箱间产生一个15 cm×60 cm×40 cm的通道,用一只冷光源(4瓦),放置在木箱上方60 cm处。实验开始时将大鼠轻轻放入通道角落,对大鼠进行30 min的观察。观察并记录大鼠穿越角落数、直立次数及斜搭次数这三项活动情况。每次每只大鼠实验结束后,清除粪便,75%无水乙醇消毒黑木箱底部和内壁,清水擦拭,并用电吹风吹干后再放入下一只大鼠进行实验。Lat迷宫原理是为大鼠提供一个视觉空间注意目标,大鼠在Lat迷宫中穿越的角落数主要反映大鼠的自发活动水平,直立次数和斜搭次数这些需要大鼠视觉空间注意目标的项目主要反映大鼠非选择性注意水平。
1.6 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组均数的比较采用两独立样本t检验,多组均数间的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
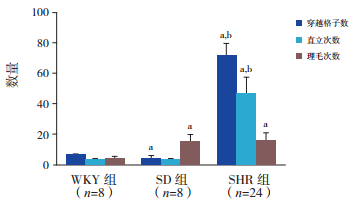
2 结果 2.1 药物干预前各组大鼠开场实验结果药物干预前:SHR穿越格子数明显多于WKY大鼠和SD大鼠;WKY大鼠穿越格子数显著多于SD大鼠(P < 0.05)。SHR直立次数明显多于WKY大鼠和SD大鼠(P < 0.05);WKY大鼠与SD大鼠相比,直立次数差异无统计学意义(P > 0.05)。SHR理毛次数明显多于WKY大鼠(P < 0.05),但与SD大鼠比较差异无统计学意义(P > 0.05);SD大鼠理毛次数明显多于WKY大鼠(P < 0.05)。见表 1,图 1。
| 表 1 各组大鼠药物干预前开场实验结果比较(x±s) |
|
|
|
图 1 各组大鼠药物干预前开场实验结果比较 a示与WKY组相比,P < 0.05;b示与SD组相比,P < 0.05。 |
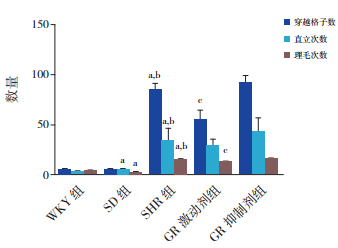
药物干预后:与SHR组比较,GR激动剂组穿越格子数明显减少(P < 0.05),GR抑制剂组穿越格子数稍增多,但差异无统计学意义(P > 0.05);SHR组穿越格子数较WKY组和SD组均有显著增高(P < 0.05);WKY组和SD组穿越格子数比较差异无统计学意义(P > 0.05)。GR激动剂组和GR抑制剂组与SHR组直立次数比较差异无统计学意义(P > 0.05);SHR组直立次数较WKY组和SD组均有显著增多(P < 0.05);SD组较WKY组直立次数明显增多(P < 0.05)。GR激动剂组与SHR组比较,理毛次数减少(P < 0.05);GR抑制剂组相较于SHR组,理毛次数无明显改变(P > 0.05);SHR组理毛次数比WKY组和SD组显著增多(P < 0.05);WKY组和SD组比较,WKY组理毛次数增多明显(P < 0.05)。见表 2,图 2。
| 表 2 各组大鼠药物干预后开场实验结果比较(x±s) |
|
|
|
图 2 各组大鼠药物干预后开场实验结果比较(n=8) a示与WKY组相比,P < 0.05;b示与SD组相比,P < 0.05;c示与SHR组相比,P < 0.05。 |
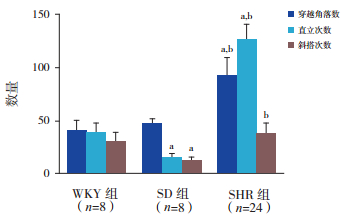
药物干预前:SHR穿越角落数显著多于WKY大鼠和SD大鼠(P < 0.05);WKY大鼠和SD大鼠穿越角落数比较差异无统计学意义(P > 0.05)。SHR直立次数较WKY大鼠和SD大鼠明显增多;且WKY大鼠较SD大鼠直立次数明显增多(P < 0.05)。SHR斜搭次数明显多于SD大鼠(P < 0.05),但其和WKY大鼠相比,差异无统计学意义(P > 0.05);和SD大鼠比较,WKY大鼠斜搭次数明显增多(P < 0.05)。见表 3,图 3。
| 表 3 各组大鼠药物干预前Lat迷宫测试结果比较(x±s) |
|
|
|
图 3 各组大鼠药物干预前Lat迷宫测试结果比较 a示与WKY组相比,P < 0.05;b示与SD组相比,P < 0.05。 |
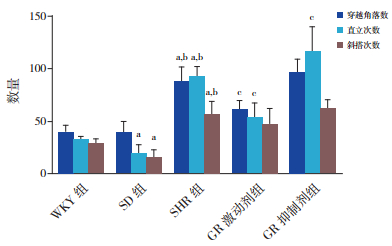
药物干预后:GR激动剂组与SHR组比较,穿越角落数显著减少(P < 0.05);GR抑制剂组穿越角落数与SHR组比较差异无统计学意义(P > 0.05);SHR组穿越角落数较WKY组和SD组均显著增高(P < 0.05);WKY组和SD组穿越角落数比较差异无统计学意义(P > 0.05)。GR激动剂组直立次数较SHR组明显减少(P < 0.05);GR抑制剂组与SHR组比较,直立次数明显增多(P < 0.05);直立次数SHR组较WKY组和SD组均有明显增多(P < 0.05);与SD组比较,WKY组直立次数明显增多(P < 0.05)。GR激动剂组和GR抑制剂组斜搭次数分别与SHR组比较,差异无统计学意义(P > 0.05);SHR组斜搭次数比WKY组和SD组均显著增多(P < 0.05);WKY组斜搭次数较SD组显著增多(P < 0.05)。见表 4,图 4。
| 表 4 各组大鼠药物干预后Lat迷宫测试结果比较(x±s) |
|
|
|
图 4 各组大鼠药物干预后Lat迷宫测试结果比较(n=8) a示与WKY组相比,P < 0.05;b示与SD组相比,P < 0.05;c示与SHR组相比,P < 0.05。 |
ADHD是一种以多动、冲动、注意力不集中为特点的常见神经精神疾病,其确切发病机制尚未阐明。约75%的患儿有一定程度的进攻和违抗行为,学习障碍和行为问题也很常见,50%的患儿上述症状会持续到青春期甚至成年[9],不仅影响患者本人及其家庭,也会阻碍社会发展。因此,尽早明确ADHD的发病机制,具有重要意义。
动物实验常被用来研究ADHD的病因、发病机制和治疗方法[10]。为了阐明ADHD确切的发病机制,研究人员使用过,包括SHR[11]、多巴胺转运体(dopamine transporter, DAT)敲除小鼠[12]、WKY/NCrl大鼠[13]等动物模型。其中SHR除了具有注意缺陷、多动、冲动这些特性外,还和ADHD患者神经生物代谢方面相似,SHR纹状体区、前额叶区、伏隔核区多巴胺释放减少[14],因此为ADHD混合型常用的模型之一;SHR是由WKY大鼠近亲交配获得的稳定品种,故WKY大鼠常被选做SHR的对照组[15]。近来某研究[16]发现WKY大鼠在水迷宫实验中存在漂浮不动现象,自主活动性较低下,并有抑郁样表现,与一般普通大鼠的生理特征不相符合,与SHR行为学差异过大,因此两者的比较缺乏客观真实性。另外SHR是近交系大鼠,而某些单位引进的WKY大鼠是非近交系大鼠,两者在基因背景方面有非常大的差异,已有研究发现不同单位提供的WKY大鼠在基因和某些生物学反应方面,如多巴胺释放和摄取等差异明显,故仅将WKY大鼠作为SHR的对照组存在一定的不足,增设SD大鼠作为SHR的另一种对照组,能够更为客观真实的反映SHR的行为学特征[13, 17]。研究提示[13],SHR是目前应用最广泛的ADHD动物模型,其很好的代表了ADHD混合型,WKY大鼠则是可作为注意力缺陷型模型,SD大鼠建议作为对照组。但前期国内很多研究并未具体探讨ADHD不同亚型的动物模型,本课题从行为学实验入手,对SHR、WKY大鼠、SD大鼠的行为学进行比较。
开场实验显示SHR穿越格子数和直立次数均较WKY大鼠、SD大鼠明显增多,理毛次数SHR较SD大鼠差异不明显,但较WKY大鼠明显增多;WKY大鼠较SD大鼠穿越格子数增多,理毛次数减少,二者直立次数无差别。Lat迷宫结果显示SHR穿越角落数和直立次数亦均较WKY大鼠、SD大鼠明显增多,斜搭次数SHR明显高于SD大鼠,但其和WKY大鼠相比,无显著差别;WKY大鼠和SD大鼠穿越角落数比较差异不大,WKY大鼠较SD大鼠直立次数和斜搭次数明显增多。以上结果提示SHR自发活动程度较WKY大鼠和SD大鼠明显,非选择性注意水平较WKY大鼠和SD大鼠缺陷,与ADHD患者混合型兼具的多动、冲动症状相符,支持SHR作为ADHD混合型的动物模型,仅用WKY大鼠作为SHR的对照组,在某些行为学方面,二者差异大,增设SD大鼠作为对照组,更能体现SHR的行为特征。WKY大鼠较SD大鼠注意缺陷症状比多动行为更明显,但其注意缺陷和多动行为兼有,尚不足以支持WKY大鼠作为ADHD注意力缺陷型的动物模型,需要更进一步的研究。
HPA轴作为神经内分泌系统的重要部分,在应激反应中起到关键作用[18]。GC是HPA轴的终产物,其通过结合到GR发挥生物学效应,GC在人类主要为皮质醇。低皮质醇可见于多种疾病,如ADHD、品行障碍、对立违抗障碍等[19]。本课题组前期研究显示,在非应激状态下,ADHD患儿的血浆皮质醇平均水平较对照组低,低血浆皮质醇与ADHD三大核心症状密切相关[20]。国外也有研究得出类似结果[21],提示ADHD患儿存在HPA轴调节异常,皮质醇水平低下可能和ADHD的核心症状相联系。此外,通过动物实验发现SHR前额区GR表达水平较WKY大鼠减少[22],以上表明GC/GR水平低下可能是HPA轴低反应性的原因之一。
本研究发现予以GR激动剂DEX干预后,开场实验SHR穿越格子数明显减少,Lat迷宫SHR穿越角落数和直立次数亦明显减少,提示GR激动剂可明显改善SHR的自主活动情况,提高SHR的非选择性注意水平;予以GR抑制剂RU486干预后,Lat迷宫SHR直立次数明显增多,支持GC能改善ADHD的核心症状,GC/GR与ADHD相关,HPA轴调节异常参与ADHD发病。予以生理盐水干预后,开场实验中WKY组较SD组理毛次数增多明显,Lat迷宫中WKY组较SD组直立次数和斜搭次数均显著增多,提示WKY大鼠和SD大鼠行为学差异明显。本课题组前期研究发现WKY大鼠予以DEX、RU486、生理盐水干预后,不同组别之间穿越格子数无明显差异,但添加DEX的组别正确反应率明显高于干预前,其他组别差异无统计学意义,提示GC对WKY大鼠的多动表现影响不大,但可影响其注意力[23]。
总之,SHR的行为学表现和ADHD混合型的临床症状相符,是可靠的ADHD混合型的动物模型,而WKY大鼠能否作为ADHD注意力缺陷型亚型的动物模型仍有待于进一步研究。GR激动剂可有效改善SHR自发活动行为和非选择性注意水平。继续深入研究GC/GR功能对ADHD的影响,对明确ADHD发病机制具有重要意义,有助于为ADHD的诊断和防治提供新思路。
| [1] |
Willcutt EG. The prevalence of DSM-IV attentiondeficit/hyperactivity disorder:a meta-analytic review[J]. Neurotherapeutics, 2012, 9(3): 490-499. DOI:10.1007/s13311-012-0135-8 (  0) 0) |
| [2] |
Polanczyk GV, Salum GA, Sugaya LS, et al. Annual research review:a meta-analysis of the worldwide prevalence of mental disorders in children and adolescents[J]. J Child Psychol Psychiatry, 2015, 56(3): 345-365. DOI:10.1111/jcpp.12381 (  0) 0) |
| [3] |
Isaksson J, Hogmark Å, Nilsson KW, et al. Effects of stimulants and atomoxetine on cortisol levels in children with ADHD[J]. Psychiatry Res, 2013, 209(3): 740-741. DOI:10.1016/j.psychres.2013.06.011 (  0) 0) |
| [4] |
陈金兰, 陈辉, 王婷婷, 等. 注意缺陷多动障碍儿童唾液与血浆皮质醇水平变化及临床意义[J]. 福建医科大学学报, 2016, 50(6): 403-406. (  0) 0) |
| [5] |
Senft RA, Meddle SL, Baugh AT. Distribution and abundance of glucocorticoid and mineralocorticoid receptors throughout the brain of the great tit (parus major)[J]. PLoS One, 2016, 11(2): e0148516. DOI:10.1371/journal.pone.0148516 (  0) 0) |
| [6] |
李春女.小剂量地塞米松预处理的抗颞叶癫痫和脑保护作用[D].长春: 吉林大学, 2013.
(  0) 0) |
| [7] |
董瑞婕, 吴爱勤. 束缚应激大鼠海马糖皮质激素受体mRNA的表达及米非司酮的干预作用[J]. 中国神经精神疾病杂志, 2009, 35(3): 175-178. DOI:10.3969/j.issn.1002-0152.2009.03.014 (  0) 0) |
| [8] |
池霞, 郭锡熔, 陈荣华, 等. 注意缺陷障碍动物模型的行为学特征检测[J]. 中国组织工程研究, 2006, 10(38): 68-70. DOI:10.3321/j.issn:1673-8225.2006.38.026 (  0) 0) |
| [9] |
Rezaei G, Hosseini SA, Akbari Sari A, et al. Comparative efficacy of methylphenidate and atomoxetine in the treatment of attention deficit hyperactivity disorder in children and adolescents:a systematic review and meta-analysis[J]. Med J Islam Repub Iran, 2016, 30: 325. (  0) 0) |
| [10] |
Carvalho C, Vieira Crespo M, Ferreira Bastos L, et al. Contribution of animal models to contemporary understanding of Attention Deficit Hyperactivity Disorder[J]. ALTEX, 2016, 33(3): 243-249. (  0) 0) |
| [11] |
Somkuwar SS, Jordan CJ, Kantak KM, et al. Adolescent atomoxetine treatment in a rodent model of ADHD:effects on cocaine self-administration and dopamine transporters in frontostriatal regions[J]. Neuropsychopharmacology, 2013, 38(13): 2588-2597. DOI:10.1038/npp.2013.163 (  0) 0) |
| [12] |
Fox MA, Panessiti MG, Hall FS, et al. An evaluation of the serotonin system and perseverative, compulsive, stereotypical, and hyperactive behaviors in dopamine transporter (DAT) knockout mice[J]. Psychopharmacology (Berl), 2013, 227(4): 685-695. DOI:10.1007/s00213-013-2988-x (  0) 0) |
| [13] |
Miller EM, Pomerleau F, Huettl P, et al. The spontaneously hypertensive and Wistar Kyoto rat models of ADHD exhibit sub-regional differences in dopamine release and uptake in the striatum and nucleus accumbens[J]. Neuropharmacology, 2012, 63(8): 1327-1334. DOI:10.1016/j.neuropharm.2012.08.020 (  0) 0) |
| [14] |
郑小兰, 陈燕惠. 注意缺陷多动障碍的实验动物模型[J]. 中华行为医学与脑科学杂志, 2015, 24(3): 276-279. DOI:10.3760/cma.j.issn.1674-6554.2015.03.025 (  0) 0) |
| [15] |
Banegas I, Prieto I, Segarra AB, et al. Bilateral distribution of enkephalinase activity in the medial prefrontal cortex differs between WKY and SHR rats unilaterally lesioned with 6-hydroxydopamine[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2017, 75: 213-218. DOI:10.1016/j.pnpbp.2017.02.015 (  0) 0) |
| [16] |
周荣易, 王娇娇, 韩新民. SHR、WKY大鼠与SD大鼠注意缺陷多动障碍模型行为学特征的比较[J]. 中国实验动物学报, 2017, 25(4): 380-385. DOI:10.3969/j.issn.1005-4847.2017.04.007 (  0) 0) |
| [17] |
曹爱华, 张昕婷, 于琳, 等. SHR/WKY/SD大鼠的行为学特征研究[J]. 中国儿童保健杂志, 2013, 21(7): 704-707. (  0) 0) |
| [18] |
King LS, Colich NL, LeMoult J, et al. The impact of the severity of early life stress on diurnal cortisol:the role of puberty[J]. Psychoneuroendocrinology, 2017, 77: 68-74. DOI:10.1016/j.psyneuen.2016.11.024 (  0) 0) |
| [19] |
Isaksson J, Allen M, Nilsson KW, et al. Polymorphisms in the FK506 binding protein 5 gene are associated with attention deficit hyperactivity disorder and diurnal cortisol levels[J]. Acta Paediatr, 2015, 104(9): 910-915. DOI:10.1111/apa.2015.104.issue-9 (  0) 0) |
| [20] |
Ma L, Chen YH, Chen H, et al. The function of hypothalamuspituitary-adrenal axis in children with ADHD[J]. Brain Res, 2011, 1368: 159-162. DOI:10.1016/j.brainres.2010.10.045 (  0) 0) |
| [21] |
Isaksson J, Nilsson KW, Nyberg F, et al. Cortisol levels in children with attention-deficit/hyperactivity disorder[J]. J Psychiatr Res, 2012, 46(11): 1398-1405. DOI:10.1016/j.jpsychires.2012.08.021 (  0) 0) |
| [22] |
黄靓.糖皮质激素受体功能对ADHD大鼠中枢5-HT系统的影响[D].福州: 福建医科大学, 2016.
(  0) 0) |
| [23] |
郑小兰.糖皮质激素受体功能对ADHD大鼠多巴胺能神经递质的影响[D].福州: 福建医科大学, 2015.
(  0) 0) |
 2018, Vol. 20
2018, Vol. 20


