气道炎症和气道重塑是支气管哮喘(简称哮喘)的两个主要病理学特征[1],但目前国内外的哮喘诊治方案[2-3]均强调对气道炎症的控制,较少关注气道重塑。目前常用于治疗哮喘的控制药物,如糖皮质激素、长效β2受体激动剂对气道重塑的治疗作用有限[4-5],而且存在不同程度的不良反应。有研究显示,仅应用10 d糖皮质激素干预的哮喘小鼠,其胸腺明显较正常对照组小,提示糖皮质激素对哮喘小鼠有中枢抑制作用[6];也有研究显示,哮喘大鼠的夜间死亡原因可能与长效β受体激动剂的副作用有关[7]。
目前已知,转化生长因子-β(transforming growth factor β, TGF-β)与Smad蛋白家族在气道重塑中起重要的调控作用[8-10]。半胱氨酰白三烯(cysteinyl leukotrienes, CysLTs)参与了哮喘的包括气道重塑在内的多个病理生理进程[11],孟鲁司特钠(montelukast, MK)是CysLTs受体拮抗剂,在哮喘的治疗中主要通过阻断CysLTs的活性而发挥作用[12]。细菌溶解产物(broncho-vaxom, OM-85BV)是临床上常用的免疫调节剂[13],已有研究证实OM-85BV可影响TGF-β的表达[6]。为探讨MK和(或)OM-85BV干预后,哮喘气道重塑的变化及对TGF-β1与Smad7的影响,为临床更好地防控哮喘提供实验室依据,本课题组进行了以下的实验,现报道如下。
1 材料与方法 1.1 实验动物SPF级Hartley雄性豚鼠40只,4~6周龄,体重300±50 g,由广州中医药大学实验动物中心提供(广东省实验动物质量合格证明号码:44005900002663;广东省动物实验证明号码:00175071),饲养于层流实验室,喂养动物专用饲料,饮用动物专用水。
1.2 主要实验仪器与试剂主要实验仪器包括:空气压缩雾化器(PARIBOYN038,德国百瑞公司);LEICA RM2015型切片机(德国莱卡设备有限公司);奥特BK-DM500型数码显微镜(重庆奥特光学设备有限公司);Image-pro plus 6.0图像分析系统(美国Media Cybernetics公司);DZF-6030A型恒温箱(上海一恒有限公司)、SM800型全自动酶标仪(上海永创医疗器械有限公司)。
主要试剂包括:MK颗粒(规格:4 mg/包)购自杭州默沙东制药有限公司;OM-85BV胶囊(规格:3.5 mg/胶囊)购自瑞士OM Pharma SA公司;卵清蛋白(ovalbumin, OVA)购自美国Sigma公司;TGF-β1、Smad7试剂盒均购自上海晨易生物科技有限公司。
1.3 模型的建立及药物干预方法将40只SPF级Hartley雄性豚鼠按照随机数字表法分为正常对照组、哮喘组、MK组、OM-85BV组、MK+OM-85BV组,每组8只。
除正常对照组外,其余4组依据Ohki等[14]方案制作哮喘豚鼠气道重塑模型。造模过程分为致敏阶段和激发阶段,共8周。方法如下:取OVA 10 g和免疫佐剂氢氧化铝10 g,加0.9%氯化钠注射液定容至100 mL,制备成浓度为10% OVA生理盐水溶液,取1 mL在豚鼠腹腔内注射,分别在第0天和第14天两次致敏。第2次致敏后开始采用1% OVA激发,前5周为每周2次,每次10 min,每次间隔2 d;后1周为每周1次,每次10 min。
药物干预在激发阶段每日1次,共6周。若当天有激发,激发前30 min分别给予对应的药物干预措施,MK和OM-85BV剂量分别参照白建文等[15]和Bessler等[16]方案,MK组采用MK(1.5 mg/mL)灌胃,OM-85BV组采用OM-85BV(0.175 mg/mL)灌胃,MK+OM-85BV组采用MK(1.5 mg/mL)联合OM-85BV(0.175 mg/mL)灌胃,剂量均为1 mL/100 g体重;若当天无激发,在对应的时间也分别给予上述干预措施。正常对照组和哮喘组在激发阶段用0.9%氯化钠注射液灌胃,剂量为1 mL/100 g。
1.4 标本制备及检测5组豚鼠于实验8周后的24 h内按照动物实验伦理要求处死。豚鼠经开胸、暴露气管,将导管插入气管内,用线打结固定后,连接注射器,缓慢推入0.4 mL的0.9%氯化钠注射液,反复3次,获取支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)约1 mL,将BALF以1 000 r/min的速度离心10 min,取上清液,置-20℃冰箱内存储备用;用ELISA法测定BALF中TGF-β1、Smad7含量。
每只豚鼠取左侧肺组织,将其固定、石蜡包埋及切片后进行苏木精-伊红(hematoxylin-eosinstaining, HE)染色,用生物数码显微镜观察肺组织病理变化;Image-pro plus 6.0图像分析系统测定肺内支气管基底膜周径(Pbm)、总管壁面积(Wat)及平滑肌面积(Wam);取胸腺并称重,同时计算该豚鼠胸腺重量占其目前体重的百分比。
1.5 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;采用Pearson相关对两变量的相关情况进行分析。P < 0.05为差异有统计学意义。
2 结果 2.1 各组豚鼠实验各阶段的一般情况观察及特点除正常对照组外,其余4组豚鼠在OVA致敏阶段能饮食、活动、大小便均正常,各组无明显差异。在OVA激发过程中,上述4组豚鼠精神明显转差,出现挣扎、烦躁不安、点头运动、呼吸频率增快、张口呼吸、腹部肌肉痉挛、擦鼻、打喷嚏、挠腮抓耳、口唇及爪不同程度紫绀、大小便明显增多等症状;MK组、OM-85BV组、MK+OM-85BV组豚鼠在激发过程中上述症状较哮喘组轻。每次激发结束后10 min左右,4组豚鼠上述症状均可自行缓解;缓解后肉眼观察,各组症状无明显差异。激发间歇期,哮喘组豚鼠与MK组、OM-85BV组、MK+OM-85BV组豚鼠比较,毛发明显失去光泽,外界轻微刺激即可引起烦躁不安。
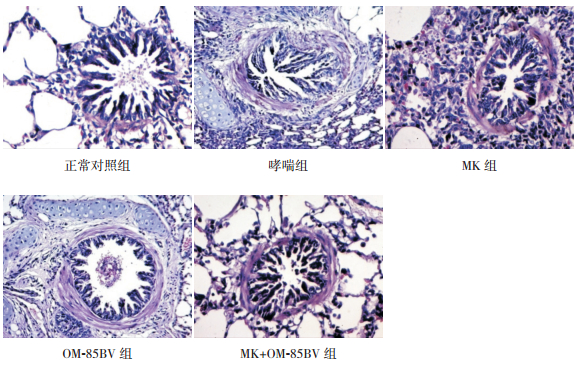
2.2 光镜下各组豚鼠肺组织病理形态学改变正常对照组支气管上皮结构完整,黏膜层、黏膜下层及外膜层层次清楚,支气管平滑肌分布均匀未见增厚,肺泡腔内无明显炎性分泌物,支气管及血管周围未见明显炎性细胞浸润;哮喘组与正常对照组相比,支气管上皮结构紊乱,黏膜上皮细胞明显减少,黏膜水肿明显,支气管平滑肌显著增厚,肺泡内有大量炎性分泌物,黏膜层、黏膜下层及血管周围有明显炎性细胞浸润;MK组、OM-85BV组及MK+OM-85BV组与哮喘组相比,经药物干预后,支气管病理损伤程度有明显改善,其中以MK+OM-85BV组改善最为明显。见图 1。
|
图 1 各组豚鼠肺组织病理切片(苏木精-伊红染色,×200) 正常对照组支气管管壁未见增厚,气道黏膜完整,无明显的炎性细胞浸润。哮喘组支气管管腔变窄,支气管管壁和肺泡壁明显增厚,支气管黏膜水肿明显、部分明显增生,管壁中和肺泡中可见明显的嗜酸性粒细胞浸润。MK组肺泡壁部分增厚,支气管管壁及肺泡壁中可见嗜酸性粒细胞浸润。OM-85BV组支气管管壁和肺泡壁少许增厚,支气管管壁中可见少量嗜酸性粒细胞浸润,肺泡中未见明显炎性细胞浸润。MK+OM-85BV组肺泡壁未见增厚,支气管黏膜层可见少量嗜酸性粒细胞浸润,肺泡壁和肺泡中未见炎性细胞浸润。 |
各组豚鼠用Pbm对Wat、Wam进行标准化,得出标准化支气管总管壁面积(Wat/Pbm)及标准化支气管平滑肌面积(Wam/Pbm)。
与正常对照组比较,其余4组Wat/Pbm和Wam/Pbm均增高(P < 0.05);与哮喘组比较,MK组、OM-85BV组和MK+OM-85BV组Wat/Pbm和Wam/Pbm均降低(P < 0.05);MK组、OM-85BV组和MK+OM-85BV组之间Wat/Pbm比较差异无统计学意义(P > 0.05);MK组和OM-85BV组之间Wam/Pbm比较差异无统计学意义(P > 0.05),但均高于MK+OM-85BV组(P < 0.05)。见表 1。
| 表 1 各组豚鼠Wat/Pbm及Wam/Pbm比较 (x±s,μm) |
|
|
各组豚鼠胸腺重量占其体重百分比比较差异无统计学意义(P > 0.05)。见表 2。
| 表 2 各组豚鼠胸腺重量占其体重百分比的比较(x±s,%) |
|
|
与正常对照组比较,其余4组TGF-β1表达水平均增高,Smad7表达水平均降低(均P < 0.01);与哮喘组比较,MK组、OM-85BV组和MK+OM-85BV组TGF-β1表达水平均降低,Smad7表达水平均增高(均P < 0.01);MK组和OM-85BV组之间TGF-β1表达水平比较差异无统计学意义(P > 0.05),但均高于MK+OM-85BV组(均P < 0.01);MK组和OM-85BV组之间Smad7表达水平比较差异无统计学意义(P > 0.05),但均低于MK+OM-85BV组(均P < 0.01)。见表 3。
| 表 3 各组豚鼠BALF中TGF-β1和Smad7表达水平比较 (x±s,ng/mL) |
|
|
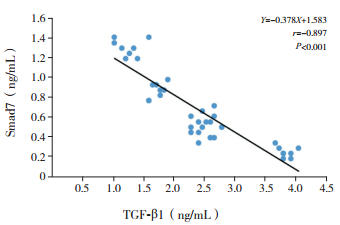
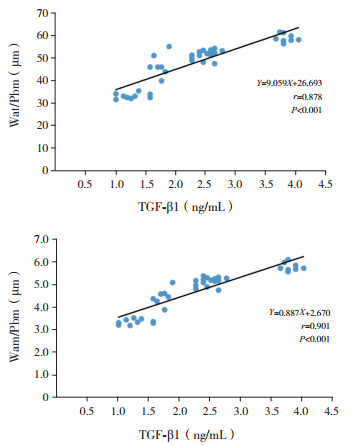
TGF-β1与Smad7表达水平呈负相关(r=-0.897,P < 0.001)。TGF-β1表达水平分别与Wat/Pbm及Wam/Pbm呈正相关(分别r=0.878、0.901,P < 0.001);Smad7表达水平分别与Wat/Pbm及Wam/Pbm呈负相关(分别r=-0.910、-0.929,P < 0.001)。见图 2~4。
|
图 2 TGF-β1与Smad7的相关性分析 |
|
图 3 TGF-β1与Wat/Pbm及Wam/Pbm的相关性分析 |

|
图 4 Smad7与Wat/Pbm及Wam/Pbm的相关性分析 |
气道平滑肌增厚等病理学表现是哮喘气道重塑的一个重要特征[17]。本课题组应用OVA作为致敏原制作豚鼠气道重塑模型,肺组织病理形态学结果显示,哮喘组、MK组、OM-85BV组及MK+OM-85BV组豚鼠支气管平滑肌、肺泡壁均较正常对照组明显增厚;且Wat/Pbm和Wam/Pbm均显示较正常对照组明显增大,表明豚鼠哮喘气道重塑模型已成功制作。
TGF-β是一种促纤维化的细胞因子,能诱导分化、炎症、增生和凋亡等多种反应,并可通过TGF-β/Smad信号转导通路促进平滑肌增生,从而促进气道重塑的发生发展[18]。TGF-β1是TGF-β家族中的一员;Smad7蛋白是一种抑制型Smad蛋白,在TGF-β/Smad信号转导通路中主要起负反馈抑制作用[19]。本实验发现,TGF-β1水平上升或Smad7水平下降时,Wat/Pbm和Wam/Pbm也同时增大,且两者之间具有相关性,这提示哮喘气道重塑时,存在TGF-β1和Smad7表达水平失衡的情况。
MK治疗哮喘的安全性和有效性已经得到公认[2-3, 12]。已有研究表明,MK可用来治疗包括哮喘在内的嗜酸性粒细胞紊乱性疾病[20]。Hosoki等[21]研究表明,MK可以阻断嗜酸性粒细胞诱导的上皮-间充质营养单位再活化,从而来改善气道重塑,其机制可能与降低了TGF-β1和磷酸化Smad3的水平有关。Shin等[22]使用OVA诱导的小鼠哮喘模型,评估MK拮抗气道炎症和气道纤维化的作用,研究发现,MK通过减少Th2细胞因子的释放和血管内皮生长因子、TGF-β/Smad在肺组织中的表达来抑制气道炎症和肺纤维化。OM-85BV是临床上常用的免疫调节剂,能显著降低学龄前儿童急性喘息发作,其机理在于减轻炎症反应,调节Th1/Th2的免疫功能[23-25],还能影响TGF-β的水平[6, 26-27],且不影响哮喘动物模型胸腺大小,即对中枢免疫无抑制作用[6]。OM-85BV在临床上进行免疫治疗,根据药品说明书:如应用于预防和/或巩固治疗,需每月连用10 d,连续使用3个月为一疗程;而应用于急性期的治疗可连续服用,直至症状消失,但至少要用10 d。本研究考虑,哮喘气道重塑的其中一个重要因素是慢性气道炎症,因此考虑应用OM-85BV抑制气道炎症需要一个连续性的治疗,从而防治气道重塑的发生发展,因此使用了连续应用的干预方案。本研究发现,在MK和(或)OM-85BV干预下,虽然还不能恢复至正常对照组水平,这与李丽等[11]的研究结果一致;但与哮喘组比较,抑制了TGF-β1水平,提升了Smad7水平,减轻了气道的病理损害,改善了气道平滑肌增厚现象;从各组胸腺占体重的百分比比较结果显示,各组之间无明显差异,推测MK和OM-85BV对中枢免疫器官均无明显影响。
本研究发现,MK或OM-85BV干预下,Wat/Pbm、Wam/Pbm等气道重塑客观指标以及TGF-β1和Smad7表达水平失衡等情况都得到了改善,但两种干预方法比较均无显著差异,推测两者均能调节Th1/Th2的免疫功能,从而改善气道炎症,进而减轻气道重塑现象,但哮喘是一个慢性炎症过程,OM-85BV能否长时间应用,这需要进一步的实验观察。有研究证实了OM-85BV能够选择性地增强Th1细胞的功能,影响细胞因子的分泌,如Th1分泌的γ-干扰素升高,Th2分泌的白介素-4降低,从而调节Th1/Th2细胞表达比值的偏移向Th1方向移动[28]。因此,OM-85BV可以协助MK更好地发挥作用,取得更好的疗效。本研究也发现,MK+OM-85BV组对气道重塑的改善好于单药干预组(MK组、OM-85BV组)。
本实验证实了TGF-β1和Smad7表达失衡可能促进了气道重塑的发生发展,而MK和(或)OM-85BV的干预对TGF-β/Smad信号转导通路产生了影响,可显著降低TGF-β1和提高Smad7水平,从而有效控制气道重塑,而且MK联合OM-85BV干预效果最好。鉴于MK和OM-85BV的安全性高、不良反应少等优点,有望在防治哮喘气道重塑中发挥重要的作用。
| [1] |
Trevor JL, Chipps BE. Severe asthma in primary care:identification and management[J]. Am J Med, 2018, 131(5): 484-491. DOI:10.1016/j.amjmed.2017.12.034 (  0) 0) |
| [2] |
中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 (  0) 0) |
| [3] |
The GINA Board of Directors, The GINA Science Committee. 2018 GINA report, global strategy for asthma management and prevention[EB/OL]. (2018-03-06). http://ginasthma.org/2018-gina-report-global-strategy-for-asthma-management-and-prevention.
(  0) 0) |
| [4] |
Matsumoto H. Serum periostin:a novel biomarker for asthma management[J]. Allergol Int, 2014, 63(2): 153-160. DOI:10.2332/allergolint.13-RAI-0678 (  0) 0) |
| [5] |
Carlstrom L, Castro M. Severe asthma:what makes it so hard to manage?[J]. Curr Allergy Asthma Rep, 2009, 9(5): 393-400. DOI:10.1007/s11882-009-0057-7 (  0) 0) |
| [6] |
刘静, 周小建, 洪建国. 细菌溶解产物对支气管哮喘小鼠TGF-β1及Foxp3表达的影响[J]. 国际呼吸杂志, 2014, 34(19): 1441-1446. DOI:10.3760/cma.j.issn.1673-436X.2014.19.001 (  0) 0) |
| [7] |
贺孝良, 李昌崇, 张维溪, 等. TGF-β1和Smad6在哮喘大鼠气道重塑中的表达及福莫特罗的影响[J]. 浙江医学, 2010, 32(3): 323-326. DOI:10.3969/j.issn.1006-2785.2010.03.008 (  0) 0) |
| [8] |
Lee HY, Kim IK, Yoon HK, et al. Inhibitory effects of resveratrol on airway remodeling by transforming growth factor-β/Smad signaling pathway in chronic asthma model[J]. Allergy Asthma Immunol Res, 2017, 9(1): 25-34. DOI:10.4168/aair.2017.9.1.25 (  0) 0) |
| [9] |
Groneberg DA, Witt H, Adcock IM, et al. Smads as intracellular mediators of airway inflammation[J]. Exp Lung Res, 2004, 30(3): 223-250. DOI:10.1080/01902140490276320 (  0) 0) |
| [10] |
Nakao A, Sagara H, Setoguchi Y, et al. Expression of Smad7 in bronchial epithelial cells is inversely correlated to basement membrane thickness and airway hyperresponsiveness in patients with asthma[J]. J Allergy Clin Immuno, 2002, 110(6): 873-878. DOI:10.1067/mai.2002.129236 (  0) 0) |
| [11] |
李丽, 娄春艳, 李敏, 等. 孟鲁司特钠对哮喘小鼠气道重塑及Th17/CD4+CD25+ Treg表达的影响[J]. 中国当代儿科杂志, 2016, 18(11): 1174-1180. DOI:10.7499/j.issn.1008-8830.2016.11.023 (  0) 0) |
| [12] |
中华医学会儿科学分会呼吸学组. 白三烯受体拮抗剂在儿童常见呼吸系统疾病中的临床应用专家共识[J]. 中华实用儿科临床杂志, 2016, 31(13): 973-977. DOI:10.3760/cma.j.issn.2095-428X.2016.13.004 (  0) 0) |
| [13] |
王晓川, 申昆玲. 反复呼吸道感染临床诊治路径[J]. 中国实用儿科杂志, 2016, 31(10): 721-725. (  0) 0) |
| [14] |
Ohki Y, Tokuyama K, Sato A, et al. Maturational changes in airway remodeling after chronic exposure to ovalbumin in sensitized guinea pigs:role of cell renewal of airway resident cells[J]. Pediatr Res, 2002, 52(4): 525-532. DOI:10.1203/00006450-200210000-00011 (  0) 0) |
| [15] |
白建文, 邓伟吾, 吴华成. 孟鲁司特对气道重塑及白细胞介素类与转移生长因子β2 mRNA表达的影响[J]. 中华结核和呼吸杂志, 2004, 27(8): 524-528. DOI:10.3760/j:issn:1001-0939.2004.08.006 (  0) 0) |
| [16] |
Bessler WG, Vor dem Esche U, Masihi N. The bacterial extract OM-85BV protects mice against influenza and Salmonella infection[J]. Int Immunopharmacol, 2010, 10(9): 1086-1090. DOI:10.1016/j.intimp.2010.06.009 (  0) 0) |
| [17] |
娄春艳, 李敏, 李丽. 哮喘小鼠气道重塑过程中CD4+CD25+调节性T细胞和Th17细胞表达的动态变化[J]. 中国当代儿科杂志, 2015, 17(9): 994-1000. (  0) 0) |
| [18] |
Cho JY. Recent advances in mechanisms and treatments of airway remodeling in asthma:a message from the bench side to the clinic[J]. Korean J Intern Med, 2011, 26(4): 367-383. DOI:10.3904/kjim.2011.26.4.367 (  0) 0) |
| [19] |
李涛, 黄茂. 转化生长因子β在支气管哮喘气道平滑肌重塑中的作用[J]. 中华哮喘杂志(电子版), 2010, 4(1): 60-63. DOI:10.3969/j.issn.1674-3911.2010.01.014 (  0) 0) |
| [20] |
Thompson-Souza GA, Gropillo I, Neves JS. Cysteinyl leukotrienes in eosinophil biology:functional roles and therapeutic perspectives in eosinophilic disorders[J]. Front Med (Lausanne), 2017, 4: 106. (  0) 0) |
| [21] |
Hosoki K, Kainuma K, Toda M, et al. Montelukast suppresses epithelial to mesenchymal transition of bronchial epithelial cells induced by eosinophils[J]. Biochem Biophys Res Commun, 2014, 449(3): 351-356. DOI:10.1016/j.bbrc.2014.05.033 (  0) 0) |
| [22] |
Shin IS, Jeon WY, Shin HK, et al. Effects of montelukast on subepithelial/peribronchial fibrosis in a murine model of ovalbumin induced chronic asthma[J]. Int Immunopharmacol, 2013, 17(3): 867-873. DOI:10.1016/j.intimp.2013.09.017 (  0) 0) |
| [23] |
Han RF, Li HY, Wang JW, et al. Study on clinical effect and immunologic mechanism of infants capillary bronchitis secondary bronchial asthma treated with bacterial lysates Broncho-Vaxom[J]. Eur Rev Med Pharmacol Sci, 2016, 20(10): 2151-2155. (  0) 0) |
| [24] |
Fu R, Li J, Zhong H, et al. Broncho-Vaxom attenuates allergic airway inflammation by restoring GSK3β-related T regulatory cell insufficiency[J]. PLoS One, 2014, 9(3): e92912. DOI:10.1371/journal.pone.0092912 (  0) 0) |
| [25] |
Kearney SC, Dziekiewicz M, Feleszko W. Immunoregulatory and immunostimulatory responses of bacterial lysates in respiratory infections and asthma[J]. Ann Allergy Asthma Immunol, 2015, 114(5): 364-369. DOI:10.1016/j.anai.2015.02.008 (  0) 0) |
| [26] |
Alyanakian MA, Grela F, Aumeunier A, et al. Transforming growth factor-beta and natural killer T-cells are involved in the protective effect of a bacterial extract on type 1 diabetes[J]. Diabetes, 2006, 55(1): 179-185. (  0) 0) |
| [27] |
Polla BS, Baladi S, Fuller K, et al. Presence of hsp65 in bacterial extracts (OM-89):a possible mediator of orally-induced tolerance?[J]. Experientia, 1995, 51(8): 775-779. DOI:10.1007/BF01922429 (  0) 0) |
| [28] |
Bowman LM, Holt PG. Selective enhancement of systemic Th1 immunity in immunologically immature rats with an orally administered bacterial extract[J]. Infect Immun, 2001, 69(6): 3719-3727. DOI:10.1128/IAI.69.6.3719-3727.2001 (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


