2. 华中科技大学同济医学院附属武汉儿童医院检验科, 湖北 武汉 430016
宫内发育迟缓(intrauterine growth retardation, IUGR)不仅影响胎儿的生长发育和出生体重,还对机体代谢内分泌产生深远影响。研究发现低出生体重与成年期肥胖、2型糖尿病、高血压、动脉粥样硬化等疾病密切相关[1-3]。Barker[4]提出“胎儿源性成人疾病”学说,即这类疾病的核心是胰岛素抵抗。研究发现IUGR新生儿在儿童和青少年时期血糖和胰岛素水平增高,存在胰岛素抵抗[5]。IUGR导致胰岛素抵抗的机制尚未明确,Lucas提出的“营养程序化”学说对其可能的发病机制进行了阐释[6]。IUGR新生儿期即可表现出一定的胰岛素抵抗趋势,而新生儿期胰岛素敏感性的改变是营养程序化学说的最直接体现[7]。脂联素是脂肪细胞因子,可改善胰岛素敏感性,参与胰岛素抵抗的调控过程。本研究对IUGR新生儿的糖和脂肪代谢、胰岛素、血清脂联素水平进行研究,探讨IUGR对新生儿期胰岛素敏感性以及脂联素水平的影响。
1 资料与方法 1.1 研究对象选择2014年10月至2017年6月在武汉儿童医院新生儿科住院的足月新生儿进行分析,按出生体重分为IUGR组和非IUGR组。两组新生儿疾病分布差异无统计学意义,见表 1。参考中国15城市不同胎龄新生儿出生体重[8],IUGR诊断标准为出生体重在同胎龄儿平均体重第10百分位以下,或低于平均体重2个标准差;非IUGR出生体重在同胎龄出生体重第10~90百分位的适于胎龄儿。纳入标准:(1)日龄 < 1 d、单胎,无窒息史;(2)生命体征及内环境稳定;(3)母亲孕期定期产检,资料完整。排除标准:(1)合并遗传代谢内分泌疾病及染色体病;(2)合并脓毒症、肝肾功能损害;(3)呼吸困难、心力衰竭、休克等危急重症状态;(4)生后7天未达到全胃肠内营养,仍需静脉营养治疗;(5)母亲患糖尿病、甲状腺功能异常、孕晚期感染、肝炎、贫血、妊娠高血压综合征。最后IUGR组82例,非IUGR组90例。收集临床资料,包括研究对象的性别、出生胎龄、出生体重、身长、头围、腹围、出生有无窒息等;母亲年龄、产检情况以及有无胎膜早破和疾病史。患儿出生后24 h内的体格测量经培训后的医务人员进行,体重精确到0.1 kg、身长精确到0.1 cm。
| 表 1 两组新生儿所患疾病情况[例(%)] |
|
|
本研究获得医院伦理委员会批准,以及研究对象监护人的知情同意。
1.2 血糖、血脂、胰岛素、脂联素检测所有新生儿于生后第7天空腹抽取股静脉血4 mL,取2 mL全血于1 h内采用ROCHE全自动生化分析仪COBAS 8000(湖北嘉信隆科技提供)测定空腹血糖(fasting serum glucose, FG)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein, HDL)和低密度脂蛋白(low-density lipoprotein, LDL)。另2mL静脉血于4℃离心(2 400 g/min)15 min,分离血清,-80℃保存待用。采用化学发光免疫法(SIEMENS胰岛素测定试剂盒)测定血清胰岛素(insulin, INS),并计算胰岛素敏感指数(insulin sensitive index, ISI)和胰岛素抵抗指数(homeostasis model assessment-insulin resistance, HOMA-IR)。血清脂联素采用酶联免疫吸附法(ELISA)测定,试剂盒由美国Phoenix公司生产。
ISI=ln [1/(空腹胰岛素×空腹血糖)]。
HOMA-IR=空腹胰岛素×空腹血糖/22.5。
1.3 统计学分析采用SPSS 21.0进行数据处理。计量资料以均数±标准差(x±s)表示,组间比较采用两独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验。影响因素分析采用Pearson相关分析和多元线性回归分析。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料分析IUGR组和非IUGR组的出生胎龄、性别和出生方式的差异无统计学意义(P > 0.05)。见表 2。
| 表 2 两组新生儿一般情况比较 |
|
|
与非IUGR组比较,IUGR组体重、身长、头围、腹围和体重/身长比均较低,差异有统计学意义(P < 0.05)。见表 3。
| 表 3 两组新生儿体格发育指标比较 (x±s) |
|
|
IUGR组胰岛素水平较非IUGR组增高(P < 0.05),两组FG、TG、LDL和HDL的差异无统计学意义(P > 0.05)。见表 4。
| 表 4 两组新生儿糖、脂代谢指标比较 (x±s) |
|
|
与非IUGR组比较,IUGR组的血清脂联素水平、ISI较低,HOMA-IR较高,差异均有统计学意义(P < 0.05)。见表 5。
| 表 5 两组新生儿胰岛素敏感性、血清脂联素水平比较 (x±s) |
|
|
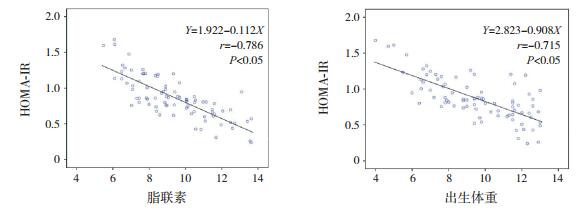
HOMA-IR与脂联素、出生体重均呈负相关(r=-0.786、-0.715,P < 0.05)。见图 1。以HOMA-IR为因变量,以脂联素、出生体重、体重/身长比、胎龄、TG、LDL和HDL为自变量,进行多元线性回归分析,脂联素和出生体重是HOMA-IR的独立影响因素(P < 0.05),呈负相关。见表 6。
|
图 1 HOMA-IR与脂联素、出生体重的相关性 [HOMA-IR]胰岛素抵抗指数。 |
| 表 6 胰岛素抵抗指数影响因素的多元线性回归分析 |
|
|
宫内营养环境不良不仅可导致胎儿宫内发育迟缓和出生低体重,而且对胎儿的代谢模式也可产生影响[9]。这种对代谢方式的影响甚至延续至成年时期,导致代谢综合征的发生。节俭表型假说提出为适应宫内不良营养环境,胎儿胰岛β细胞数量减少、功能改变,外周组织胰岛素敏感性降低,以防御低血糖的发生,保证重要脏器如脑、肺的能量供应[10]。这种代谢的改变被“程序化”,增加生后胰岛素抵抗和代谢综合征的发生[6, 11]。高胰岛素正血糖钳夹技术是评价胰岛素抵抗的金标准,但费用昂贵、耗费时间长且需多次抽血,在临床特别是儿科难以开展,实际工作中常以HOMA-IR增高和/或ISI降低评估胰岛素抵抗[12]。本研究在新生儿出生后第7天进行血糖、血脂、血浆脂联素、胰岛素水平检测,并计算HOMA-IR和ISI,避免了日龄跨度大及追赶生长、喂养方式等因素的影响,而且生后第7天基本达到全胃肠内营养。结果表明,IUGR与非IUGR新生儿的FG、TG、LDH和HDL差异无统计学意义,但IUGR新生儿的胰岛素水平上升,HOMA-IR增高、ISI降低,提示宫内发育迟缓虽然对新生儿糖及脂肪水平未产生明显影响,但已经体现出一定程度的胰岛素敏感性改变。这与Yada等[13]的研究一致。进一步多元线性回归分析也显示出生体重是HOMA-IR的影响因素,二者呈负相关。
脂联素是脂肪组织分泌的一种蛋白质,有增加胰岛素敏感性的功能,可防止胰岛素抵抗发生,是近几年研究的热点脂肪细胞因子[14]。国外学者[15-16]研究证明,IUGR新生儿血清脂联素水平下降,HOMA-IR值升高。本研究IUGR新生儿血清脂联素水平较低,脂联素水平与HOMA-IR呈负相关。与文献一致。
综上所述,IUGR新生儿血糖、血脂水平虽无明显改变,但胰岛素敏感性已经有下降趋势,脂联素水平与HOMA-IR呈负相关,但IUGR对胰岛素敏感性调节的具体机制还有待进一步研究。
| [1] |
Crume TL, Scherzinger A, Stamm E, et al. The long-term impact of intrauterine growth restriction in a diverse U.S. cohort of children:the EPOCH Study[J]. Obesity, 2014, 22(2): 608-615. DOI:10.1002/oby.20565 (  0) 0) |
| [2] |
Salam RA, Das JK, Bhutta ZA. Impact of intrauterine growth restriction on long-term health[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(3): 249-254. DOI:10.1097/MCO.0000000000000051 (  0) 0) |
| [3] |
Jornayvaz FR, Vollenweider P, Bochud M, et al. Low birth weight leads to obesity, diabetes and increased leptin levels in adults:the Colaus study[J]. Cardiovasc Diabetol, 2016, 15: 73. DOI:10.1186/s12933-016-0389-2 (  0) 0) |
| [4] |
Barker DJ, Osmond C. Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales[J]. Lancet, 1986, 1(8489): 1077-1081. (  0) 0) |
| [5] |
Gupta M, Gupta R, Pareek A, et al. Low birth weight and insulin resistance in mid and late childhood[J]. Indian Pediatr, 2007, 3(44): 177-184. (  0) 0) |
| [6] |
Lucas A. Programming by early nutrition in man[J]. Ciba Found Symp, 1991, 156: 38-50. (  0) 0) |
| [7] |
Simental-Mendia LE, Castañeda-Chacón A, Rodríguez-Morán M, et al. Birth-weight, insulin levels, and HOMA-IR in newborns at term[J]. BMC Pediatr, 2012, 12: 94. (  0) 0) |
| [8] |
胡亚美, 江载芳, 申昆玲. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版, 2014, 44-45.
(  0) 0) |
| [9] |
郑锐丹, 汪无尽, 应艳琴, 等. 生长追赶宫内发育迟缓大鼠早期糖脂代谢及脂肪细胞功能的改变[J]. 中国当代儿科杂志, 2012, 14(07): 543-547. (  0) 0) |
| [10] |
Hales CN, Barker DJ. The thrifty phenotype hypothesis[J]. Br Med Bull, 2001, 60(1): 5-20. DOI:10.1093/bmb/60.1.5 (  0) 0) |
| [11] |
Rytter D, Bech BH, Frydenberq M, et al. Fetal growth and cardio-metabolic risk factors in the 20-year-old offspring[J]. Acta Obstet Gynecol Scand, 2014, 93(11): 1150-1159. DOI:10.1111/aogs.2014.93.issue-11 (  0) 0) |
| [12] |
Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentration in man[J]. Diabetologia, 1985, 28(7): 412-419. DOI:10.1007/BF00280883 (  0) 0) |
| [13] |
Yada KK, Gupta R, Gupta A, et al. Insulin levels in low birth weight neonates[J]. Indian J Med Res, 2003, 118: 197-203. (  0) 0) |
| [14] |
López-Jaramillo P, Gómez-Arbeláez D, López-López J, et al. The role of leptin/adiponectin ratio in metabolic syndrome and diabetes[J]. Horm Mol Biol Clin Investig, 2014, 18(1): 37-45. (  0) 0) |
| [15] |
Cekmez F, Canpolat FE, Pirgon O, et al. Adiponection and visfatin levels in extremely low birth weight infants:they are also at risk for insulin resistant[J]. Eur Rev Med Pharmacol Sci, 2013, 17(4): 501-506. (  0) 0) |
| [16] |
Visentin S, Lapolla A, Londero AP, et al. Adiponectin levels are reduced while markers of systemic inflammation and aortic remodeling are increased in intrauterine growth restricted mother-child couple[J]. Biomed Res Int, 2014, 6(22): 1155-1165. (  0) 0) |
 2018, Vol. 20
2018, Vol. 20


