2. 实验血液学国家重点实验室, 天津 300020
铁粒幼红细胞贫血(sideroblastic anemia, SA)是一组临床和遗传均具有异质性的疾病,其共同特点是贫血和骨髓存在环形铁粒幼红细胞,分为遗传性和获得性SA。遗传性铁粒幼红细胞贫血(congenital sideroblastic anemia, CSA)是一组由于不同基因突变而导致的血红素合成、铁硫簇生物合成或线粒体呼吸链蛋白合成相关途径缺陷的罕见病[1]。随着二代测序(next-generation sequencing, NGS)技术的进展,目前已报道了14个CSA相关致病基因,包括ALAS2、SLC25A38、FECH、GLRX5、HSPA9、HSCB、ABCB7、PUS1、YARS2、LARS2、TRNT1、MT-ATP6、NDUFB11、SLC19A2基因及线粒体基因缺失[2]。尽管如此,仍有近40%单纯CSA或伴有CSA的相关综合征未找到致病基因[2]。最常见的获得性SA为骨髓增生异常综合征伴环形铁粒幼红细胞(myelodysplastic syndrome with ring sideroblasts, MDS-RS),约70%~ 90%成人患者存在SF3B1基因突变[3],但这一基因突变在CSA中并未检测到[4]。致病基因不同,患儿所需的治疗和预后也不同。因此,致病基因及其机制的识别对临床决策是至关重要的。本研究分析了36例SA患儿的临床特征,采用目的基因捕获NGS技术进行SA相关致病基因、与血红素合成及线粒体铁代谢有关的基因检测,分析基因型与临床表型的关系。
1 资料与方法 1.1 研究对象选取2008年1月至2018年1月我院36例临床诊断SA患儿为研究对象。CSA诊断标准为[5]:(1)较早(出生后或婴儿期)出现的慢性贫血;(2)骨髓形态显示骨髓中红系细胞增生增高或正常;(3)骨髓铁染色显示含铁血黄素显著增多,铁粒幼红细胞增高(常至80%~90%),环形铁粒幼红细胞比例增高(> 10%);(4)电镜显示幼红细胞线粒体铁沉积;(5)有相应的家族史;(6)除外继发性SA。MDS-RS诊断标准为[3]:符合MDS最低诊断标准,骨髓环形铁粒幼红细胞≥15%或≥5%且具有SF3B1基因突变。
所有患儿家属均已签署知情同意,并获中国医学科学院血液病医院血液学研究所伦理委员会批准(KT2013004-EC-1)。
1.2 临床资料的收集收集SA患儿的临床资料,包括确诊年龄、性别、重要症状体征(包括发育情况、躯体畸形、肝脾大小)、家族史、血常规、血清铁、转铁蛋白饱和度、铁蛋白、外周血涂片、骨髓细胞学、染色体和治疗反应等。
1.3 目的基因捕获NGS检测SA突变基因所有患儿均采集骨髓或外周血5 mL(EDTA抗凝),4℃保存,72 h内提取DNA。家系验证DNA提取自父母和/或同胞外周血。
目的基因panel包括已报道的CSA相关致病基因、与血红素合成及线粒体铁代谢有关基因的全部外显子及外显子-内含子交界区等564个基因。应用Illumina NextSeq 500测序平台进行NGS。平均基因覆盖度为98.1%,平均测序深度为600×,95%覆盖度 > 20×。针对检测到的变异位点,对先证者及其亲属进行Sanger测序验证。依据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)发布的序列变异解读标准和指南[6]判断变异的致病性。
线粒体基因组测序仅在无上述基因突变的或高度怀疑皮尔逊综合征(Pearson syndrome, PS)的患儿中进行。通过捕获panel对线粒体DNA进行富集、扩增,应用Illumina NextSeq 500测序平台对扩增产物进行NGS。质控分析合格的数据,与线粒体参考序列进行比对、统计测序深度及覆盖度,SNP/InDel检测、注释及统计采用mtDB数据库(http://www.mtdb.igp.uu.se)、OMIM数据库(https://www.omim.org)及MitoMap数据库(https://www.mitomap.org)。捕获效率为80%,线粒体DNA覆盖度达99.93%。
1.4 随访所有患儿随访至2019年1月,中位随访时间41(3~130)个月。随访资料来源于住院病历、门诊病历。对随访期间死亡的病例,根据病例记录或与患儿家属电话联系确认。失访患儿共3例(8%)。
1.5 统计学分析总生存(overall survival, OS)期按确诊至死亡的时间或确诊至2019年1月计算。计数资料以中位数(范围)表示。
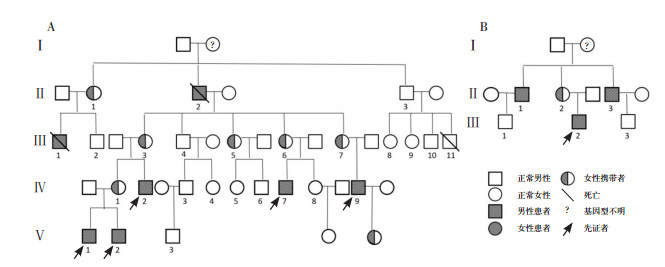
2 结果 2.1 SA患儿的临床特征及基因突变分析36例患儿中,32例为CSA,4例为MDS-RS,共6例患儿(2个家系)有家族史(图 1)。首次临床诊断SA中位年龄3(0~14)岁,男24例,女12例。19例(53%)检出与CSA相关致病/可能致病性基因突变,其中68%(13/19)患儿检测到核基因突变,32%(6/19)检测到线粒体基因缺失。21例检测出致病或可能致病或意义不明基因突变患儿的临床特征及基因突变情况见表 1。
|
图 1 具有家族史的ALAS2基因突变导致的CSA患儿家系图 图A示ALAS2基因突变导致的X连锁环状铁粒幼红细胞贫血家系1,本研究中纳入的患儿11~15分别为Ⅳ-2、Ⅳ-7、Ⅳ-9、Ⅴ-1、Ⅴ-2;图B示ALAS2基因突变导致的X连锁环状铁粒幼红细胞贫血家系2,本研究中纳入的患儿10为Ⅲ-2。 |
| 表 1 21例检测出致病或可能致病或意义不明基因突变SA患儿临床特征和基因信息 |
|
|
19例基因诊断患儿中,ALAS2基因致病/可能致病性突变占47%(9/19)。患儿均为男性,均表现为婴幼儿期即出现典型的小细胞低色素贫血[血红蛋白66(48~89)g/L,平均红细胞体积72.4(60.9~84.6)fl],铁蛋白进行性显著增高[943(87~6020)ng/mL]及铁过载导致的器官受累(包括第二性征发育不良、身材矮小、反复腹泻、肝大及脾大)。其中,R411C[7]、F165L[8]、M202I[5]、C471Y[9]和c.-15-2188A > G[10]为既往报道过的致病突变。患儿10存在ALAS2基因c.1153A > T(p.I385F)母源性半合子新变异,其2个患病舅舅为该变异的半合子,符合PP1;患儿表型和家族史对考虑的基因高度特异,符合PP4;该变异为ESP数据库(http://evs.gs.washington.edu/EVS)、千人基因组数据库(http://browser.1000genomes.org)、ExAC数据库(http://exac.broadinstitute.org)中未发现的变异,符合PM2;经SIFT(https://sift.bii.a-star.edu.sg)、PolyPhen-2(http://genetics.bwh.harvard.edu/pph2)、MutationTaster(http://www.mutationtaster.org)软件的生物信息数据分析预测,分别提示为“有害的”、“可能有害的”和“致病的”,符合PP3;该变异为错义变异,而基因的良性错义变异频率低、错义变异是疾病的普遍机制,符合PP2;因此该变异被判定为“可能致病的”。
4例(21%)患儿存在SLC25A38基因致病性突变,均无家族史,均表现为单纯重度小细胞低色素贫血[血红蛋白57(49~62)g/L,平均红细胞体积71.5(53.7~74.4)fl],铁蛋白增高[332(197~ 1 435)ng/mL],各系统铁过载出现较早,部分患儿伴有脾大(2/4)。2例患儿为纯合突变,2例为复合杂合突变,4例患儿检测到5种突变,2种错义突变,3种无义突变。其中,R134C、R187Q、W87X、I143Pfs146X为既往报道过的致病突变[9],Q59X为新变异。该变异为无义突变,符合PVS1;该变异为ESP数据库、千人数据库、ExAC数据库中未发现的变异,符合PM2;经MutationTaster和GERP++软件的生物信息数据分析预测,分别提示为“有害的”、“保守的”,符合PP3;因此该变异被判定为“致病的”。
未检测到致病/可能致病性基因突变的患儿进一步行线粒体基因组捕获测序。32%(6/19)患儿检测到线粒体基因不同大小片段的缺失,大小范围在4 000~7 000 bp之间,共同涉及的基因包括ATP6、COX3、ND3、ND4L、ND4、ND5及tRNA(包括TRNG、TRNR、TRNL2、TRNS2、TRNH)基因,均诊断为PS。6例PS患儿出生时即存在重度大细胞性贫血[血红蛋白60(49~81)g/L,平均红细胞体积89.8(74.1~101.4)fl],伴有粒细胞和血小板不同程度的减低;骨髓涂片三系可见不同程度的病态造血,红系和粒系前体细胞胞浆空泡为其特征性表现。部分患儿未输血的情况下铁蛋白已明显增高[715(164~1265)ng/mL]。6例患儿出现的血液系统以外症状包括发育迟缓、胰腺外分泌功能不全、肌张力减低,患儿1同时伴有1型糖尿病。
此外,患儿20、21检测到意义不明的ALAS2基因杂合变异,均为女性CSA患儿。其中,Y500C为既往报道过的致病性突变[11];c.1600+1G > A为ESP数据库、千人数据库、ExAC数据库中未发现的变异,经MutationTaster和GERP++软件的生物信息数据分析预测,分别提示为“致病的”、“保守的”,但由于无法获得患儿父母的样本,不能确定该患儿是否存在X染色体非随机失活。4例MDS-RS患儿均未检测到SF3B1突变及CSA相关基因突变。
2.2 预后维生素B6治疗对ALAS2基因R411C、F165L、M202I、C471Y突变的患儿有效,而对c.-15-2188A > G和I385F突变患儿无效。对维生素B6治疗反应者预后好,血红蛋白浓度在用药后1~3个月内升至正常,铁蛋白逐渐下降。而维生素B6无反应者需依赖输注红细胞,并伴有严重的铁过载相关器官损害。SLC25A38基因突变患儿对维生素B6治疗均无反应。患儿19行无关供者造血干细胞移植后痊愈,余患儿均依赖输注红细胞。PS患儿预后较差,67%(4/6)死于感染、酸中毒或多脏器功能衰竭。
3 讨论CSA致病基因主要涉及血红素合成(ALAS2、SLC25A38)、铁硫簇合成(ABCB7、GLRX5)、线粒体蛋白合成及参与氧化磷酸化的蛋白合成(线粒体DNA、PUS1、YARS2、TRNT1及SLC19A2)。近年来,不断有新基因被报道,包括HSPA9、HSCB、LARS2、MT-ATP6、NDUFB11基因[2]。成人MDS-RS致病基因主要涉及编码剪接体的多个基因突变,包括SF3B1、U2AF35、ZRSR2、SRSF2,其中SF3B1基因突变占70%以上,但儿童MDS-RS未检测到上述基因突变[3]。本研究系统分析了这一罕见疾病的基因突变谱,59% CSA患儿检测到了致病/可能致病性基因,4例MDS-RS患儿均未检测到致病/可能致病性基因突变,均与既往报道基因突变检出率基本一致[2-4]。
ALAS2基因突变所致的X连锁环状铁粒幼红细胞贫血(X-linked sideroblastic anemia, XLSA)是CSA最常见的类型。ALAS2编码血红素合成第一步所需的氨基酮戊酸合成酶。迄今为止,已报道近100种突变[12]。大多数致病性突变位于外显子5和外显子9,后者包含吡哆醛结合位点,即赖氨酸391[13]。ALAS2基因突变对酶的功能影响广泛,包括辅因子和底物结合、催化及酶稳定性。不到5%的家系突变位点位于内含子1的GATA1转录因子结合位点上,导致编码正常蛋白的mRNA表达量减低[10]。本研究首次在中国CSA患儿中报道了c.-15-2188A > G位点的突变(患儿11~15)。XLSA男性患者多见,表现为典型的小细胞低色素贫血。但女性患者也约占1/4,并且具有不同的临床表现及突变谱[14-15]。男性患者多在20岁以内出现典型症状,而女性患者多在中年以后出现正细胞/大细胞正色素贫血,几乎都与染色体非随机失活有关。遗憾的是,本研究中2例女性患儿临床符合CSA,但贫血出现较早,检测出的变异既往在CSA患者中报道过或者功能预测有害,但由于缺少父母标本未能验证是否存在X染色体非随机失活,故无法明确变异的致病性。位于吡哆醛结合位点的突变对维生素B6治疗反应好,本研究中,位点R411C、F165L、M202I、C471Y均对维生素B6治疗有反应,与既往报道一致[7-9]。其他影响酶的催化活性及酶与甘氨酸、琥珀酰辅酶A亲和力的突变可能对维生素B6治疗反应不佳。本研究中I385F位于吡哆醛结合位点以外,可能是患儿对维生素B6治疗反应不佳的原因。
红系特异转运体SLC25A38是单纯CSA最常见的突变基因,其临床特点为发病年龄早,男女比例大致相同,多在儿童期就表现为重度小细胞低色素贫血,对维生素B6治疗无反应,且多依赖输血治疗[2]。其机制可能是SLC25A38可能参与甘氨酸向线粒体膜内转运,和/或甘氨酸与δ-氨基-γ-酮戊酸(δ-amino levulinic acid, ALA)的跨线粒体内膜交换转运,从而促进ALA合成。无义突变、移码突变及剪接突变是常见的突变形式,占所有突变的1/3,而错义突变则几乎均位于底物结合位点和跨膜结构域的保守氨基酸上。迄今为止,近40个SLC25A38相关CSA家系被报道,其中近2/3患儿为纯合突变,其中突变Y109X和R117X发生频率较高[2]。本研究中Q59X为新发现的突变位点。既往报道口服高剂量甘氨酸治疗对SLC25A38突变的CSA无效[16]。采用减低剂量预处理方案的同胞全相合造血干细胞移植治愈了1例SLC25A38突变的CSA患儿,未出现严重的移植物抗宿主病[17]。本研究中患儿19进行了无关供者全相合外周血造血干细胞移植,采用重型地中海贫血造血干细胞移植治疗的预处理方案[18],未出现严重的移植物抗宿主病,目前血红蛋白正常,铁蛋白下降至正常范围。提示造血干细胞移植有望成为治愈这一疾病的手段之一。
PS与线粒体DNA的大片段缺失、重组或重复有关。突变分布的组织、突变型与野生型线粒体DNA比例不同导致不同的临床表现及预后。除典型的出生后较早(常为6个月内)出现大细胞贫血、伴有不同程度粒细胞及血小板减少、骨髓表现为造血前体细胞空泡及由于胰腺外分泌障碍导致的发育迟滞外,PS患儿还可能表现为肾小管病、肝大、胆汁淤积、糖尿病、累及神经肌肉及心脏等[19]。部分患儿只表现为血液系统异常,甚至表现为纯红细胞再生障碍而被误诊为先天性纯红细胞再生障碍性贫血[20]。本研究中,患儿2、6除血液系统异常外无其他异常,而患儿6因初次就诊时表现为三系增生减低伴病态造血被误诊为儿童难治性血细胞减少。虽然线粒体疾病有母系遗传的特点,本研究中患儿母亲均未检测到相应突变,提示散发突变也是常见的形式。治疗包括输血、碳酸氢盐、补充胰酶及脂溶性维生素等支持治疗,但疗效均不佳。目前为止,异基因造血干细胞移植治疗PS文献报道共有4例,3例死亡,仅1例患儿在移植后3年情况仍良好[20-22]。PS预后差,患儿多于3岁前死亡,死亡常见原因包括脓毒血症、酸中毒或多脏器功能衰竭[20-22]。但部分患儿症状可自行改善,可能与机体优先选择线粒体缺失少的体细胞有关[19]。
本研究中,有17例患儿未找到致病/可能致病性基因突变。原因可能有:首先,大部分CSA相关致病基因突变为病例报道,而部分基因突变仅在某一人种中被报道过;第二,NGS技术自身存在局限性,包括不充分的靶向覆盖(0~1.5%),且某些致病基因尚未纳入panel中;调控区及部分内含子区存在的变异无法检出;虽然目的基因靶向NGS可以检测到小片段缺失/插入变异,但无法检出大片段缺失、拷贝数变异和短串联重复序列;第三,对疾病认知水平的局限,可能仍有未知的致病基因,或者对已知致病基因的认识尚不充分。
总之,目的基因捕获NGS技术对复杂遗传疾病进行基因诊断相对于传统方法更为系统、高效。本研究首次发现了ALAS2基因上一个对维生素B6治疗不敏感的突变位点I385F,及SLC25A38新突变Q57X。此外,对于婴儿期即出现的低增生性贫血,尤其是无神经肌肉系统症状者,需考虑线粒体病可能,由于此类型病情进展可能较快,采用线粒体基因捕获技术,有助于尽快确诊。
| [1] |
龙章彪, 杜亚丽, 韩冰. 遗传性铁粒幼细胞贫血相关基因及机制研究进展[J]. 中华血液学杂志, 2016, 37(12): 1090-1093. DOI:10.3760/cma.j.issn.0253-2727.2016.12.018 (  0) 0) |
| [2] |
Ducamp S, Fleming MD. The molecular genetics of sideroblastic anemia[J]. Blood, 2019, 133(1): 59-69. DOI:10.1182/blood-2018-08-815951 (  0) 0) |
| [3] |
Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J]. Blood, 2016, 127(20): 2391-2405. DOI:10.1182/blood-2016-03-643544 (  0) 0) |
| [4] |
Ohba R, Furuyama K, Yoshida K, et al. Clinical and genetic characteristics of congenital sideroblastic anemia:comparison with myelodysplastic syndrome with ring sideroblast (MDS-RS)[J]. Ann Hematol, 2013, 92(1): 1-9. DOI:10.1007/s00277-012-1564-5 (  0) 0) |
| [5] |
Liu G, Guo S, Kang H, et al. Mutation spectrum in Chinese patients affected by congenital sideroblastic anemia and a search for a genotype-phenotype relationship[J]. Haematologica, 2013, 98(12): e158-e160. DOI:10.3324/haematol.2013.095513 (  0) 0) |
| [6] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [7] |
Furuyama K, Uno R, Urabe A, et al. R411C mutation of the ALAS2 gene encodes a pyridoxine-responsive enzyme with low activity[J]. Br J Haematol, 1998, 103(3): 839-841. DOI:10.1046/j.1365-2141.1998.01050.x (  0) 0) |
| [8] |
Cotter PD, Rucknagel DL, Bishop DF. X-linked sideroblastic anemia:identification of the mutation in the erythroid-specific δ-aminolevulinate synthase gene (ALAS2) in the original family described by Cooley[J]. Blood, 1994, 84(11): 3915-3924. DOI:10.1182/blood.V84.11.3915.bloodjournal84113915 (  0) 0) |
| [9] |
An W, Zhang J, Chang L, et al. Mutation analysis of Chinese sporadic congenital sideroblastic anemia by targeted capture sequencing[J]. J Hematol Oncol, 2015, 8: 55. DOI:10.1186/s13045-015-0154-0 (  0) 0) |
| [10] |
Kaneko K, Furuyama K, Fujiwara T, et al. Identification of a novel erythroid-specific enhancer for the ALAS2 gene and its loss-of-function mutation which is associated with congenital sideroblastic anemia[J]. Haematologica, 2014, 99(2): 252-261. (  0) 0) |
| [11] |
Méndez M, Moreno-Carralero MI, Morado-Arias M, et al. Sideroblastic anemia:functional study of two novel missense mutations in ALAS2[J]. Mol Genet Genomic Med, 2016, 4(3): 273-282. (  0) 0) |
| [12] |
Fleming MD. The genetics of inherited sideroblastic anemias[J]. Semin Hematol, 2002, 39(4): 270-281. DOI:10.1053/shem.2002.35637 (  0) 0) |
| [13] |
Shoolingin-Jordan PM, Al-Daihan S, Alexeev D, et al. 5-Aminolevulinic acid synthase:mechanism, mutations and medicine[J]. Biochim Biophys Acta, 2003, 1647(1-2): 361-366. DOI:10.1016/S1570-9639(03)00095-5 (  0) 0) |
| [14] |
Aivado M, Gattermann N, Rong A, et al. X-linked sideroblastic anemia associated with a novel ALAS2 mutation and unfortunate skewed X-chromosome inactivation patterns[J]. Blood Cells Mol Dis, 2006, 37(1): 40-45. (  0) 0) |
| [15] |
Aivado M, Gattermann N, Bottomley S. X chromosome inactivation ratios in female carriers of X-linked sideroblastic anemia[J]. Blood, 2001, 97(12): 4000-4002. DOI:10.1182/blood.V97.12.4000 (  0) 0) |
| [16] |
LeBlanc MA, Bettle A, Berman JN, et al. Study of glycine and folic acid supplementation to ameliorate transfusion dependence in congenital SLC25A38 mutated sideroblastic anemia[J]. Pediatr Blood Cancer, 2016, 63(7): 1307-1309. DOI:10.1002/pbc.25981 (  0) 0) |
| [17] |
Kim MH, Shah S, Bottomley SS, et al. Reduced-toxicity allogeneic hematopoietic stem cell transplantation in congenital sideroblastic anemia[J]. Clin Case Rep, 2018, 6(9): 1841-1844. DOI:10.1002/ccr3.1667 (  0) 0) |
| [18] |
Huang K, Zhou DH, Li Y, et al. Modified conditioning regimen improves outcomes of unrelated donor peripheral blood stem cell transplantation for β-thalassaemia major patients[J]. Pediatr Blood Cancer, 2018, 65(7): e27026. DOI:10.1002/pbc.27026 (  0) 0) |
| [19] |
Farruggia P, Di Marco F, Dufour C. Pearson syndrome[J]. Expert Rev Hematol, 2018, 11(3): 239-246. DOI:10.1080/17474086.2018.1426454 (  0) 0) |
| [20] |
Gagne KE, Ghazvinian R, Yuan D, et al. Pearson marrow pancreas syndrome in patients suspected to have DiamondBlackfan anemia[J]. Blood, 2014, 124(3): 437-440. DOI:10.1182/blood-2014-01-545830 (  0) 0) |
| [21] |
Hoyoux C, Dresse MF, Robinet S, et al. Cord blood transplantation in a child with Pearson's disease[J]. Pediatr Blood Cancer, 2008, 51(4): 566. DOI:10.1002/pbc.21615 (  0) 0) |
| [22] |
Pfeffer G, Horvath R, Klopstock T, et al. New treatments for mitochondrial disease-no time to drop our standards[J]. Nat Rev Neurol, 2013, 9(8): 474-481. DOI:10.1038/nrneurol.2013.129 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


