2. 石河子大学医学院, 新疆 石河子 832000
新生儿持续肺动脉高压(persistent pulmonary hypertension, PPH)是一种新生儿综合征,由于出生后肺血管阻力下降失败而导致的低氧血症、酸中毒等病症[1],全球每年约10%~20%的PPH新生患儿会发生死亡[2-3],但目前其具体的发病机制尚不清楚,临床治疗效果欠佳。糖皮质激素在调节血管收缩舒张、血管平滑肌细胞增殖及水盐平衡方面有重要的作用[4],而Ⅱ型11β-羟基类固醇脱氢酶(11β-hydroxysteroid dehydrogenase type 2, 11β-HSD2)是糖皮质激素代谢的关键酶之一,将有生物活性的皮质醇氧化为无活性的皮质酮,可直接调节糖皮质激素的水平[5]。研究表明,缺氧是PPH形成的始动原因[6]。本课题组前期研究已表明在新生小鼠PPH的模型中钙敏感受体(CaSR)的表达水平和细胞内钙离子浓度升高,激动剂组较PPH组明显增加而抑制剂组有所下降[7-9]。由此猜测:在新生儿PPH中,CaSR可能通过调控钙离子浓度而介导11β-HSD2的表达,导致皮质醇浓度改变,继而导致肺动脉高压。所以本研究通过构建PPH小鼠模型,并通过干预CaSR进而观察11β-HSD2的表达及皮质醇的浓度变化,为新生儿PPH的临床诊断和治疗提供新的思路和依据。
1 材料与方法 1.1 主要试剂与仪器小鼠抗大鼠11β-HSD2单克隆抗体(美国Abcam公司),CaSR激动剂氯化钆(GdCl3,美国Sigma公司),CaSR抑制剂NPS2390(德国R & D公司),辣根过氧化物酶标记的山羊抗小鼠IgG抗体、小鼠抗大鼠β-actin单克隆抗体(北京中杉金桥生物技术有限公司),11β-HSD2反转录试剂盒、QuantiNova SYBR Green qPCR荧光定量试剂盒(美国Fermentas公司),皮质醇测定试剂盒(上海酶联生物科技有限公司),小鼠脑利钠肽(BNP)ELISA试剂盒(上海江莱生物科技有限公司),TRIzol(美国Invitrogen公司)。
主要仪器包括荧光定量PCR仪(美国Bio-Rad公司),病理图像分析处理系统(美国Media Cybernetics公司),低温台式离心机(美国Thermo Scientific公司),荧光定量PCR仪(美国Bio-Rad公司)等。
1.2 实验动物分组及模型建立参考文献[10]采用慢性缺氧的方法构建PPH动物模型。SPF级健康C57BL/6小鼠,体重17~28 g,由新疆维吾尔族自治区实验动物研究中心提供。按雌雄鼠2 : 1配对,待孕鼠产仔后将新生小鼠随机分为对照组(n=17)、PPH组(n=17)、激动剂组(n=17)、抑制剂组(n=17)。对照组小鼠暴露在空气中,其他3组小鼠置于氧浓度为12%的低氧箱中,持续2周。称量新生小鼠体重计算体重增长率(RBWI),RBWI=(终末体重-初始体重)/初始体重×100%。低氧处理同时,激动剂组和抑制剂组每日分别腹腔注射GdCl3 16 mg/kg和NPS2390 1 mg/kg[11],对照组和PPH组以每日等量生理盐水替代,持续2周。
1.3 标本采集及处理造模完成后,各组小鼠用1%戊巴比妥钠麻醉,常规消毒后沿左侧肋缘剪断胸骨打开胸腔。取出肺组织和心脏,10%甲醛固定,石蜡包埋后用于苏木精-伊红(HE)染色和免疫组化;将未做处理的肺组织置于液氮过夜,-80℃储存备用。
1.4 心脏和肺组织形态学检测心脏和肺组织标本石蜡包埋后制作石蜡切片,脱蜡后进行HE染色,光学显微镜下观察。
每组取10只小鼠的肺组织标本,从每个肺组织标本中随机选取8张切片于400倍的显微镜下观察,每张切片随机选取6个视野测量直径20~50 μm、100~199 μm的肺小动脉。计算肺小动脉血管壁厚度(WT)来评价肺血管,WT%=100×(2×血管内侧壁厚度)/血管外径。每张切片随机选取4~6个视野用于测量肺泡平均内衬间隔(MLI)及径向肺泡计数(RAC)[12-13],用于评价肺泡发育状况。
每组取10只小鼠的心脏组织标本,从每个心脏组织标本中随机选取8张切片,每张切片随机选取6个视野测量右心室和左心室的室壁厚度,计算右心室与左心室的室壁厚度之比(RV/LV)来评价肺动脉高压和右心室肥大程度。
1.5 免疫组织化学法检测肺组织11β-HSD2的表达每组取小鼠的肺组织标本石蜡切片。石蜡切片脱蜡后用枸橼酸抗原修复,冷却至室温后用PBS缓冲液震洗,擦去多余的PBS后血清封闭,加入小鼠抗大鼠11β-HSD2一抗(1 : 500),4℃孵育隔夜后PBS冲洗,擦去多余的PBS后加入辣根过氧化物酶标记的山羊抗小鼠IgG二抗(1 : 1 000),DAB显色,在显微镜下观察。
1.6 实时荧光定量PCR法测量新生小鼠肺组织11β-HSD2 mRNA的表达每组取8只小鼠肺组织标本,放于研钵中液氮研磨后用TRIzol法提取肺组织匀浆总RNA,采用QuantiNova SYBR Green qPCR试剂盒检测11β-HSD2 mRNA的相对含量。11β-HSD2上游引物:5'-GATGTTCCCCTCGCCTGAA-3',下游引物:5'-ATGAGCAGTGCAATAGCTGCCTTG-3'。MACT(内参)上游引物:5'-TTCCTTCTTGGGTATGGAAT-3'。下游引物:5'-GAGCAATGATCTTGATCTTC-3'。反应体系:上下游引物各1 μL、SYBR Green I 10 μL、无水酶5 μL、cDNA 3 μL。反应条件:95℃预变性2 min;95℃变性30 s,60℃退火20 s,共40个循环。11β-HSD2的相对表达量以2-△△CT表示。
1.7 Western blot法检测新生小鼠肺组织11β-HSD2蛋白表达每组取8只小鼠,每只小鼠取50 mg肺组织放于研钵中,液氮研磨后加入蛋白裂解酶和PMSF冷却30 min后离心,取上清液进行测定。取50 μg蛋白样品,10% SDS-PAGE电泳,80 V 120 min后转移至PVDF膜,室温封闭2 h,加入小鼠抗大鼠11β-HSD2一抗(1 : 500),β-actin一抗(1 : 1 000)4℃孵育过夜;TBST洗膜4次,每次8 min,加入辣根过氧化物酶标记的山羊抗小鼠lgG二抗(1 : 1 000)室温孵育2 h,TBST洗膜4次,每次8 min,然后显色定影。定影后用image J软件检测分析灰度值,计算11β-HSD2蛋白的相对表达量,结果用11β-HSD2蛋白与内参β-actin蛋白的比值表示。
1.8 新生小鼠血清皮质醇及肺组织BNP浓度检测每组取10只小鼠,每只小鼠取20 mg肺组织置于研钵中研磨后,静置离心取上清液,按照皮质醇测定试剂盒说明书的方法检测其浓度。取30 mg肺组织置于研钵中研磨后,静置离心取上清液,按照小鼠BNP ELISA试剂盒说明书检测上清液BNP水平,450 nm波长下测定吸光度值,计算新生小鼠肺组织BNP浓度。
1.9 统计学分析采用SPSS 20.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 新生小鼠的基本情况对照组小鼠由于哺乳状况和小鼠个体原因,以及其他3组小鼠对干预药物和缺氧的耐受较差,造成了建模过程中小鼠的死亡,即造模完成后各组小鼠均死亡3只。对照组小鼠在造模期间活动量大、精神良好、反应灵敏;PPH组和激动剂组上述情况较差甚至出现不同程度的呼吸困难,抑制剂组较PPH组上述情况有轻微的好转,但相比对照组略差。PPH组和激动剂组体重和RBWI较对照组明显下降(P < 0.05),抑制剂组的体重及RBWI与对照组、PPH组和激动剂组比较差异均无统计学意义(P > 0.05)。见表 1。
| 表 1 低氧14 d后各组小鼠体重及RBWI比较 (x±s) |
|
|
与对照组比较,PPH组和激动剂组小鼠肺小动脉在低氧条件下管壁明显增厚,而抑制剂组小鼠肺小动脉管壁厚度与PPH组和激动剂组相比略薄(图 1)。与对照组比较,PPH组和激动剂组WT%明显增加(P < 0.05),而抑制剂组较PPH组和激动剂组WT%有所减少(P < 0.05),对照组和抑制剂组WT%比较差异无统计学意义(P > 0.05)。PPH组和激动剂组较对照组RV/LV值明显增加(P < 0.05),说明右心室肥大;PPH组与激动剂组RV/LV值比较差异无统计学意义(P > 0.05);抑制剂组RV/LV值低于PPH组,但高于对照组(P < 0.05),与激动剂组比较差异无统计学意义(P > 0.05)。与对照组相比,PPH组的BNP浓度明显升高,激动剂组较PPH组进一步升高(P < 0.05);抑制剂组BNP浓度较激动剂组和PPH组有所降低(P < 0.05),且与对照组相比差异无统计学意义(P > 0.05)。见表 2。
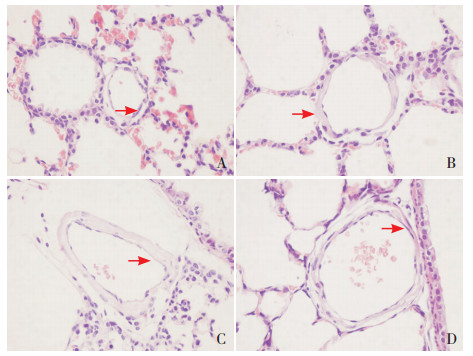
|
图 1 各组新生小鼠肺小动脉血管壁变化(苏木精-伊红染色,×400) A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。与对照组相比,PPH组和激动剂组肺小动脉血管壁显著增厚,抑制剂组血管壁厚度较PPH组减小(箭头所示)。 |
| 表 2 各组小鼠WT%、RV/LV和BNP浓度的比较 (x±s) |
|
|
对照组小鼠肺泡密度较大,肺泡完整,单个肺泡较小;PPH组肺泡明显增大,密度降低,间隔破坏严重;激动剂组较PPH组肺泡间隔破环更加严重,肺泡密度更小;而抑制剂组较PPH组和激动剂组肺泡间隔破坏有所减轻,肺泡密度相对增加(图 2)。与对照组相比,激动剂组和PPH组MLI值增大,RAC值明显减小(P < 0.05);而抑制剂组较激动剂组和PPH组MLI值减小,RAC值增加(P < 0.05),且与对照组比较差异无统计学意义(P > 0.05);激动剂组和PPH组MLI值和RAC值比较差异无统计学意义(P > 0.05)。见表 3。
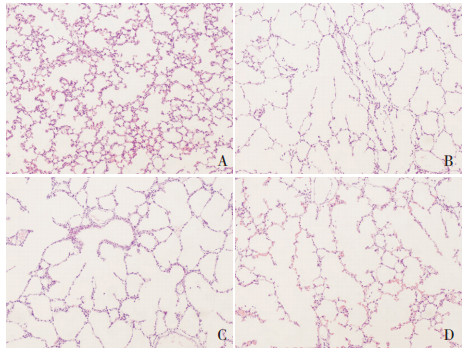
|
图 2 各组新生小鼠肺泡形态(苏木精-伊红染色,×100) A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。与对照组相比,PPH组新生小鼠肺泡破坏严重,肺泡变大,肺泡隔板数量减少;激动剂组新生小鼠肺泡情况与PPH组小鼠相比无明显差异;抑制剂组较PPH组肺泡破坏程度有所减轻。 |
| 表 3 各组小鼠肺泡MLI及RAC值的比较 (x±s) |
|
|
免疫组织化学结果表明:11β-HSD2蛋白主要分布于肺动脉血管平滑肌细胞和内皮细胞,阳性表达呈棕褐色。PPH组较对照组11β-HSD2蛋白阳性表达减弱,说明缺氧能够抑制11β-HSD2蛋白的表达;在激动剂组11β-HSD2蛋白阳性表达较对照组减弱;抑制剂组11β-HSD2蛋白阳性表达较PPH组和激动剂组明显加深,提示激动剂在缺氧的基础上进一步抑制该蛋白的表达,同时抑制剂能够逆转这种状况。见图 3。
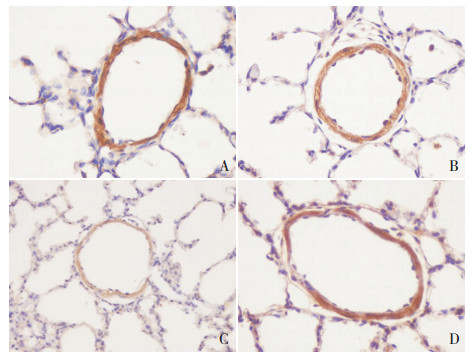
|
图 3 免疫组化法检测各组小鼠肺组织11β-HSD2的表达(DAB,×400) A为对照组,B为PPH组,C为激动剂组,D为抑制剂组。11β-HSD2主要在肺小动脉内皮细胞和平滑肌细胞中表达,阳性表达呈棕褐色。与对照组相比,PPH组肺动脉中11β-HSD2表达有所下降,激动剂组进一步下调;而与PPH组和激动剂组相比,11β-HSD2在抑制剂组中表达有所上调。 |
与对照组相比,PPH组的11β-HSD2 mRNA及其蛋白的表达明显下降(P < 0.05),激动剂组的11β-HSD2 mRNA及其蛋白的表达水平进一步下调(P < 0.05),而抑制剂组11β-HSD2 mRNA及其蛋白的表达水平较PPH组和激动剂组明显上调,但与对照组相比差异仍有统计学意义(P < 0.05)。各组皮质醇的浓度变化水平和11β-HSD2的表达呈现相反的变化趋势。见图 4,表 4。
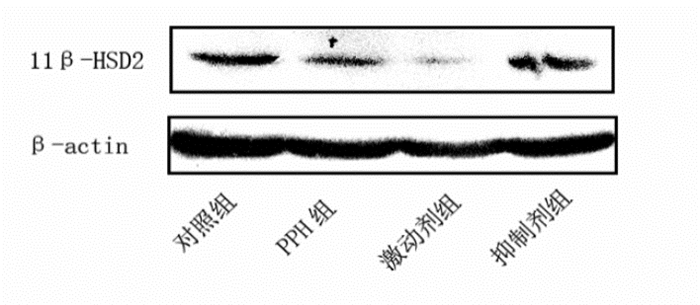
|
图 4 Western blot检测各组新生小鼠肺组织中11β-HSD2蛋白电泳图 |
| 表 4 各组小鼠肺组织11β-HSD2 mRNA及其蛋白相对表达量及皮质醇浓度比较 (x±s) |
|
|
有研究表明,低氧因素会导致肺动脉血管的收缩、肺血管内皮细胞功能障碍、平滑肌细胞的增殖和迁移及凋亡抑制,从而诱导肺动脉高压的发生发展[14];同时结合课题组前期的实验结果及相关文献报道CaSR确实参与了肺动脉高压(如肺动脉平滑肌细胞增殖、血管重构)的发生发展[15]。为研究在这之间是否有其他分子或者蛋白参与,进而本次研究通过低氧诱导构建PPH新生小鼠动物模型,来研究CaSR激动剂和CaSR抑制剂对PPH模型小鼠11β-HSD2及皮质醇的作用。实验结果显示:PPH组较对照组右心室壁厚度、肺动脉管壁厚度及BNP浓度均显著增加且具有统计学意义,表明本次实验构建PPH动物模型成功。
本研究中肺动脉的免疫组化染色结果发现11β-HSD2主要表达于肺血管的平滑肌细胞和内皮细胞中。11β-HSD2 mRNA及其蛋白水平方面检测发现,PPH组较对照组小鼠肺动脉11β-HSD2表达明显下降而皮质醇的浓度升高,表明低氧可以下调11β-HSD2的表达,进而使皮质醇浓度升高。结合本课题组前期研究结果[8-9, 16]及激动剂组和抑制剂组的结果:CaSR激动剂能够进一步下调11β-HSD2的表达和促进皮质醇的浓度升高;CaSR抑制剂反而能够上调11β-HSD2的表达和抑制皮质醇的分泌。有研究团队研究了非基因组信号通路,数据表明,细胞内钙离子是快速抑制11β-HSD2的表达和活性的重要介质[17]。同时Hardy等[18]也表明细胞内钙离子的增加会抑制胎盘11β-HSD2的活性和表达水平,这与本次实验结果相一致。其可能原因是细胞内增多的钙离子作用于腺苷酸环化酶(AC)而降低其水平,进而下调其下游分子环磷酸腺苷(cAMP)从而抑制蛋白激酶A(PKA);11β-HSD2基因启动子区含有转录因子NF-1、Sp1等的结合位点,其中最重要的转录因子是NF-1,而下调的PKA不能有效的磷酸化NF-1进而下调11β-HSD2的水平[17-19]。由于11β-HSD2水平的降低,皮质醇不能被有效的灭活而升高。而过量的皮质醇暴露会刺激肺动脉平滑肌细胞过度增殖及内皮细胞受损进而发生血管重构[20],这也正好符合PPH发生的基本病理特征。同时它还可以抑制内皮细胞产生NO、前列环素等一系列舒血管因子及可以激活相应缩血管物质受体,从而加强缩血管效应[21]。可能通过以上的综合作用诱导PPH的产生。
钙敏感受体调节剂正逐渐为呼吸、心血管、肿瘤疾病提供新的治疗可能[22],其中CaSR抑制剂具有多种生物活性,包括抗炎、抗癌、保护心血管系统等[23],但本次实验结果发现抑制剂组较PPH组肺泡密度较小、肺泡较完整、肺泡间隔破坏较轻、肺动脉平滑肌细胞排列较整齐、RV/LV值减小、BNP浓度降低、小鼠精神状态有所好转,这些结果提示钙敏感受体的阻断可能为PPH提供新的治疗策略。同时我们发现11β-HSD2可能作为中间的信号蛋白参与其中,有研究表明选择性抑制11β-HSD2对机体有害,会导致高血压等心血管疾病的发生[24],相反是否可以选择性激动11β-HSD2来更好逆转此病?以及中间具体的信号通路有待进一步研究。
综上所述,本次实验CaSR抑制剂能够在一定程度上恢复PPH导致的肺泡损伤、皮质醇浓度过高等病症,以及从11β-HSD2角度为PPH的发病提供可能的机制。
| [1] |
Del Rey Hurtado de Mendoza B, Sánchez-de-Toledo J, Bobillo Perez S, et al. Lung ultrasound to assess the etiology of persistent pulmonary hypertension of the newborn (LUPPHYN Study):a pilot study[J]. Neonatology, 2019, 116(2): 140-146. (  0) 0) |
| [2] |
Kibe M, Ibara S, Inagaki H, et al. Lethal persistent pulmonary hypertension of the newborn in Bohring-Opitz syndrome[J]. Am J Med Genet A, 2018, 176(5): 1245-1248. (  0) 0) |
| [3] |
Ng QX, Venkatanarayanan N, Ho CYX, et al. Selective serotonin reuptake inhibitors and persistent pulmonary hypertension of the newborn:an update meta-analysis[J]. J Womens Health (Larchmt), 2019, 28(3): 331-338. (  0) 0) |
| [4] |
Burford NG, Webster NA, Cruz-Topete D. Hypothalamicpituitary-adrenal axis modulation of glucocorticoids in the cardiovascular system[J]. Int J Mol Sci, 2017, 18(10): pii:E2150. (  0) 0) |
| [5] |
Chen L, Guilmette J, Luo ZC, et al. Placental 11β-HSD2 and cardiometabolic health indicators in infancy[J]. Diabetes Care, 2019, 42(5): 964-971. (  0) 0) |
| [6] |
Babooa N, Shi WJ, Chen C. Factors relating caesarean section to persistent pulmonary hypertension of the newborn[J]. World J Pediatr, 2017, 13(6): 517-527. (  0) 0) |
| [7] |
张方方, 王彦梅, 田松柏, 等. 钙敏感受体及相关分子在新生大鼠持续肺动脉高压发病中的作用[J]. 中国新生儿科杂志, 2016, 31(4): 64-68. (  0) 0) |
| [8] |
王萌萌, 李贺, 张方方, 等. 钙敏感受体在新生小鼠持续性肺动脉高压中的作用[J]. 中国当代儿科杂志, 2017, 19(2): 208-214. (  0) 0) |
| [9] |
李贺, 谷强, 王萌萌, 等. 钙敏感受体对低氧诱导的持续性肺动脉高压小鼠肺动脉平滑肌细胞内钙离子浓度的影响[J]. 中国新生儿科杂志, 2018, 33(1): 59-64. (  0) 0) |
| [10] |
Ambalavanan N, Bulger A, Murphy-Ullrich J, et al. Endothelin-A receptor blockade prevents and partially reverses neonatal hypoxic pulmonary vascular remodeling[J]. Pediatr Res, 2005, 57(5 Pt 1): 631-636. (  0) 0) |
| [11] |
甄毅岚.钙敏感受体在小鼠缺血性脑卒中的作用及机制[D].合肥: 安徽医科大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10366-1014315828.htm
(  0) 0) |
| [12] |
Knudsen L, Weibel ER, Gundersen HJ, et al. Assessment of air space size characteristics by intercept (chord) measurement:an accurate and efficient stereological approach[J]. J Appl Physiol (1985), 2010, 108(2): 412-421. (  0) 0) |
| [13] |
Cooney TP, Thurlbeck WM. The radial alveolar count method of Emery and Mithal:a reappraisal 1-postnatal lung growth[J]. Thorax, 1982, 37(8): 572-579. (  0) 0) |
| [14] |
Alano MA, Ngougmna E, Ostrea EM Jr, et al. Analysis of nonsteroidal antiinflammatory drugs in meconium and its relation to persistent pulmonary hypertension of the newborn[J]. Pediatrics, 2001, 107(3): 519-523. (  0) 0) |
| [15] |
Nakamura H, Zimmer J, Lim T, et al. Increased CaSR and TRPC6 pulmonary vascular expression in the nitrofen-induced model of congenital diaphragmatic hernia[J]. Pediatr Surg Int, 2018, 34(2): 211-215. (  0) 0) |
| [16] |
李翔, 吴冰霞, 谷强, 等. 钙敏感受体对持续性肺动脉高压新生小鼠内皮型一氧化氮合酶及一氧化氮的影响[J]. 中国当代儿科杂志, 2019, 21(2): 189-194. (  0) 0) |
| [17] |
Kossintseva I, Wong S, Johnstone E, et al. Proinflammatory cytokines inhibit human placental 11beta-hydroxysteroid dehydrogenase type2 activity through Ca2+ and cAMP pathways[J]. Am J Physiol Endocrinol Metab, 2006, 290(2): E282-E288. (  0) 0) |
| [18] |
Hardy DB, Dixon SJ, Narayanan N, et al. Calcium inhibits human placental 11beta-hydroxysteroid dehydrogenase type 2 activity[J]. Biochem Biophys Res Commun, 2001, 283(4): 756-761. (  0) 0) |
| [19] |
倪晓田.人绒毛膜促性腺激素促进胎盘糖皮质激素屏障11β-HSD2表达的机制研究[D].上海: 复旦大学, 2010. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2226200
(  0) 0) |
| [20] |
Zhang L, Zhou J, Jing Z, et al. Glucocorticoids regulate the vascular remodeling of aortic dissection via the p38 MAPK-HSP27 pathway mediated by soluble TNF-RII[J]. EBioMedicine, 2018, 27: 247-257. (  0) 0) |
| [21] |
Ong SL, Whitworth JA. How do glucocorticoids cause hypertension:role of nitricoxide deficiency, oxidative stress, and eicosanoids[J]. Endocrinol Metab Clin North Am, 2011, 40(2): 393-407. (  0) 0) |
| [22] |
Vahe C, Benomar K, Espiard S, et al. Diseases associated with calcium-sensing receptor[J]. Orphanet J Rare Dis, 2017, 12(1): 19. (  0) 0) |
| [23] |
Lee JW, Park HA, Kwon OK, et al. NPS 2143, a selective calcium-sensing receptor antagonist inhibits lipopolysaccharideinduced pulmonary inflammation[J]. Mol Immunol, 2017, 90: 150-157. (  0) 0) |
| [24] |
Zhou C, Ye F, Wu H, et al. Recent advances in the study of 11β-hydroxysteroid dehydrogenase type 2(11β-HSD2) inhibitors[J]. Environ Toxicol Pharmacol, 2017, 52: 47-53. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


