2. 北京大学第三医院儿科, 北京 100191
宫内发育迟缓(intrauterine growth restriction, IUGR)在孕期发生率高达8%,是导致新生儿死亡和发生合并症的第2位原因,仅次于早产[1]。宫内发生发育迟缓的新生儿为小于胎龄儿(small for gestational age, SGA),是指出生体重在同性别同胎龄正常体重的第10百分位数以下或低于平均值的2个标准差[2]。IUGR的新生儿容易发生近期或远期的合并症,并且越来越多的研究表明IUGR与其成年后发生2型糖尿病、肥胖、高血压等密切相关[3]。Ronkainen等[4]研究关注了IUGR对肺功能的影响,以及其与喘息或哮喘的关系,此项研究基于5 000名儿童群体,证实儿童3~4岁时出现的喘息症状可能与IUGR相关。近年来越来越多的研究表明IUGR能够影响肺脏成熟,从而引发呼吸系统结构和(或)功能改变[5],在学龄期儿童可表现为哮喘[6]。为了研究IUGR与哮喘发生的相关分子机制,本研究在IUGR模型基础上建立卵清蛋白(ovalbumin, OVA)诱导的支气管哮喘小鼠模型,对建立IUGR哮喘模型的方法进行了探讨。
1 材料与方法 1.1 实验动物、饲料及环境8~10周龄雌性BALB/c小鼠(清洁级),购自北京维通利华实验动物有限公司,饲养于北京大学医学部动物实验中心。动物饲料购自北京华阜康生物科技股份有限公司,饲料包括两种:低蛋白饲料(8%酪蛋白)和普通饲料(20%蛋白)。饲料配方参照本课题组既往研究基础[7],详见表 1。动物饮用水为动物中心提供的纯净水。饲养温度24±2℃,湿度50%~70%,12 h自动昼夜循环。干预前所有小鼠均适应性喂养7 d。
| 表 1 实验中应用饲料配方 |
|
|
参照文献[8]的方法,将适应性喂养后的16只BALB/c雌鼠按照2 : 1与雄鼠合笼,次日晨查孕栓,查到孕栓则记录为受孕雌鼠,记为孕0 d。采用随机分组方法将受孕雌鼠分成低蛋白饮食组和正常蛋白饮食组,每组8只。两组孕鼠均单笼喂养,每日分别添加低蛋白饲料及正常蛋白饲料,自由摄食,摄食量及饮水量不受限制,直至分娩。两组孕鼠分娩后及仔鼠21 d断奶后均饲以正常蛋白饮食。仔鼠出生后6 h测量体重,依据文献[8]中描述,IUGR模型评估鉴定的标准是出生体重低于同胎龄平均体重的第10百分位或2个标准差。仔鼠6周龄时,随机选取低蛋白饮食组中符合IUGR标准的16只雄性仔鼠纳入IUGR组,正常蛋白饮食组中16只雄性小鼠纳入对照组。
将对照组小鼠随机分对照+PBS组和对照+OVA组(n=8),将IUGR组小鼠随机分为IUGR+PBS组和IUGR+OVA组(n=8)。参照文献[9]的方法,在实验第0天、第14天,对照+OVA组和IUGR+OVA组小鼠腹腔注射100 μL含有OVA的PBS溶液(OVA浓度为2 mg/mL)进行致敏;对照+PBS组和IUGR+PBS组腹腔注射等体积PBS。从第21天至第30天,将对照+OVA组和IUGR+OVA组小鼠置于雾化箱中,雾化吸入50 μL OVA溶液(OVA浓度为1%),每次激发30 min,每日1次,连续10 d。对照+PBS组和IUGR+PBS组小鼠予以等量的PBS溶液进行雾化吸入。诱导发生哮喘模型时无小鼠死亡,成活率100%。本研究通过检测肺泡灌洗液中炎症细胞计数、血清IgE水平及肺组织形态学改变等多个方面,鉴定哮喘模型是否成功建立[9]。
1.3 小鼠血糖、血清胰岛素和血清IgE水平检测IUGR建模结束后(即小鼠生后6周),进食后约2 h,一次性采血针取小鼠尾静脉微量血,通过微量血糖仪测定末梢血糖水平;采用眼静脉丛采血法采集小鼠血液标本并收集于未添加抗凝剂的试管中,凝固后留取血清,采用酶联免疫吸附法(enzyme-linked inmmunosorbent assay, ELISA)检测小鼠血清胰岛素水平。OVA诱导哮喘模型建模结束后24 h,采用眼静脉丛采血法采集小鼠血液标本收集于未加抗凝剂的试管中,凝固后留取血清,采用ELISA法检测小鼠血清IgE水平。胰岛素和IgE抗体ELISA试剂盒均购自美国ALPCO公司。实验步骤严格按照试剂盒说明书操作。
1.4 小鼠肺泡灌洗液细胞含量测定采集静脉血后,将小鼠气管切开,22号套管针置入并且固定,用无菌生理盐水对气管、支气管和肺脏进行灌洗,共2次,保证肺泡灌洗液回收率在75%以上。肺泡灌洗液离心后,在1 h内将细胞与上清液进行分离,将沉淀细胞涂片、固定、苏木精-伊红(HE)染色,光镜下按照细胞形态进行嗜酸性粒细胞、淋巴细胞、巨噬细胞和总细胞的分类计数(至少计数200个细胞)。
1.5 小鼠肺组织标本HE染色哮喘模型建模结束后24 h取小鼠右肺组织固定于10%甲醛溶液中,经过洗涤、脱水、透明、浸蜡、包埋、切片、HE染色,最后进行透明和封片,通过显微镜拍照,进行图像采集。
1.6 统计学分析采用SPSS 24.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 低蛋白饮食法构建小鼠IUGR模型正常蛋白饮食组新生仔鼠73只,低蛋白饮食组新生仔鼠43只,其中死亡9只,成活率79%。正常蛋白饮食组平均体重1.99 ± 0.19 g,低蛋白饮食组平均体重1.67±0.18 g(全部达到IUGR标准),两组比较差异有统计学意义(t=8.490,P < 0.01)。
2.2 对照组和IUGR组小鼠血糖及血清胰岛素水平变化与对照组相比,IUGR组小鼠血糖值降低,但差异无统计学意义(P=0.290);IUGR组小鼠血清胰岛素水平降低,差异有统计学意义(P < 0.01)。见表 2。
| 表 2 对照组和IUGR组小鼠血糖及血清胰岛素水平比较 (x±s) |
|
|
对照+PBS组、对照+OVA组、IUGR+PBS组和IUGR+OVA组IgE含量比较差异有统计学意义(F=317.14,P < 0.001)。IUGR+PBS组IgE含量(3.58±0.27 μg/mL)较对照+PBS组(5.50±0.35 μg/mL)降低(P < 0.01);与对照+ PBS组和IUGR+PBS组相比,对照+OVA组IgE含量(12.89±1.21 μg/mL)和IUGR+OVA组IgE含量(25.00±2.07 μg/mL)均明显升高(P < 0.01),且IUGR+OVA组IgE含量高于对照+OVA组(P < 0.01)。
2.4 各组小鼠肺泡灌洗液细胞分类计数与对照+PBS组相比,IUGR+PBS组肺泡灌洗液中白细胞、嗜酸性粒细胞、淋巴细胞及巨噬细胞计数均无变化,差异无统计学意义(P > 0.05);与对照+PBS组和IUGR+PBS组相比,对照+OVA组和IUGR+OVA组白细胞、嗜酸性粒细胞、淋巴细胞及巨噬细胞计数均明显增加(P < 0.01),且对照+ OVA组的白细胞、嗜酸性粒细胞、淋巴细胞及巨噬细胞计数均多于IUGR+OVA组(P < 0.01),见表 3。
| 表 3 各组小鼠肺泡灌洗液细胞分类计数比较 (x±s,×104/L) |
|
|
对照+PBS组:肺泡隔膜正常,肺泡壁结构完整,肺泡间隔和支气管均未发现炎症渗出物;支气管形态规则,支气管内膜光滑,上皮细胞无明显增生,支气管和血管壁周围无明显炎性细胞浸润。对照+OVA组:肺泡壁增厚,肺泡空间缩小,肺泡间隙可见炎性细胞浸润;气道上皮细胞未融合,气道黏膜明显水肿,气道平滑肌增生增厚,支气管壁增厚,管腔狭窄,在管腔中观察到许多炎症分泌物,在支气管和血管壁周围观察到大量的炎性细胞浸润。IUGR+PBS组:肺泡组织结构及支气管组织结构特征与对照+PBS组基本相似。IUGR+OVA组:肺泡组织中呈现严重的炎性细胞浸润,肺泡壁增厚,肺泡空间缩小,肺泡上皮细胞肿大,细胞间连续性被破坏;气道上皮细胞增生,气道黏膜水肿,支气管壁增厚,管腔狭窄,在支气管和血管壁周围可见大量的炎性细胞浸润。见图 1。
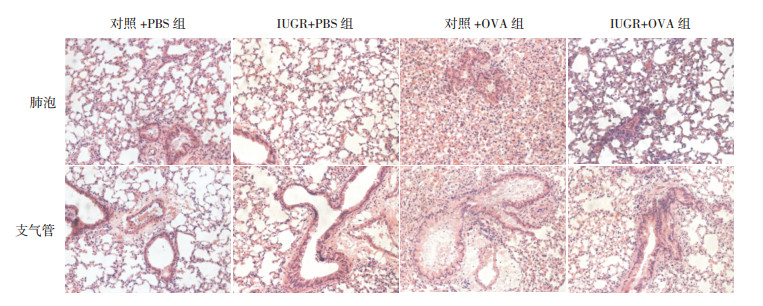
|
图 1 各组小鼠肺组织(肺泡及支气管)病理变化(苏木精-伊红染色,×200) 对照+PBS组及IUGR+PBS组肺泡结构正常;对照+OVA组肺泡壁增厚;IUGR+OVA组肺泡壁增厚,炎性细胞浸润。对照+PBS组及IUGR+PBS组支气管结构正常;对照+OVA组支气管壁增厚,炎性细胞浸润;IUGR+OVA组支气管壁增厚、狭窄,大量炎性细胞浸润。 |
本研究应用OVA诱导IUGR小鼠发生支气管哮喘,成功建立了IUGR哮喘动物模型,为研究小于胎龄儿肺功能降低及未来发生哮喘风险的机制提供了动物实验基础。建立IUGR合并哮喘动物模型,主要需要考虑3个方面。首先,需要选择兼顾IUGR和哮喘两种疾病的动物种系。本课题组曾应用Wistar大鼠和BALB/c小鼠进行预实验,为了更贴近IUGR发生哮喘的临床实践,后续进行转基因或基因敲除等进一步研究,本课题组选用BALB/c小鼠作为建立模型的动物品种。国内外建立IUGR动物模型多用Sprague-Dawley(SD)大鼠[10]和Wistar大鼠[11-12],而用于建立支气管哮喘模型常用BALB/c小鼠[13]、Brown-Norway(BN)大鼠[14]、豚鼠[15]等。Yue等[16]研究发现,暴露于NO2气体的BALB/c孕鼠的子代小鼠,更容易由OVA诱导发生哮喘。Wang等[17]研究发现,通过将BALB/c孕鼠置于低氧环境中,导致仔鼠发生IUGR,进而将子代BALB/c小鼠通过OVA诱导发生哮喘,与正常对照小鼠相比,发生IUGR的BALB/c小鼠表现出更强烈的气道高反应。结合本研究结果,可见BALB/c小鼠适合作为研究IUGR及哮喘相关机制的动物模型。
选好动物种系后,需要解决的第二个问题就是选择恰当的IUGR动物模型建立方法。本课题组既往成功的通过低蛋白饮食法建立了大鼠IUGR动物模型[18],同时应用IUGR大鼠模型进行了相关分子机制的研究[19-20],研究结果可靠,模型稳定。本研究选择低蛋白饮食法建立IUGR小鼠模型。低蛋白饮食法建立IUGR模型的关键问题是低蛋白饲料的获取,本研究结合既往的实验基础,参考国外IUGR小鼠动物模型建立的经验[21],应用20%正常蛋白饮食和8%低蛋白饮食进行研究,BALB/c小鼠经过不同蛋白含量的饲料喂养后,低蛋白饮食组新生小鼠在生后6 h体重显著低于正常蛋白饮食组,IUGR模型成功建立。国内外常用的IUGR模型制作方法包括酒精干预法、子宫动脉结扎法、低蛋白饮食法。高琳琳等[22]比较了这3种模型制作方法,提示低蛋白饮食建立的IUGR动物模型成功率高,死胎率低,而且亦能很好的模拟IUGR的病理生理过程。本研究结果提示,IUGR组小鼠血糖及胰岛素水平较对照组降低,提示IUGR小鼠糖原储备不足,胰岛素分泌水平较低。与本研究结果一致,Boehmer等[23]证实了鼠类和羊IUGR动物模型具有胰岛发育障碍和β细胞功能不全,IUGR动物模型表现为胰腺体积减少、β细胞数量减少和胰岛素分泌减少。Berends等[24]研究发现,宫内发育迟缓小鼠表现出中枢及外周胰岛素抵抗,其原因可能与其影响下丘脑胰岛素分泌的信号通路有关。
如何在IUGR模型基础上诱导发生哮喘是本研究需要解决的第三个问题。虽然国内建立哮喘小鼠动物模型的方法已较成熟,但缺乏在IUGR模型基础上建立哮喘动物模型的经验。本研究在BALB/c小鼠IUGR模型基础上,选择OVA腹腔注射致敏,然后雾化吸入OVA激发炎症反应,通过此种方法建立支气管哮喘模型。支气管哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞等)和细胞成分参与的气道慢性炎症性疾病,其典型的临床特征有气道炎症、气道重塑及气道高反应性[25]。因此,支气管哮喘模型成功的评价指标体现在肺泡灌洗液中嗜酸性粒细胞、淋巴细胞和巨噬细胞计数,以及肺组织肺泡及支气管病理形态的改变[26]。本研究结果提示,IUGR组小鼠经过OVA诱导后,IgE含量较IUGR组升高,肺泡灌洗液的炎症细胞明显增多,并且肺组织病理形态学改变显示肺泡及气道炎症,提示支气管哮喘模型建立成功。Chen等[27]通过小鼠雾化吸入OVA,成功的建立了支气管哮喘小鼠的气道炎症和高反应,肺泡灌洗液中炎症细胞明显增多。Zhang等[28]在OVA诱导的支气管哮喘小鼠模型中发现,除了肺泡灌洗液中炎症细胞增多以外,肺组织形态学提示明显的气道炎症反应。这些研究结果与本研究哮喘模型结果一致。
总之,本研究在低蛋白饮食法诱导的IUGR模型基础上采用雾化和腹腔注射OVA成功建立了IUGR-支气管哮喘合为一体的小鼠模型,为研究IUGR与气道炎症之间的分子机制建立了实验基础,亦为阐明IUGR发生支气管哮喘的可能分子机制奠定了实验室基础。
| [1] |
Swanson AM, David AL. Animal models of fetal growth restriction:considerations for translational medicine[J]. Placenta, 2015, 36(6): 623-630. DOI:10.1016/j.placenta.2015.03.003 (  0) 0) |
| [2] |
Sharma D, Sharma P, Shastri S. Genetic, metabolic and endocrine aspect of intrauterine growth restriction:an update[J]. J Matern Fetal Neonatal Med, 2017, 30(19): 2263-2275. DOI:10.1080/14767058.2016.1245285 (  0) 0) |
| [3] |
Salam RA, Das JK, Bhutta ZA. Impact of intrauterine growth restriction on long-term health[J]. Curr Opin Clin Nutr Metab Care, 2014, 17(3): 249-254. DOI:10.1097/MCO.0000000000000051 (  0) 0) |
| [4] |
Ronkainen E, Dunder T, Kaukola T, et al. Intrauterine growth restriction predicts lower lung function at school age in children born very preterm[J]. Arch Dis Child Fetal Neonatal Ed, 2016, 101(5): F412-F417. DOI:10.1136/archdischild-2015-308922 (  0) 0) |
| [5] |
Thangaratnarajah C, Dinger K, Vohlen C, et al. Novel role of NPY in neuroimmune interaction and lung growth after intrauterine growth restriction[J]. Am J Physiol Lung Cell Mol Physiol, 2017, 313(3): L491-L506. DOI:10.1152/ajplung.00432.2016 (  0) 0) |
| [6] |
Sonnenschein-van der Voort AM, Gaillard R, de Jongste JC, et al. Foetal and infant growth patterns, airway resistance and school-age asthma[J]. Respirology, 2016, 21(4): 674-682. DOI:10.1111/resp.12718 (  0) 0) |
| [7] |
关育红, 邢燕, 王新利, 等. 胎儿生长受限大鼠胰岛素敏感性的动态变化[J]. 中华围产医学杂志, 2011, 14(4): 221-226. DOI:10.3760/cma.j.issn.1007-9408.2011.04.007 (  0) 0) |
| [8] |
Woodall SM, Breier BH, Johnston BM, et al. A model of intrauterine growth retardation caused by chronic maternal undernutrition in the rat:effects on the somatotrophic axis and postnatal growth[J]. J Endocrinol, 1996, 150(2): 231-242. DOI:10.1677/joe.0.1500231 (  0) 0) |
| [9] |
Daubeuf F, Frossard N. Acute asthma models to ovalbumin in the mouse[J]. Curr Protoc Mouse Biol, 2013, 3(1): 31-37. DOI:10.1002/9780470942390.mo120202 (  0) 0) |
| [10] |
郑锐丹, 汪无尽, 应艳琴, 等. 生长追赶宫内发育迟缓大鼠早期糖脂代谢及脂肪细胞功能的改变[J]. 中国当代儿科杂志, 2012, 14(7): 543-547. (  0) 0) |
| [11] |
曲香, 贺宝平, 王华. 宫内发育迟缓对大鼠脑内NGF及TrkA表达影响的研究[J]. 中国当代儿科杂志, 2011, 13(5): 415-418. (  0) 0) |
| [12] |
Camprubí Camprubí M, Balada Caballé R, Ortega Cano JA, et al. Learning and memory disabilities in IUGR babies:functional and molecular analysis in a rat model[J]. Brain Behav, 2017, 7(3): e00631. (  0) 0) |
| [13] |
Li L, Hua L, He Y, et al. Differential effects of formaldehyde exposure on airway inflammation and bronchial hyperresponsiveness in BALB/c and C57BL/6 mice[J]. PLoS One, 2017, 12(6): e0179231. DOI:10.1371/journal.pone.0179231 (  0) 0) |
| [14] |
朱庆龄, 李锋, 王俊丽, 等. 经口食物过敏大鼠动物模型的建立[J]. 中国当代儿科杂志, 2016, 18(8): 757-761. (  0) 0) |
| [15] |
Kondo M, Tsuji M, Hara K, et al. Chloride ion transport and overexpression of TMEM16A in a guinea-pig asthma model[J]. Clin Exp Allergy, 2017, 47(6): 795-804. DOI:10.1111/cea.12887 (  0) 0) |
| [16] |
Yue H, Yan W, Ji X, et al. Maternal exposure of BALB/c mice to indoor NO2 and allergic asthma syndrome in offspring at adulthood with evaluation of DNA methylation associated Th2 polarization[J]. Environ Health Perspect, 2017, 125(9): 097011. DOI:10.1289/EHP685 (  0) 0) |
| [17] |
Wang KCW, Larcombe AN, Berry LJ, et al. Foetal growth restriction in mice modifies postnatal airway responsiveness in an age and sex-dependent manner[J]. Clin Sci (Lond), 2018, 132(2): 273-284. DOI:10.1042/CS20171554 (  0) 0) |
| [18] |
张金, 邢燕, 王新利, 等. 宫内发育迟缓致大鼠肝细胞胰岛素敏感性降低及体外胰岛素抵抗模型的建立[J]. 北京大学学报(医学版), 2014, 46(3): 464-468. DOI:10.3969/j.issn.1671-167X.2014.03.024 (  0) 0) |
| [19] |
邢燕, 关育红, 张金, 等. 肝脏组织磷脂酰肌醇-3激酶/蛋白激酶B信号通路参与降低胎儿生长受限大鼠的胰岛素敏感性[J]. 中华围产医学杂志, 2012, 15(12): 743-749. DOI:10.3760/cma.j.issn.1007-9408.2012.12.008 (  0) 0) |
| [20] |
邢燕, 齐婧, 王新利, 等. 肝脏过氧化物体增殖物激活受体γ基因启动子甲基化及其mRNA表达下调降低胎儿生长受限大鼠胰岛素敏感性[J]. 中华围产医学杂志, 2012, 15(11): 683-688. DOI:10.3760/cma.j.issn.1007-9408.2012.11.011 (  0) 0) |
| [21] |
Duran Fernandez-Feijoo C, Carrasco Carrasco C, Villalmazo Francisco N, et al. Influence of catch up growth on spatial learning and memory in a mouse model of intrauterine growth restriction[J]. PLoS One, 2017, 12(5): e0177468. DOI:10.1371/journal.pone.0177468 (  0) 0) |
| [22] |
高琳琳, 王军, 李子英, 等. 不同方法制备大鼠宫内发育迟缓模型的比较[J]. 中国比较医学杂志, 2018, 28(1): 1-7. DOI:10.3969/j.issn.1671-7856.2018.01.001 (  0) 0) |
| [23] |
Boehmer BH, Limesand SW, Rozance PJ. The impact of IUGR on pancreatic islet development and β-cell function[J]. J Endocrinol, 2017, 235(2): R63-R76. DOI:10.1530/JOE-17-0076 (  0) 0) |
| [24] |
Berends LM, Dearden L, Tung YCL, et al. Programming of central and peripheral insulin resistance by low birthweight and postnatal catch-up growth in male mice[J]. Diabetologia, 2018, 61(10): 2225-2234. DOI:10.1007/s00125-018-4694-z (  0) 0) |
| [25] |
Mims JW. Asthma:definitions and pathophysiology[J]. Int Forum Allergy Rhinol, 2015, 5: S2-S6. DOI:10.1002/alr.21609 (  0) 0) |
| [26] |
Daubeuf F, Frossard N. Eosinophils and the ovalbumin mouse model of asthma[J]. Methods Mol Biol, 2014, 1178: 283-293. (  0) 0) |
| [27] |
Chen WQ, Xie ZZ, Wang X, et al. Influences of PON1 on airway inflammation and remodeling in bronchial asthma[J]. J Cell Biochem, 2018, 119(1): 793-805. (  0) 0) |
| [28] |
Zhang Q, Wang L, Chen B, et al. Propofol inhibits NF-κB activation to ameliorate airway inflammation in ovalbumin (OVA)-induced allergic asthma mice[J]. Int Immunopharmacol, 2017, 51: 158-164. DOI:10.1016/j.intimp.2017.08.015 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


