肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)占儿童社区获得性肺炎的10%~40%,其中难治性肺炎支原体肺炎(refractory Mycoplasma pneumoniae pneumonia, RMPP)因病情较重,肺部病变范围较大、密度增高,合并肺不张、胸腔积液及坏死性肺炎等肺内表现,导致临床治疗比较棘手,常需气管镜干预治疗[1]。据文献报道,MPP患儿支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)细胞学分类以中性粒细胞升高、巨噬细胞下降为特征[2]。且发现轻度及重度MPP患儿急性期血清中半乳凝素-3(galectin-3)水平升高,表明半乳凝素-3可能与肺炎支原体(MP)感染导致的全身性或局灶性炎症损害相关[3]。但半乳凝素-3是否与儿童MP下呼吸道感染后中性粒细胞管腔内炎症浸润及巨噬细胞消耗相关尚未见报道。本研究旨在明确半乳凝素-3是否与MP感染后RMPP患儿气道细胞免疫炎症反应相关。
1 资料与方法 1.1 研究对象研究对象为2013年1月至2017年1月我院收治的RMPP患儿64例,均符合《儿童肺炎支原体肺炎诊治专家共识(2015年版)》中RMPP的诊断标准[1]。其中男43例,女21例,年龄3~11岁(平均4.4±1.1岁),体重18~42 kg(平均24±8 kg)。所有患儿均存在发热、咳嗽及胸片和/或肺部螺旋CT改变, 血清MP抗体滴度≥1 : 160。64例RMPP患儿在内科保守治疗的基础上,于入院后7~10 d(急性期)进行了首次气管镜下支气管肺泡灌洗术。64例患儿中,48例在入院14~21 d(恢复期)进行了第2次气管镜下支气管肺泡灌洗术。另外16例未进行第2次灌洗术,其中7例患儿首次气管镜术后3 d左右复查胸片提示肺部实变范围缩小 > 50%,继续给予内科保守治疗;9例患儿因经济、内心恐惧等原因未进行第2次手术。将本院同期收治的6例支气管异物患儿设为对照组,有明确的异物吸入史,病程 < 7 d,胸片或肺部螺旋CT提示未合并肺部感染。对照组患儿在性别、年龄方面与RMPP患儿的比较差异无统计学意义。
1.2 病例纳入及排除标准纳入标准:(1)年龄≥3岁;(2)符合RMPP诊断标准[1];(3)血清MP抗体滴度≥1 : 160和/或MP载量 > 1.0×103 copy/mL。
排除标准:(1)重症MPP[4];(2)存在肺炎链球菌、金黄色葡萄球菌及呼吸道病毒7项等其他病原体混合感染者;(3)既往存在支气管哮喘者;(4)存在先天性纤毛发育异常、囊性纤维化、支气管扩张症、弥漫性肺间质疾病及支气管肺发育异常等肺部基础疾病;(5)肺结核;(6)各种先天性心脏疾病。
1.3 标本采集本研究经我院医学伦理委员会批准。所有患儿行支气管肺泡灌洗术术前均由家长签署知情同意书。常规行心电图、凝血功能检查及乙肝、丙肝、梅毒、艾滋病等传染病筛查。术前禁食、禁水4~6 h。术前30 min肌注阿托品0.02~0.03 mg/kg及咪达唑仑0.05~0.10 μg/kg。选用Olympus BF30c-20纤维支气管镜,采用利多卡因“边麻边进”的方式依次通过声门、气管、隆突及叶支气管,将支气管镜嵌顿于病变侧叶、段或亚段支气管,37℃生理盐水5 mL/次局部灌洗,使用0.03~0.04 Kpa负压立即回抽液体,灌洗液回收率 > 40%。留取BALF 2 mL,送检计数中性粒细胞百分比等。另收集2 mL BALF,12 000 rpm低温离心5 min,以进行MP定量及半乳凝素-3水平的检测。
1.4 标本检测BALF采用单层纱布过滤去除黏液,离心后细胞沉渣行苏木素-伊红染色,进行计数细胞总数及中性粒细胞和巨噬细胞百分比。采用ELISA方法检测BALF上清中半乳凝素-3水平(试剂盒购自MultiScience公司)。采用RT-PCR检测BALF中MP载量。RT-PCR试剂盒由中山大学达安基因股份有限公司提供。PCR扩增采用美国ABI公司7900型PCR扩增仪。反应总体积为50 μL。反应管置ABI7500自动荧光检测仪。第一步,94℃ 2 min预变性;第2步,93℃ 45 s预变性,55℃ 1 min退火,共10个循环;第3步,93℃ 30 s变性,55℃ 45 s退火,共计30个循环。反应结束后电脑自动采集与分析结果。
1.5 统计学分析采用SPSS 20.0软件进行统计学分析。正态分布的定量资料使用均数±标准差(x±s)表示,两组间比较采用独立样本t检验,急性期与恢复期的比较采用配对t检验。非正态分布的计量资料采用中位数(范围)表示,组间比较采用Wilcoxon符号秩检验或Mann-Whitney U检验。两个指标间相关性评估采用Spearman相关分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 各组BALF中有核细胞、中性粒细胞及巨噬细胞百分比的比较RMPP组急性期有核细胞计数为1.6(0.8~2.3)×109/L,恢复期1.0(0.6~1.6)×109/L,对照组为0.7(0.4~1.2)×109/L。与对照组相比,BALF中中性粒细胞百分比在RMPP组急性期及恢复期均明显升高;与急性期相比,恢复期显著下降,差异具有统计学意义(P < 0.01)。与对照组相比,RMPP组急性期及恢复期巨噬细胞百分比均显著降低,差异具有统计学意义(P < 0.01);恢复期与急性期相比差异无统计学意义(P > 0.05)。见表 1和表 2。
| 表 1 RMPP组和对照组BALF中半乳凝素-3、MP载量及中性粒细胞、巨噬细胞百分比的比较 |
|
|
| 表 2 RMPP患儿急性期与恢复期BALF中半乳凝素-3、MP载量及中性粒细胞、巨噬细胞百分比的比较 |
|
|
与对照组相比,半乳凝素-3水平在RMPP组急性期及恢复期明显升高(表 1);与急性期相比,恢复期明显下降,差异具有统计学意义(P < 0.01),见表 2。
2.3 各组BALF中MP载量的比较与对照组相比,RMPP组急性期及恢复期BALF中MP载量明显升高(表 1);与急性期相比,恢复期显著下降(P < 0.01), 见表 2。
2.4 BALF中半乳凝素-3与MP载量及中性粒细胞和巨噬细胞百分比的相关性分析Spearman相关分析显示, RMPP患儿急性期半乳凝素-3水平与MP载量呈正相关(rs=0.789,P < 0.01)(图 1);半乳凝素-3水平与中性粒细胞百分比亦呈正相关(rs=0.726,P < 0.01)(图 1);半乳凝素-3水平与巨噬细胞百分比无明显相关性(rs=-0.24,P > 0.05)。
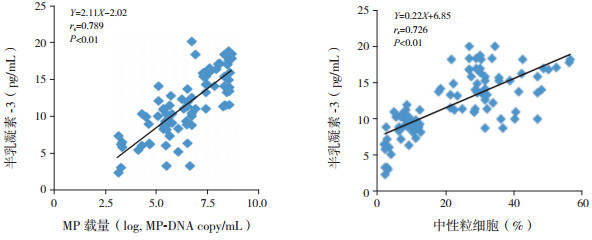
|
图 1 BALF中半乳凝素-3与MP载量及中性粒细胞百分比的相关性 |
半乳凝素-3是半乳凝素家族成员之一,可与细胞内糖蛋白、细胞表面分子以及细胞外基质作用,参与细胞粘附、增殖及凋亡等。半乳凝素-3与多种炎症反应相关,包括中性粒细胞的粘附和激活,单核细胞/巨噬细胞的化学趋化等[5-7]。本研究观察到RMPP患儿BALF中半乳凝素-3急性期和恢复期均明显高于异物组,恢复期较急性期下降,表明半乳凝素-3参与RMPP的炎症反应过程,并且可能会持续至RMPP恢复期后一段时间才能恢复至正常水平。
Saraya等[8]发现,MPP所致肺部损害可能受宿主细胞介导的免疫炎症反应水平的影响,同时Wang等[9]认为,RMPP常出现外周血中性粒细胞百分比及肺泡腔中中性粒细胞浸润明显增高,并与胸腔积液的发生及肺损伤的严重度相关。本研究发现,RMPP患儿急性期中性粒细胞百分比明显高于恢复期及异物组,考虑中性粒细胞参与了MP感染后急性期细胞免疫炎症反应过程,此发现与上述Wang等[9]报道相同。且随着疾病恢复,中性粒细胞数量逐渐下降,表明肺部炎症损伤得到控制。
半乳凝素-3被发现在肺炎链球菌肺部感染小鼠模型中起着白细胞募集的作用。与野生型(WT)小鼠相比,半乳凝素-3缺乏型小鼠在肺炎链球菌感染后出现更严重的肺炎,败血症和肺损伤的发生增加,且小鼠的肺泡内中性粒细胞募集减少,但肺匀浆髓过氧化物酶活性与WT小鼠相比没有减少[10]。这表明中性粒细胞在半乳凝素-3缺乏型小鼠肺炎期间在肺间质组织中积聚。分泌的半乳凝素-3可以交联细胞表面糖蛋白,激活多种先天免疫反应,如中性粒细胞中的呼吸爆发[5]。在没有半乳凝素-3的情况下,阻碍了中性粒细胞正常转移到肺泡腔而发挥免疫防御作用[11]。本研究发现,RMPP患儿急性期BALF中半乳凝素-3水平与中性粒细胞百分比呈高度正相关,但与巨噬细胞百分比之间无相关性,表明半乳凝素-3在MP感染导致的RMPP急性期具有促进中性粒细胞肺组织募集及肺泡腔内转移的作用,但可能对循环中单核细胞肺内趋化并转化为巨噬细胞无主导作用。
半乳凝素-3是由巨噬细胞及肺内Clara细胞所分泌的强大促炎因子[12],MP侵入下呼吸道后,主要靠巨噬细胞的吞噬作用所清除[13]。本研究显示,RMPP患儿BALF中半乳凝素-3水平与MP载量呈正相关。推测可能系MP感染刺激气道上皮细胞及巨噬细胞分泌半乳凝素-3,而半乳凝素-3进一步促进巨噬细胞活化以促进MP清除。但感染亦可造成巨噬细胞短期消耗。例如流感后肺泡巨噬细胞会暂时耗尽[14]。本研究发现,RMPP患儿急性期及恢复期BALF中巨噬细胞计数明显低于异物组,急性期及恢复期之间无显著差异。这提示MP感染可造成RMPP患儿短期内巨噬细胞大量消耗。
综上,本研究发现半乳凝素-3参与RMPP气道炎症反应过程,并且与中性粒细胞炎症部位趋化及管腔浸润密切相关。同时MP感染可诱发RMPP患儿急性期及恢复期肺泡腔内巨噬细胞消耗增加。本研究的不足之处为仅进行了RMPP临床BALF标本,未进行细胞水平及动物实验模型以进一步验证临床推测。下一步研究可使用MP刺激人Clara细胞,观察半乳凝素-3分泌水平,以及MP刺激半乳凝素-3缺乏型小鼠及WT小鼠,观察两类MPP模型鼠中性粒细胞及巨噬细胞管腔浸润、肺组织炎症损伤情况的差异及可能的作用机制。
| [1] |
中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童肺炎支原体肺炎诊治专家共识(2015年版)[J]. 中华实用儿科临床杂志, 2015, 30(17): 1304-1307. DOI:10.3760/cma.j.issn.2095-428X.2015.17.006 (  0) 0) |
| [2] |
Liu Y, Zhang X, Wang Y, et al. The role of granulocyte macrophage colony stimulating factor in hospitalized children with Mycoplasma pneumoniae pneumonia[J]. J Infect Chemother, 2018, 24(10): 789-794. DOI:10.1016/j.jiac.2018.06.003 (  0) 0) |
| [3] |
田芳, 韩波, 段梅. 肺炎支原体肺炎患儿血清TNF-α、IL-6及半乳凝素-3浓度测定的临床意义[J]. 中国当代儿科杂志, 2014, 16(10): 1001-1004. DOI:10.7499/j.issn.1008-8830.2014.10.009 (  0) 0) |
| [4] |
张晗, 尚云晓. 重症肺炎支原体肺炎早期识别[J]. 中国实用儿科杂志, 2015, 30(3): 176-179. (  0) 0) |
| [5] |
Nieminen J, St-Pierre C, Sato S. Galectin-3 interacts with naive and primed neutrophils, inducing innate immune responses[J]. J Leukoc Biol, 2005, 78(5): 1127-1135. DOI:10.1189/jlb.1204702 (  0) 0) |
| [6] |
Quenum Zangbede FO, Chauhan A, Sharma J, et al. Galectin-3 in M2 macrophages plays a protective role in resolution of neuropathology in brain parasitic infection by regulating neutrophil turnover[J]. J Neurosci, 2018, 38(30): 6737-6750. DOI:10.1523/JNEUROSCI.3575-17.2018 (  0) 0) |
| [7] |
de Oliveira FL, Gatto M, Bassi N, et al. Galectin-3 in autoimmunity and autoimmune diseases[J]. Exp Biol Med (Maywood), 2015, 240(8): 1019-1028. DOI:10.1177/1535370215593826 (  0) 0) |
| [8] |
Saraya T, Watanabe T, Tsukahara Y, et al. The correlation between chest X-ray scores and the clinical findings in children and adults with Mycoplasma pneumoniae pneumonia[J]. Intern Med, 2017, 56(21): 2845-2849. DOI:10.2169/internalmedicine.8500-16 (  0) 0) |
| [9] |
Wang M, Wang Y, Yan Y, et al. Clinical and laboratory profiles of refractory Mycoplasma pneumoniae pneumonia in children[J]. Int J Infect Dis, 2014, 29: 18-23. DOI:10.1016/j.ijid.2014.07.020 (  0) 0) |
| [10] |
Nieminen J, St-Pierre C, Bhaumik P, et al. Role of galectin-3 in leukocyte recruitment in a murine model of lung infection by Streptococcus pneumoniae[J]. J Immunol, 2008, 180(4): 2466-2473. (  0) 0) |
| [11] |
Farnworth SL, Henderson NC, Mackinnon AC, et al. Galectin-3 reduces the severity of pneumococcal pneumonia by augmenting neutrophil function[J]. Am J Pathol, 2008, 172(2): 395-405. (  0) 0) |
| [12] |
Lai JF, Zindl CL, Duffy LB, et al. Critical role of macrophages and their activation via MyD88-NFκB signaling in lung innate immunity to Mycoplasma pneumoniae[J]. PLoS One, 2010, 5(12): e14417. DOI:10.1371/journal.pone.0014417 (  0) 0) |
| [13] |
Maldonado CA, Sundblad V, Salatino M, et al. Cell-type specific regulation of galectin-3 expression by glucocorticoids in lung Clara cells and macrophages[J]. Histol Histopathol, 2011, 26(6): 747-759. (  0) 0) |
| [14] |
Ginhoux F, Jung S. Monocytes and macrophages:developmental pathway and tissue homeostasis[J]. Nat Rev Immunol, 2014, 14(6): 392-404. DOI:10.1038/nri3671 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21

