伴有IKZF1基因缺失的急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)患儿5年无事件生存(event-free survival, EFS)率仅70%左右,预后明显不如IKZF1基因正常ALL患儿[1]。Jia等[2]对15项临床研究进行Meta分析,结果显示IKZF1基因缺失是儿童ALL的独立预后不良因素。国外有学者报道,提高化疗强度可改善IKZF1基因缺失的ALL患儿预后[3-4]。但国内尚未报道提高化疗强度对伴IKZF1基因缺失ALL患儿预后的影响,2014年制订的儿童ALL诊疗建议(第四次修订)也未将IKZF1基因缺失作为危险度分型的依据[5]。本文通过观察提高化疗强度对24例伴IKZF1基因缺失ALL患儿生存率的影响,旨在探讨提高化疗强度是否可改善其预后。
1 资料与方法 1.1 研究对象收集2015年12月至2018年2月间在福建医科大学附属协和医院小儿血液科确诊并按照中国儿童白血病协作组(Chinese Children's Leukemia Group, CCLG)ALL 2008(CCLG-ALL 2008)方案规范治疗的ALL患儿为研究对象。
排除标准:在2个疗程化疗(诱导缓解+早期强化治疗)内出现任何原因所致死亡、疾病进展、复发等事件的ALL患儿。
共纳入278例患儿,其中男169例(60.8%),女109例(39.2%),确诊年龄4(0.75~14)岁。
1.2 IKZF1基因缺失的检测取ALL患儿骨髓3~5 mL,EDTA抗凝,采用多重连接探针扩增(multiplex ligation-dependent probe amplification, MLPA)技术检测IKZF1基因有无大片段缺失情况来判断该基因是否存在突变型异构体。
1.3 诊断标准及临床危险度分型诊断标准及临床危险度分型(IKZF1基因缺失不作为危险度分型依据)参照CCLG-ALL 2008方案[5],分为低危(low risk, LR)、中危(intermediate risk, IR)及高危(high risk, HR)。所有患儿采用流式细胞术检测微小残留病(minimal residual disease, MRD)水平,除了诊疗建议要求的诱导缓解治疗末(第33天)及巩固治疗开始前进行MRD检测外,新增诱导缓解治疗第15天作为MRD检测点,并将其作为MRD分型依据。MRD标危(MRD-SR):第15天MRD < 10-2且第33天、巩固治疗前MRD均 < 10-4。MRD中危(MRD-IR):10-2≤第15天MRD < 10-1,和/或10-4≤第33天MRD < 10-2,和/或10-4≤巩固治疗前MRD < 10-3。MRD-高危(MRD-HR):第15天MRD≥10-2,和/或第33天MRD≥10-4,和/或巩固治疗前MRD≥10-3。
1.4 分组及化疗方案根据有无IKZF1基因缺失将278例患儿分为:IKZF1基因缺失组(n=24)和IKZF1基因正常组(n=254)。所有IKZF1基因缺失组ALL患儿,无论有无其他危险因素,均接受CCLG-ALL 2008 HR方案化疗;8例伴Ph染色体阳性患儿,加达沙替尼治疗。IKZF1基因正常组则根据初诊危险因素及早期疗效评估划分临床危险度分型,相应接受LR、IR、HR方案化疗。
1.5 随访截至2018年9月30日,随访时间18.5(0.9~35.5)个月。总体生存(overall survival, OS)期为患者诊断至死亡或最后随访的时间;EFS期为诊断到发生任何事件的时间,包括任何原因所致死亡、疾病进展、复发或失访。IKZF1基因缺失组无失访病例,IKZF1基因正常组有3例(1.2%)失访,其生存期均计算至末次随访日期。
1.6 统计学分析采用SPSS 21.0软件进行数据处理。正态分布计量资料用均数±标准差(x±s)表示,非正态分布计量资料用中位数(范围)表示。计数资料采用百分比(%)表示,组间比较采用χ2检验。两组生存曲线比较采用Kaplan-Meier法,并行log-rank检验。P < 0.05为差异有统计学意义。
2 结果 2.1 MLPA检测结果278例患儿中,共24例检测到IKZF1基因外显子大片段缺失,缺失率为8.6%。具体外显子缺失情况如下:1~8号外显子杂合缺失10例(42%),4~7号杂合缺失9例(38%),2~7号杂合缺失3例(12%),4~6号及1~6号杂合缺失各1例(4%)。在不同亚型ALL中的IKZF1基因外显子缺失率不同,以BCR-ABL1融合基因阳性的ALL最高(67%),其次为无融合基因阳性及重现性染色体异常的B细胞型ALL(11%),见表 1。
| 表 1 不同亚型ALL中的IKZF1基因外显子缺失情况 |
|
|
两组的性别、年龄、泼尼松诱导反应差异无统计学意义(P > 0.05),但IKZF1基因缺失组的初诊时WBC≥50×109/L、BCR-ABL1融合基因阳性、诱导缓解治疗第15天MRD≥10%、MRD-HR及临床危险度-HR所占比例均明显高于IKZF1基因正常组(P < 0.05)。见表 2。
| 表 2 IKZF1基因缺失组和IKZF1基因正常组的临床特征比较 [n(%)] |
|
|
IKZF1基因缺失组中,3例(12%)复发,2例(8%)因化疗相关并发症死亡;IKZF1基因正常组,18例(7.1 %)复发,12例(4.7%)因化疗相关并发症死亡。
IKZF1基因缺失组3年EFS率为76%±10%,其中,BCR-ABL1融合基因阳性与阴性患儿3年EFS率差异无统计学意义(70%±18% vs 79%±11%,P=0.73)。IKZF1基因缺失组与IKZF1基因正常组总体3年EFS率差异无统计学意义(76%±10% vs 84%±4%,P=0.282);临床危险度- HR中,IKZF1基因缺失组与IKZF1基因正常组3年EFS率差异无统计学意义(71%±14% vs 74%±6%,P=0.953);临床危险度-非HR,IKZF1基因缺失组与IKZF1基因正常组3年EFS率差异无统计学意义(82%±12% vs 86%±5%,P=0.436)。见图 1。
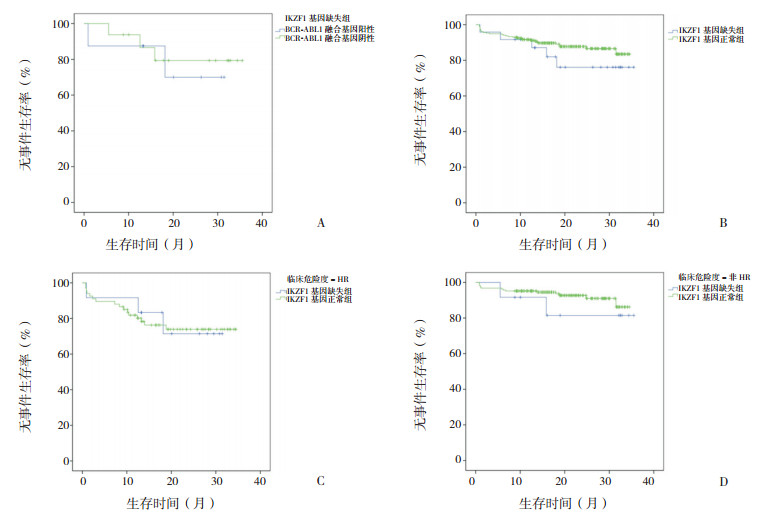
|
图 1 各组患儿3年无事件生存(EFS)率比较 图A示IKZF1基因缺失组中BCR-ABL1融合基因阳性与BCRABL1融合基因阴性患儿的3年EFS率差异无统计学意义;图B示IKZF1基因缺失组和IKZF1基因正常组的3年EFS率差异无统计学意义;图C示临床危险度-HR中IKZF1基因缺失组和IKZF1基因正常组的3年EFS率差异无统计学意义;图D示临床危险度-非HR中IKZF1基因缺失组和IKZF1基因正常组的3年EFS率差异无统计学意义。 |
人类的IKZF1基因位于7p12,共有8个外显子,其编码的Ikaros蛋白属锌指蛋白家族成员,是一种极为重要的造血转录调控因子,尤其在淋巴系统造血方面发挥关键性调控作用;IKZF1基因失活导致Ikaros蛋白功能下降或丧失,影响淋巴系统造血调控[6]。研究表明,IKZF1基因异常在白血病发病机制及复发进展中起关键作用,并可通过调控不同的信号途径和直接作用于糖皮质激素靶基因介导B细胞型ALL对糖皮质激素耐药以及BCR-ABL1融合基因阳性ALL对酪氨酸激酶抑制剂的耐药[7-9]。大约30%的儿童B细胞型ALL有IKZF1基因的失活,其中约7%为插入、移码或错义突变,其余大部分为缺失[9-10]。IKZF1基因缺失以外显子1~8及2~7缺失最常见,外显子2~3、2~7、2~8、4~8等则较为少见[11]。
IKZF1基因外显子缺失在儿童B细胞型ALL中的检出率为12%~15%,在不同亚型的儿童ALL均可检出:BCR-ABL1融合基因阳性ALL为66%~76.2%,BCR/ABL1样ALL约70%,TCF3基因重排约3%,MLL基因重排约5%,T细胞型ALL约4%,超二倍体及不伴有重现性染色体及融合基因的B细胞型ALL为15%~20%,BCR-ABL1融合基因阴性的ALL约7%,ETV6/RUNX1基因阳性ALL约3%[1, 9, 12-15]。本研究中,IKZF1基因缺失在各亚型ALL的检出率与报道接近,但总体检出率为8.6%,低于报道,可能的主要原因为入组患儿的年龄不同:本研究入组病例年龄为0~14岁,而报道中入组病例的年龄多为0~18岁,而IKZF1基因缺失检出率与年龄有明显相关性,在年龄≥10岁患儿的比例高于年龄在1~10岁患儿[1, 16]。
临床研究显示,IKZF1基因缺失往往伴随初诊时更高的WBC、年龄更大、治疗后MRD更高、BCR-ABL1融合基因阳性、CRLF2基因重排等危险因素,但多因素分析显示IKZF1基因缺失仍为儿童ALL预后不良最强的独立预测因素之一[1-3, 9, 11, 17]。那提高化疗强度可否改善伴IKZF1基因缺失ALL患儿的预后呢?国外已有报道,提高化疗强度可改善伴IKZF1基因缺失ALL患儿的预后。欧洲癌症治疗研究组织(EORTC)临床试验显示,伴IKZF1基因缺失的ALL患儿在强化治疗中增加脉冲式长春新碱-类固醇激素化疗次数,无进展生存(progression-free survival, PFS)率及OS率均明显提高[3]。Yeoh等报道[4],一组为59例伴IKZF1基因缺失的ALL患者,不将IKZF1基因缺失作为危险度分型依据,按照原来危险度分型治疗(马来西亚-新加坡ALL 2003研究,MS-2003);另一组为50例伴IKZF1基因缺失的ALL患者,将IKZF1基因缺失作为危险度分型依据,提高一个危险度分型治疗,对伴有BCR-ABL1融合基因阳性,加用伊马替尼治疗(马来西亚-新加坡ALL 2010研究,MS-2010);MS-2010组的5年OS率为91.6%,显著高于MS-2003组的69.6%,表明提高化疗强度,可降低伴IKZF1基因缺失ALL患儿的复发率,提高远期疗效。Volejnikova等[15]报道,单独以IKZF1基因缺失作为危险因素或联合诱导治疗第15天MRD结果调整化疗强度,可更好的危险度分型,提高总体的远期生存率。以上研究表明,伴IKZF1基因缺失的ALL患儿或许可通过提高化疗强度改善预后。
在本组病例中,IKZF1基因缺失组的初诊时WBC≥50×109/L、BCR-ABL1融合基因阳性、诱导缓解治疗第15天MRD≥10%、MRD-HR及临床危险度-HR所占比例均显著高于IKZF1基因正常组,这与文献报道相符合[1-3, 9, 11, 17]。在伴IKZF1基因缺失的病例中,如果按CCLG-2008 ALL方案的临床危险度分型依据,而未将IKZF1基因缺失作为危险度分型依据,有12例患儿为非HR(LR 5例,IR 7例),这部分患儿均接受CCLG-ALL 2008 HR方案化疗,实际上提高了整体的化疗强度。经以上方案的调整,IKZF1基因缺失组3年EFS率为76%±10%,与IKZF1基因正常组比较差异无统计学意义。IKZF1基因缺失组-HR、非HR(实际上提高了化疗强度)的3年EFS率接近IKZF1基因正常组-HR、非HR。以上结果表明,提高化疗强度可能改善伴IKZF1基因缺失儿童ALL的整体预后,但因病例数较少,随访时间较短,仍需累积病例并延长随访时间明确。
在伴IKZF1基因缺失的ALL患儿中,其预后也有所差异。Boer等报道[11],在伴有IKZF1基因缺失的儿童ALL中,少见的缺失类型(外显子2~3、2~7、2~8、4~8缺失)的预后差于常见的缺失类型(外显子1~8、4~7缺失)。Volejnikova等[15]报道,在伴IKZF1基因缺失的儿童BCR-ABL1融合基因阴性ALL中,诱导治疗第15天MRD≥10%组的预后显著低于MRD < 10%组。Stanulla等[18]报道,在伴有IKZF1基因缺失的儿童ALL中,同时伴有CDKN2A、CDKN2B、PAX5或PAR1基因缺失组的5年EFS率显著低于不伴有以上基因缺失。以上研究表明,伴IKZF1基因缺失的儿童ALL可同时存在其他的危险因素,或许还可进一步危险度分型治疗。
总之,伴有IKZF1基因缺失的儿童ALL初诊时往往同时有更多的危险因素,早期治疗反应较差,提高化疗强度,可改善该亚型ALL的预后。
| [1] |
Dörge P, Meissner B, Zimmermann M, et al. IKZF1 deletion is an independent predictor of outcome in pediatric acute lymphoblastic leukemia treated according to the ALL-BFM 2000 protocol[J]. Haematologica, 2013, 98(3): 428-432. DOI:10.3324/haematol.2011.056135 (  0) 0) |
| [2] |
Jia M, Wang ZJ, Li JY, et al. The impact of IKZF1 deletion on the prognosis of acute lymphoblastic leukemia:an updated meta-analysis[J]. Cancer Biomark, 2014, 14(6): 493-503. (  0) 0) |
| [3] |
Clappier E, Grardel N, Bakkus M, et al. IKZF1 deletion is an independent prognostic marker in childhood B-cell precursor acute lymphoblastic leukemia, and distinguishes patients benefiting from pulses during maintenance therapy:results of the EORTC Children's Leukemia Group study 58951[J]. Leukemia, 2015, 29(11): 2154-2161. DOI:10.1038/leu.2015.134 (  0) 0) |
| [4] |
Yeoh AEJ, Lu Y, Chin WHN, et al. Intensifying treatment of childhood B-lymphoblastic leukemia with IKZF1 deletion reduces relapse and improves overall survival:results of Malaysia-Singapore ALL 2010 Study[J]. J Clin Oncol, 2018, 36(26): 2726-2735. DOI:10.1200/JCO.2018.78.3050 (  0) 0) |
| [5] |
中华医学会儿科学分会血液学组, 《中华儿科杂志》编辑委员会. 儿童急性淋巴细胞白血病诊疗建议(第四次修订)[J]. 中华儿科杂志, 2014, 52(9): 641-644. DOI:10.3760/cma.j.issn.0578-1310.2014.09.001 (  0) 0) |
| [6] |
Olsson L, Johansson B. Ikaros and leukaemia[J]. Br J Haematol, 2015, 169(4): 479-491. DOI:10.1111/bjh.13342 (  0) 0) |
| [7] |
Marke R, Havinga J, Cloos J, et al. Tumor suppressor IKZF1 mediates glucocorticoid resistance in B-cell precursor acute lymphoblastic leukemia[J]. Leukemia, 2016, 30(7): 1599-1603. DOI:10.1038/leu.2015.359 (  0) 0) |
| [8] |
Churchman ML, Low J, Qu C, et al. Efficacy of retinoids in IKZF1-mutated BCR-ABL1 acute lymphoblastic leukemia[J]. Cancer Cell, 2015, 28(3): 343-356. DOI:10.1016/j.ccell.2015.07.016 (  0) 0) |
| [9] |
Marke R, van Leeuwen FN, Scheijen B. The many faces of IKZF1 in B-cell precursor acute lymphoblastic leukemia[J]. Haematologica, 2018, 103(4): 565-574. (  0) 0) |
| [10] |
Martinelli G, Iacobucci I, Storlazzi CT, et al. IKZF1(Ikaros) deletions in BCR-ABL1-positive acute lymphoblastic leukemia are associated with short disease-free survival and high rate of cumulative incidence of relapse:a GIMEMA AL WP report[J]. J Clin Oncol, 2009, 27(31): 5202-5207. DOI:10.1200/JCO.2008.21.6408 (  0) 0) |
| [11] |
Boer JM, van der Veer A, Rizopoulos D, et al. Prognostic value of rare IKZF1 deletion in childhood B-cell precursor acute lymphoblastic leukemia:an international collaborative study[J]. Leukemia, 2016, 30(1): 32-38. DOI:10.1038/leu.2015.199 (  0) 0) |
| [12] |
Mullighan CG, Su X, Zhang J, et al. Deletion of IKZF1 and prognosis in acute lymphoblastic leukemia[J]. N Engl J Med, 2009, 360(5): 470-480. DOI:10.1056/NEJMoa0808253 (  0) 0) |
| [13] |
Mullighan CG, Miller CB, Radtke I, et al. BCR-ABL1 lymphoblastic leukaemia is characterized by the deletion of Ikaros[J]. Nature, 2008, 453(7191): 110-114. DOI:10.1038/nature06866 (  0) 0) |
| [14] |
Iacobucci I, Storlazzi CT, Cilloni D, et al. Identification and molecular characterization of recurrent genomic deletions on 7p12 in the IKZF1 gene in a large cohort of BCR-ABL1-positive acute lymphoblastic leukemia patients:on behalf of Gruppo Italiano Malattie Ematologiche dell'Adulto Acute Leukemia Working Party (GIMEMA AL WP)[J]. Blood, 2009, 114(10): 2159-2167. DOI:10.1182/blood-2008-08-173963 (  0) 0) |
| [15] |
Volejnikova J, Mejstrikova E, Dörge P, et al. Ikaros (IKZF1) alterations and minimal residual disease at day 15 assessed by flow cytometry predict prognosis of childhood BCR/ABL-negative acute lymphoblastic leukemia[J]. Pediatr Blood Cancer, 2013, 60(3): 420-427. DOI:10.1002/pbc.v60.3 (  0) 0) |
| [16] |
Górniak P, Pastorczak A, Zalewska-Szewczyk B, et al. Polymorphism in IKZF1 gene affects age at onset of childhood acute lymphoblastic leukemia[J]. Leuk Lymphoma, 2014, 55(9): 2174-2178. DOI:10.3109/10428194.2013.866661 (  0) 0) |
| [17] |
Olsson L, Ivanov Öfverholm I, Norén-Nyström U, et al. The clinical impact of IKZF1 deletions in paediatric B-cell precursor acute lymphoblastic leukaemia is independent of minimal residual disease stratification in Nordic Society for Paediatric Haematology and Oncology treatment protocols used between 1992 and 2013[J]. Br J Haematol, 2015, 170(6): 847-858. DOI:10.1111/bjh.2015.170.issue-6 (  0) 0) |
| [18] |
Stanulla M, Dagdan E, Zaliova M, et al. IKZF1plus defines a new minimal residual disease-dependent very-poor prognostic profile in pediatric B-cell precursor acute lymphoblastic leukemia[J]. J Clin Oncol, 2018, 36(12): 1240-1249. DOI:10.1200/JCO.2017.74.3617 (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


