2. 潍坊医学院附属医院儿科, 山东 潍坊 261053
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是一种儿科常见病,且近年来在发展中国家的发病率有所上升[1],HIE可导致多种后遗症,给国家和社会带来沉重负担[2]。因此,寻找HIE有效的治疗方案具有重要意义。研究表明,激活内源性神经干细胞(neural stem cells, NSCs)的增殖,可促进神经再生,有助于损伤后神经修复,具有神经保护作用[3]。褪黑素是松果体分泌的一种神经保护剂,可通过血脑屏障治疗中枢神经系统疾病[4-5]。本课题组前期研究发现,单剂量即刻褪黑素治疗(single dose immediate treatment, SDIT)可促进脑缺血再灌注损伤大鼠内源性NSCs增殖[6],但其对缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)新生大鼠脑NSCs的影响尚未见报道,鉴于新生大鼠脑NSCs在外界刺激后可激活,且具有较强的神经再生能力,推测褪黑素极有可能促进HIBD新生大鼠内源性NSCs增殖。另有研究发现7日连续褪黑素治疗(7 days continuous treatment, 7DCT)可减轻局灶性脑缺血损伤[7],但7DCT对新生大鼠HIBD的影响尚未见报道,且SDIT与7DCT两种方案治疗HIBD新生大鼠疗效的差异尚未阐明,故本研究通过观察SDIT与7DCT两种不同褪黑素治疗方案对新生大鼠HIBD及内源性NSCs增殖的影响,以期寻求褪黑素治疗HIBD的较优方案,为褪黑素治疗的临床应用提供科学的理论依据。
1 材料与方法 1.1 实验动物及分组96只健康7日龄Sprague-Dawley(SD)新生大鼠,雌雄不限,平均体重11.9±1.4 g,由山东省济南朋悦实验动物繁育有限公司提供,许可证号:SCXK(鲁)20140007。采用随机数字表法随机分为正常对照组、HIBD组、SDIT组及7DCT组(n=24)。每组再分为造模后7 d(n=16)、28 d(n=8)两个亚组,7 d亚组行组织学(n=8)与Western blot检测(n=8),28 d亚组行苏木精-伊红(HE)与尼氏染色(n=8)。正常对照组不予任何处理,SDIT组于HIBD后30 min,按10 mg/kg剂量行腹腔注射褪黑素(美国Sigma公司),7DCT组于HIBD后30 min,给予10 mg/kg剂量褪黑素腹腔注射,连续腹腔注射褪黑素7 d,每天1次。
1.2 新生大鼠HIBD模型的制作采用经典Rice-Vannucci法建立HIBD大鼠模型[8],乙醚吸入麻醉,剪开颈部皮肤并分离出右侧颈总动脉,电凝笔(美国Roboz公司)电凝右侧颈总动脉,放入低氧舱(武汉七0一研究所)内缺氧2 h后再放置于母鼠笼中喂养,舱内氧气浓度为8%±0.01%。
1.3 标本的收集各组分别在造模后7 d、28 d取新生大鼠,腹腔注射10%水合氯醛麻醉后,断头取脑,4%多聚甲醛固定过夜,常规方法包埋,石蜡切片机(Shanton公司,英国)行冠状位切片,每4~5张脑组织切片取1张,厚度约为5 μm。
1.4 PCNA/Nestin/DAPI免疫荧光双重染色HIBD后7 d,各组取8只大鼠脑组织,每个脑组织随机取5~6张切片,石蜡切片脱蜡至水,热修复抗原,正常山羊血清封闭后,弃掉封闭液,加入鼠抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA,北京中杉金桥生物技术有限公司,1 : 100)与兔抗巢蛋白(Nestin,武汉博士德生物工程有限公司,1 : 75)一抗混合液,4℃孵育过夜。次日,0.01 mol/L磷酸盐缓冲液(PBS)洗涤后,滴加Alexa Fluor 488标记的山羊抗兔IgG(1 : 100)和Alexa Fluor 594标记的山羊抗鼠IgG(1 : 100)荧光二抗(北京中杉金桥生物技术有限公司)混合液,37℃避光孵育1 h后,0.01 mol/L PBS冲洗,含6-二脒基-2-苯基吲哚(4' , 6-diamidino-2-phenylindole,DAPI)的荧光封片剂(北京中杉金桥生物技术有限公司)封片。每张切片随机取5个视野,研究级正置荧光显微镜(日本Olympus公司)下观察、拍照并计数脑组织海马齿回状(dentate gyrus, DG)区和侧脑室室管膜下区(subventricular zone, SVZ)PCNA+Nestin+DAPI+细胞数。
1.5 苏木精-伊红染色HIBD后28 d,各组取大鼠脑组织切片,石蜡切片脱蜡至水,苏木素(上海碧云天生物技术有限公司)染核1~2 min,双蒸水冲洗后盐酸乙醇分色,再次冲洗后滴加1%伊红染料1~2 min。70%、80%乙醇中浸泡数秒后置于无水乙醇中脱水5 min,二甲苯Ⅰ、二甲苯Ⅱ中透明10 min,中性树胶封片。正置于光学显微镜下观察各组大鼠海马CA1区组织病理学改变并拍照。
1.6 尼氏染色HIBD后28 d,各组取8只大鼠脑组织,每个脑组织随机取5~6张切片。石蜡切片脱蜡至水,滴加0.1%甲苯胺蓝后放入60℃烤箱孵育1~2 min,双蒸水冲洗,依次70%、80%、95%乙醇中浸泡数秒,镜下观察细胞核呈淡蓝色后放入无水乙醇脱水,二甲苯透明,中性树胶封片。正置光学显微镜下观察,每张切片随机选取5个视野,计数脑组织海马CA1区锥体细胞数。
1.7 Western blot检测蛋白表达HIBD后7 d,各组大鼠经腹腔注射10%水合氯醛麻醉后,生理盐水灌注取脑,取每只大鼠右侧前囟前1.0~-4.5 mm新鲜脑组织,加入组织裂解液提取总蛋白并进行蛋白浓度测定,取60 μg蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜,5%脱脂奶粉封闭1 h,分别加入兔抗Nestin(1 : 1 000)、鼠抗GAPDH(内参,美国Cell Signaling Technology公司,1 : 2 000)一抗后,4℃孵育过夜。次日,0.01 mol/L的PBS液洗膜后,分别加入山羊抗兔或山羊抗鼠二抗,室温孵育1 h,电化学发光(enhanced chemiluminescence, ECL,美国Thermo公司)法显色,化学发光凝胶成像系统(美国ProteinSimple公司)曝光并拍照,计算Nestin与GAPDH光密度的比值作为Nestin蛋白的相对表达量,并行统计学分析。
1.8 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
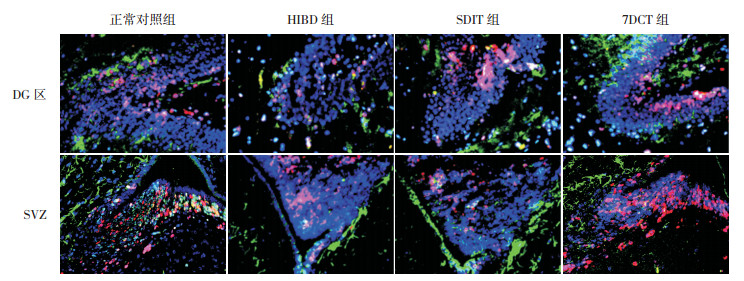
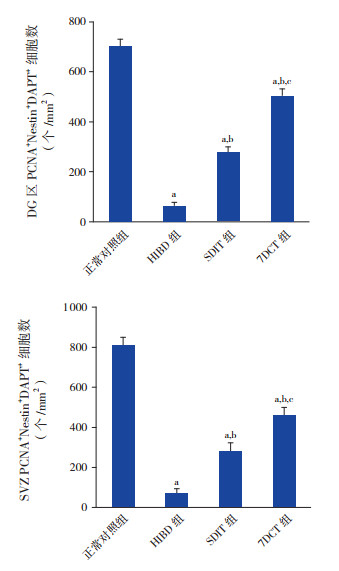
2 结果 2.1 不同褪黑素治疗方案对HIBD新生大鼠脑组织DG区及SVZ内源性NSCs增殖的影响HIBD后7 d,正常对照组脑组织DG区及SVZ均有大量PCNA+Nestin+DAPI+细胞数表达;HIBD组脑组织DG区及SVZ PCNA+Nestin+DAPI+细胞数较正常对照组明显减少(P < 0.01);SDIT组及7DCT组脑组织DG区及SVZ PCNA+Nestin+DAPI+细胞数均较HIBD组明显增多,但仍少于正常对照组(P < 0.01),且7DCT组脑组织DG区及SVZ PCNA+Nestin+DAPI+细胞数多于SDIT组(P < 0.01)。见图 1~2。
|
图 1 不同褪黑素治疗方案对大鼠脑组织DG区及SVZ PCNA+Nestin+DAPI+细胞数表达的影响(免疫荧光染色,×400) PCNA标记增殖细胞,胞核染为红色;Nestin为神经丝蛋白,胞质染为绿色;DAPI标记所有细胞核,核染为蓝色;PCNA+Nestin+DAPI+细胞为增殖的神经干细胞。正常对照组脑组织DG区及SVZ均可见大量PCNA+Nestin+DAPI+细胞,HIBD组阳性细胞较少,SDIT组和7DCT组阳性细胞均较HIBD组增加,且7DCT组较SDIT组增加更显著。 |
|
图 2 各组大鼠脑组织DG区及SVZ PCNA+Nestin+DAPI+细胞数比较(n=8) a示与正常对照组比较,P < 0.01;b示与HIBD组比较,P < 0.01;c示与SDIT组比较,P < 0.01。 |
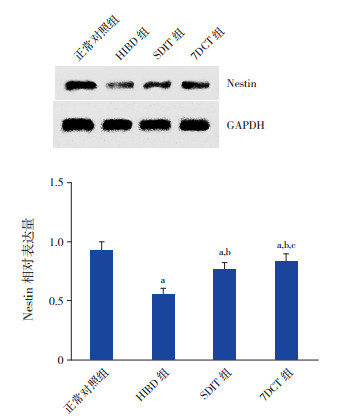
HIBD后7 d,正常对照组见大量Nestin蛋白表达,HIBD组Nestin蛋白的表达明显下降,且显著低于正常对照组(P < 0.01);SDIT与7DCT组Nestin蛋白的表达均较HIBD组升高(P < 0.01),但仍低于正常对照组(P < 0.05),且7DCT组Nestin蛋白的表达显著高于SDIT组(P < 0.05)。见图 3。
|
图 3 不同褪黑素治疗方案对Nestin蛋白表达的影响 上图为各组Nestin蛋白表达的Western blot条带图。下图为各组Nestin蛋白相对表达水平比较柱形图(n=8),a示与正常对照组比较,P < 0.05;b示与HIBD组比较,P < 0.05;c示与SDIT组比较,P < 0.05。 |
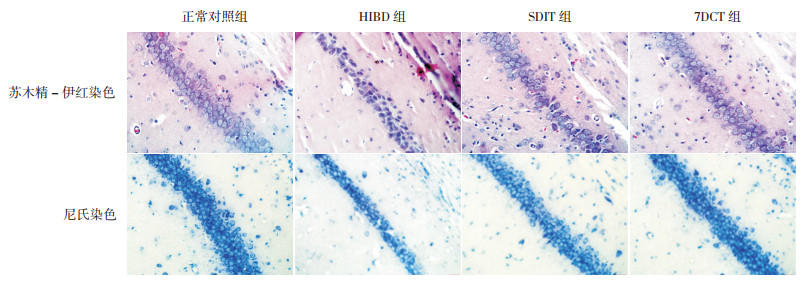
HIBD后28 d,正常对照组新生大鼠海马CA1区锥体细胞数目多,细胞排布整齐、规则,细胞形态及结构正常;HIBD组海马CA1区锥体细胞数目少,细胞排布稀疏、紊乱,细胞形态大小不一;SDIT组及7DCT组海马CA1区锥体细胞均排列较规则,细胞形态及结构均较正常,但锥体细胞数目仍均少于正常对照组。见图 4。
|
图 4 不同褪黑素治疗方案对海马CA1区的影响 苏木精-伊红染色(×400)结果:正常对照组细胞形态规则、排列整齐;HIBD组细胞形态不规则、排列紊乱;SDIT组细胞形态较规则、排列有序;7DCT组细胞排列规则,细胞形态及结构较正常。尼氏染色(×400)结果:正常对照组见大量锥体细胞;HIBD组锥体细胞数较少;SDIT组与7DCT组锥体细胞数均显著多于HIBD组,且7DCT组显著多于SDIT组。 |
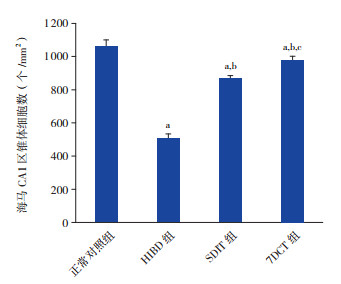
HIBD后28 d,正常对照组新生大鼠海马CA1区锥体细胞数量最多,排布整齐,细胞大且圆;HIBD组海马CA1区锥体细胞数量最少,排布无规律,形态不规则,锥体细胞数目显著少于正常对照组(P < 0.01);SDIT组及7DCT组海马CA1区锥体细胞排列较整齐,形态较规则,锥体细胞数量均显著多于HIBD组(P < 0.01),但仍少于正常对照组(P < 0.05),且7DCT组锥体细胞数量多于SDIT组(P < 0.05)。见图 4~5。
|
图 5 各组大鼠海马CA1区锥体细胞数比较(n=8) a示与正常对照组比较,P < 0.05;b示与HIBD组比较,P < 0.01;c示与SDIT组比较,P < 0.05。 |
HIE严重威胁着新生儿的生命,是科学工作者研究的重点[9]。褪黑素作为一种神经保护剂,有研究发现褪黑素SDIT方案治疗可减轻新生大鼠的HIBD[10],还有研究发现褪黑素SDIT方案治疗可减轻成年大鼠的脑缺血再灌注损伤[11]。对于新生儿而言,缺氧、缺血所导致的弥漫性脑损伤与成年人局灶性脑缺血再灌注不同,局灶性脑缺血再灌注损伤治疗时间窗较短,SDIT可达到最佳治疗效果,但新生儿的大脑正处于发育过程中,具有更强的再生潜能,与SDIT相比,我们推测7DCT更能促进HIBD新生大鼠内源性NSCs增殖,且7DCT与实际临床治疗方式贴合更加紧密。故本研究比较SDIT与7DCT两种不同褪黑素治疗方案对HIBD新生大鼠的影响,以期为褪黑素治疗HIE提供科学的理论依据。
神经再生是新生儿HIBD后神经修复的重要基础。NSCs在脑内终生存在,主要见于DG区和SVZ[12]。本研究利用Nestin/PCNA免疫荧光双重标记增殖的NSCs,发现HIBD后7 d,HIBD组脑组织DG区及SVZ均可见少量增殖的NSCs,提示HIBD本身可促进HIBD新生大鼠内源性NSCs的增殖,但由于HIBD导致脑内微环境改变,NSCs的增殖能力是有限的,褪黑素能否放大内源性NSCs的增殖,以及SDIT与7DCT两种治疗方案疗效的差别是本研究的重点。本研究发现:SDIT组及7DCT组脑组织DG区及SVZ增殖的NSCs均较HIBD组增多,但均仍少于正常对照组,表明SDIT与7DCT方案均可以促进DG区与SVZ内源性NSCs的增殖,提示褪黑素可促进内源性NSCs的增殖,放大内源性神经再生;同时,本研究还发现7DCT组DG区及SVZ的NSCs增殖比SDIT组增加更显著,提示7DCT方案更亦促进内源性NSCs的增殖。为验证本推测,本研究采用Western blot法观察SDIT与7DCT方案对Nestin蛋白表达的影响,发现两种褪黑素治疗方案均对NSCs具有神经保护作用,且7DCT对NSCs的保护作用更佳,其机制可能与褪黑素促进HIBD新生大鼠内源性NSCs的增殖有关,具体机制目前正在进一步的研究当中。
海马是与学习记忆相关的重要脑区,海马CA1区更是HIBD后损伤易感区[13]。HE染色和尼氏染色是脑损伤远期组织学评估的常用方法,本研究采用HE与尼氏染色两种方法观察不同褪黑素治疗方案对HIBD新生大鼠脑组织海马CA1区锥体细胞的影响,发现HIBD后28 d,正常对照组海马CA1区锥体细胞数量最多,排布整齐,细胞大且圆;HIBD组脑组织海马CA1区锥体细胞数目最少,细胞排布稀疏、紊乱,细胞形态大小不一,锥体细胞数量少于正常对照组,这与文献报道一致[12],提示模型造模成功;SDIT与7DCT组脑组织海马CA1区锥体细胞较整齐,形态较规则,锥体细胞数目均高于HIBD组,且7DCT组脑组织海马CA1区锥体细胞数多于SDIT组,但仍少于正常对照组,提示两种褪黑素治疗方案均能减轻HIBD新生大鼠海马CA1区锥体细胞的损伤,且7DCT方案治疗HIBD新生大鼠疗效较佳,其机制可能与褪黑素治疗可促进内源性NSCs的增殖有关,其相关分子信号机制尚有待于进一步研究。
总之,两种褪黑素治疗方案均可促进HIBD新生大鼠脑内源性NSCs的增殖,减轻HIBD,7DCT方案疗效较优,从而为褪黑素治疗HIBD的临床应用提供了科学的理论依据。
| [1] |
Yum SK, Moon CJ, Youn YA, et al. Changes in lactate dehydrogenase are associated with central gray matter lesions in newborns with hypoxic-ischemic encephalopathy[J]. J Matern Fetal Neonatal Med, 2016, 30(10): 1177-1181. (  0) 0) |
| [2] |
Douglas-Escobar M, Weiss MD. Hypoxic-ischemic encephalopathy:a review for the clinician[J]. JAMA Pediatr, 2015, 169(4): 397. DOI:10.1001/jamapediatrics.2014.3269 (  0) 0) |
| [3] |
Ryu S, Lee SH, Kim SU, et al. Human neural stem cells promote proliferation of endogenous neural stem cells and enhance angiogenesis in ischemic rat brain[J]. Neural Regen Res, 2016, 11(2): 298-304. DOI:10.4103/1673-5374.177739 (  0) 0) |
| [4] |
Bavithra S, Selvakumar K, Sundareswaran L, et al. Neuroprotective effect of melatonin against PCBs induced behavioural, molecular and histological changes in cerebral cortex of adult male wistar rats[J]. Neurochem Res, 2017, 42(2): 428-438. DOI:10.1007/s11064-016-2087-6 (  0) 0) |
| [5] |
Yang Y, Sun B, Huang J, et al. Up-regulation of miR-325-3p suppresses pineal aralkylamine N-acetyltransferase (Aanat) after neonatal hypoxia-ischemia brain injury in rats[J]. Brain Res, 2017, 1668: 28-35. DOI:10.1016/j.brainres.2017.05.001 (  0) 0) |
| [6] |
李振, 程丹丹, 陈伟, 等. 褪黑素对脑缺血再灌注大鼠神经干细胞增殖的影响及机制研究[J]. 中华神经科杂志, 2018, 51(12): 977-984. DOI:10.3760/cma.j.issn.1006-7876.2018.12.008 (  0) 0) |
| [7] |
Chern CM, Liao JF, Wang YH. Melatonin ameliorates neural function by promoting endogenous neurogenesis through the MT2 melatonin receptor in ischemic-stroke mice[J]. Free Radic Biol Med, 2012, 52(9): 1634-1647. DOI:10.1016/j.freeradbiomed.2012.01.030 (  0) 0) |
| [8] |
Rice JE, Vannucci RC. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. (  0) 0) |
| [9] |
Yao Y, Zheng XR, Zhang SS, et al. Transplantation of vascular endothelial growth factor-modified neural stem/progenitor cells promotes the recovery of neurological function following hypoxic-ischemic brain damage[J]. Neural Regen Res, 2016, 11(9): 1456-1463. (  0) 0) |
| [10] |
Xu LX, Lv Y, Li YH, et al. Melatonin alleviates brain and peripheral tissue edema in a neonatal rat model of hypoxic-ischemic brain damage:the involvement of edema related proteins[J]. BMC Pediatr, 2017, 17(1): 90. DOI:10.1186/s12887-017-0824-x (  0) 0) |
| [11] |
程丹丹, 陈岚芬, 陈伟, 等. 两种不同褪黑素治疗途径对局灶性脑缺血大鼠行为学及组织病理学的影响[J]. 中华行为医学与脑科学杂志, 2018, 27(4): 310-315. DOI:10.3760/cma.j.issn.1674-6554.2018.04.005 (  0) 0) |
| [12] |
Han XR, Wen X, Wang YJ, et al. MicroRNA-140-5p elevates cerebral protection of dexmedetomidine against hypoxic-ischaemic brain damage via the Wnt/β-catenin signalling pathway[J]. J Cell Mol Med, 2018, 22(6): 3167-3182. DOI:10.1111/jcmm.13597 (  0) 0) |
| [13] |
马泽, 闫少珍, 王晓莉, 等. 脐血单个核细胞移植联合高压氧治疗对新生大鼠缺氧缺血性脑损伤的影响[J]. 中国当代儿科杂志, 2015, 17(7): 736-740. (  0) 0) |
 2019, Vol. 21
2019, Vol. 21


