2. 四川大学口腔医学院, 四川 成都 610041
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是在缺氧和缺血状态同时存在的情况下,发生的一种新生儿脑损伤。其致死率可高达20%以上,且存活患儿可发生多种后遗症,包括癫痫、脑瘫、视觉和听觉障碍、发育迟缓和孤独症等[1]。目前全身亚低温治疗为临床上常规应用的治疗手段,在足月儿缺氧缺血脑损伤(hypoxic-ischemic brain damage, HIBD)后的6 h内,进行48~72 h的亚低温治疗,可提升患儿的存活率,减少严重后遗症的发生率并改善预后[2]。但在接受亚低温治疗后,患儿易发生高血糖及白细胞减少症等相关并发症,且依旧有半数以上患儿伴有脑损伤[3]。因而,探索对HIE有效且安全的治疗手段十分必要。
鸢尾素(irisin)是新近发现的一种多肽,由Ⅲ型纤连蛋白结构域包含蛋白5被未确认的酶剪切其C末端后形成[4]。广泛分布于包括血液、脑脊液、唾液及乳汁等多种体液中[5-7]。目前鸢尾素已被报道具有抗炎症、抗凋亡、抗氧化应激等多种效应[8]。在肺缺氧缺血损伤模型中,检测到缺氧缺血损伤可以引起大鼠血液中鸢尾素的水平升高[9],提示鸢尾素可能具有对缺氧缺血损伤的保护作用。
细胞凋亡是导致缺氧缺血脑损伤的重要病理机制。细胞凋亡可由多条通路触发,线粒体介导的通路和死亡受体介导的通路是其中两条主要通路,两者最终都会通过激活半胱氨酸蛋白酶-3(caspase-3)执行细胞凋亡。线粒体介导的细胞凋亡主要通过激活B细胞淋巴瘤-2(B cell lymphoma 2, BCL-2)家族蛋白,导致促凋亡蛋白如BCL-2相关蛋白X(BCL-2 associated X protein, BAX)、BCL-2拮抗/杀伤因子-1(BCL-2 antagonist/killer 1, BAK)等孔蛋白,与抗凋亡蛋白如BCL-2、BCL-2样2蛋白(BCL-2 like 2 protein, BCL-W)等蛋白水平失衡,在线粒体膜上形成孔道,使线粒体中的其他促凋亡蛋白如凋亡诱导因子、细胞色素C等释放,激活半胱氨酸蛋白酶-9(caspase-9)并进一步激活caspase-3,介导凋亡[10]。
本研究建立新生大鼠HIBD模型,探究鸢尾素对HIBD的作用和机制。
1 材料与方法 1.1 动物由于不同性别大鼠对于同等程度缺氧缺血损伤的反映程度不同[11],本实验使用雄性7日龄Sprague-Dawley大鼠建立新生儿HIBD模型。由成都达硕实验动物有限公司直接购入新生大鼠及其母鼠,饲养于无病原体的实验动物中心,母鼠使用常规食物喂养,并实行12 h昼夜交替周期给予光照。生后7 d时,选取体重在15~19 g之间的大鼠248只随机分为假手术组、模型组、鸢尾素干预低剂量组及高剂量组,每组62只。
1.2 建立新生大鼠HIBD模型参考既往文献建立模型[12],使用异氟烷对新生大鼠进行吸入麻醉后置于电热垫上固定,保持手术过程中37℃的环境。消毒大鼠颈部皮肤,做颈部正中切口,游离颈总动脉后,对假手术组大鼠直接进行血管复位并缝合伤口,对其他3组大鼠进行右侧颈总动脉双结扎后切断。术后将各组大鼠置于电热垫上休息0.5 h,假手术组大鼠不进行缺氧处理,其他3组大鼠放入缺氧仓,暴露于8% O2、92% N2的环境下2 h,缺氧仓中放入37℃电热垫。
1.3 侧脑室注射鸢尾素重组多肽各组大鼠进行吸入式麻醉,俯卧固定于电热垫上。标记自前囟向右外侧移动2 mm,再向人字缝尖方向纵向移动2 mm后的点。使用Hamilton的5 µL进样针,于标记点处垂直进针2 mm深度,进行侧脑室注射。注射速度为1 µL/min,注射量为5 µL,注射完毕后,保持进样针在原处1 min后拔出。参考既往文献报道[13],侧脑室注射时,以小鼠体重20 g进行统一计算,低剂量组中,5 µL PBS中加入0.15 µg(7.5 µg/kg)鸢尾素重组多肽(orb180476,英国Biorbyt公司);高剂量组中,5 µL PBS中加入0.30 µg(15 µg/kg)鸢尾素重组多肽;模型组及假手术组注射5 µL PBS。
1.4 水迷宫实验造模后3周(生后28 d)的各组大鼠(n=18),进行水迷宫实验。前5日训练大鼠,第6日测试大鼠从实验开始至寻找到平台的时间。实验使用直径1.6 m、深0.4 m的圆形水池,平台直径10 cm,并低于水面1 cm,水温保持在25±1℃。训练期间,将大鼠由4个象限放入水池,找到平台后,于平台上休息15 s,移出水池。若大鼠未能在120 s内找到平台,则引导大鼠游向平台。第6日记录各组大鼠由4个象限出发,至找到平台为止的潜伏期时长,若未能在120 s内找到平台,则主动结束实验,并记录时间为120 s。训练开始后第7日,撤去平台,记录大鼠从同一象限出发,60 s内穿越平台区的次数。
1.5 2, 3, 5-三苯基氯化四氮唑染色造模后48 h,异氟烷麻醉各组大鼠(n=18),断头取脑,2 mm厚度切片。将切片置于2%的2, 3, 5-三苯基氯化四氮唑(2, 3, 5-triphenyltetrazolium chloride, TTC)溶液中,避光孵育15 min。PBS清洗3次后,加入4%多聚甲醛保存。
1.6 苏木精-伊红染色造模后48 h,异氟烷麻醉各组大鼠(n=8),断头取脑,4%多聚甲醛固定脑组织48 h,石蜡包埋,5 µm厚度切片,于热水中展开后置于载玻片上,于4℃保存。切片经脱蜡、水化后,使用苏木精染色5 min,并使用1%盐酸酒精分化10 s,清水冲洗切片1 h;再使用伊红染色5 min,冲洗掉染液;经酒精脱水后,使用二甲苯进行透化,最后进行封固。
1.7 TUNEL染色使用二甲苯、酒精处理保存的造模后48 h各组大鼠(n=8)脑组织标本的石蜡切片。在37℃使用蛋白酶K孵育25 min后,使用破膜液在常温下孵育20 min。按照原位细胞死亡试剂盒(11684817910,瑞士Roche公司)说明书进行染色。并使用4', 6-二脒基-2-苯基吲哚(1 : 500,D9542,美国Sigma-Aldrich公司)避光孵育10 min进行细胞核染色。加荧光淬灭剂,使用Olympus FV1000激光共聚焦显微镜获取图像。
1.8 蛋白质免疫印迹法造模后24 h及48 h,分别取各组大鼠(n=9)右脑半球皮层组织,使用RIPA裂解液裂解组织并离心,取上清液,于-70℃冰箱保存。采用上样缓冲液稀释样本,并加热蛋白使其变性后,以SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)将不同分子量蛋白分离,并将目标蛋白转移到聚偏二氟乙烯膜条带上。封闭条带后,加入兔抗大鼠BAX(1 : 1 000,14796,美国Cell Signaling Technology公司)、兔抗大鼠BCL-2(1 : 1 000,SAB4500003,美国Sigma-Aldrich)、兔抗大鼠cleaved-caspase-3(CC3,1 : 1 000,9661,美国Cell Signaling Technology)及内参小鼠抗大鼠β-actin(1 : 5 000,200068-8F10,成都正能生物技术有限责任公司)等一抗,4℃孵育过夜。清洗条带后,加入羊抗兔IgG(1 : 5 000,511103)及羊抗小鼠IgG(1 : 5 000,511203)(成都正能生物技术有限责任公司)孵育1 h,再次清洗。滴加ECL化学发光试剂,曝光获取图像,分析样本目标蛋白的灰度值。结果以目的蛋白与内参蛋白条带灰度值比值表示。
1.9 统计学分析使用SPSS 22.0统计软件对数据进行统计学分析。计量资料使用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 水迷宫实验在水迷宫实验中,模型组较假手术组潜伏期明显延长(P < 0.01);低剂量组与模型组比较潜伏期差异无统计学意义(P > 0.05);高剂量组潜伏期随着训练次数增加有减少的趋势,经过训练的高剂量组大鼠潜伏期与模型组和低剂量组相比均明显缩短(P < 0.01),且与假手术组相比差异无统计学意义(P > 0.05)。模型组大鼠撤去平台后穿越平台次数较假手术组明显减少(P < 0.01);低剂量组较模型组穿越平台次数增加(P < 0.01);高剂量组大鼠穿越平台次数较模型组和低剂量组均明显增加(P < 0.01),且与假手术组相比差异无统计学意义(P > 0.05)。见图 1,表 1。
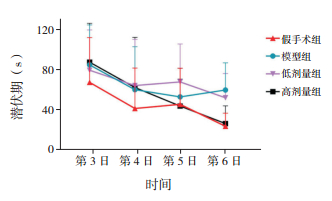
|
图 1 水迷宫实验第3~6日各组大鼠潜伏期的变化曲线(n=18) |
| 表 1 行为学结果 |
|
|
造模后48 h,TTC实验结果显示,各组脑梗死面积比较差异有统计学意义(F=28.98,P < 0.0001)。假手术组脑梗死面积为0,模型组大鼠脑梗死面积(21%±8%)明显大于假手术组(P < 0.05);低剂量组(13%±6%)及高剂量组(6%±4%)脑梗死面积与模型组相比均有减少,且存在浓度依赖趋势,其中高剂量组的脑梗死面积与模型组相比差异有统计学意义(P < 0.05),但仍大于假手术组(P < 0.05)。见图 2。
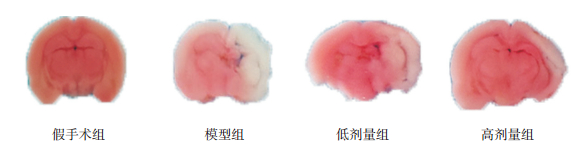
|
图 2 造模后48 h各组大鼠脑组织TTC染色结果 假手术组大鼠脑组织未出现脑梗死区域,模型组大鼠出现大面积脑梗死区域,低剂量组及高剂量组大鼠脑梗死面积明显小于模型组,且呈剂量依赖性。 |
与假手术组相比,模型组和低剂量组大鼠右脑神经元明显减少,右侧脑组织染色较对侧脑组织浅,结构疏松,组织结构紊乱,大量细胞死亡;右侧大脑皮层区见大量细胞胞质空泡化、细胞核固缩、核破裂的神经元。高剂量组大鼠右侧脑组织染色浅淡区面积较模型组减少,右侧大脑皮层核固缩神经元较模型组和低剂量组减少,脑组织接近正常生理结构。见图 3。
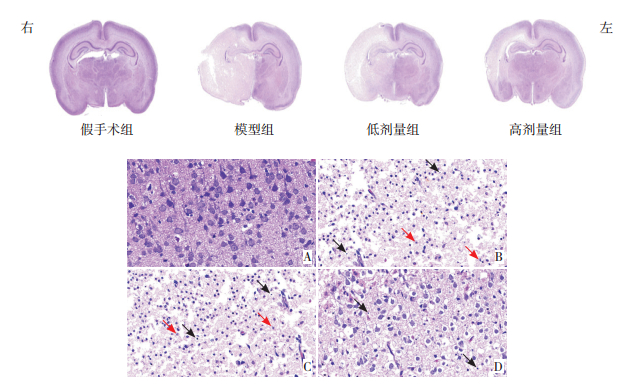
|
图 3 各组大鼠脑组织苏木精-伊红染色结果 上图为各组大鼠的脑组织切片染色后的全脑图像。与假手术组相比,模型组和低剂量组大鼠右侧脑组织染色较对侧脑组织浅,结构疏松,组织结构紊乱;高剂量组右侧脑组织染色浅淡区域面积较模型组减少,脑组织接近正常生理结构。下图为各组大鼠右侧大脑皮层扫描放大后的图像(×600)。A为假手术组,模型组(B)和低剂量组(C)大鼠右侧大脑皮层区可见大量神经元细胞胞质空泡化、细胞核固缩(黑色箭头所示)、核破裂(红色箭头所示);高剂量组(D)可见中量细胞胞质空泡化,神经元细胞核固缩减少。 |
造模后,模型组大鼠右侧大脑全脑、海马区及皮层区出现广泛性细胞凋亡;低剂量组同样存在广泛性的细胞凋亡;高剂量组可见细胞凋亡程度较模型组减轻。TUNEL染色分析发现,模型组大鼠右侧大脑皮层及海马区细胞凋亡率明显高于假手术组(P < 0.01),低剂量组细胞凋亡率与模型组比较差异无统计学意义(P > 0.05),高剂量组细胞凋亡率较模型组及低剂量组均降低,但仍高于假手术组(P < 0.01)。见图 4,见表 2。
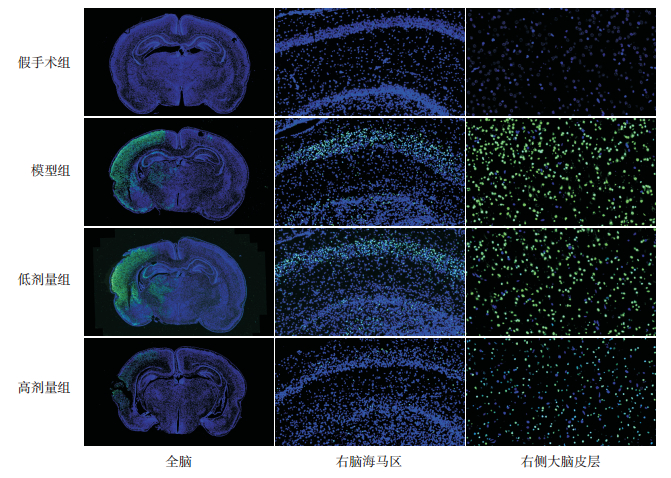
|
图 4 各组大鼠脑组织TUNEL染色结果 全脑(×20);右脑海马区(×200);右侧大脑皮层(×400)。蓝色染色为细胞核;绿色染色为TUNEL染色阳性细胞,即凋亡细胞。造模后,模型组大鼠右侧大脑、海马区及皮层出现广泛性细胞凋亡;上述区域在低剂量组同样存在广泛性的细胞凋亡;高剂量组可见细胞凋亡程度较模型组减轻。 |
| 表 2 各组细胞凋亡率比较 |
|
|
造模后24 h,模型组、低剂量组和高剂量组CC3水平较假手术组均明显升高(P < 0.01);与模型组相比,低剂量组、高剂量组存在CC3水平降低(P < 0.05);且高剂量组CC3水平低于低剂量组(P < 0.05)。高剂量组BCL-2/BAX值较假手术组、模型组和低剂量组均明显升高(P < 0.05),且低剂量组高于模型组(P < 0.05)。
造模后48 h,模型组和低剂量组的CC3水平较假手术组明显升高(P < 0.05),高剂量组CC3水平与假手术组比较差异无统计学意义(P > 0.05);低剂量组、高剂量组CC3水平较模型组明显降低(P < 0.05),且高剂量组低于低剂量组(P < 0.05)。与假手术组相比,模型组BCL-2/BAX值降低,低剂量组及高剂量组BCL-2/BAX值升高(P < 0.05);低剂量组、高剂量组BCL-2/BAX值均明显高于模型组(P < 0.05),且低剂量组明显高于高剂量组(P < 0.05)。见图 5,表 3。
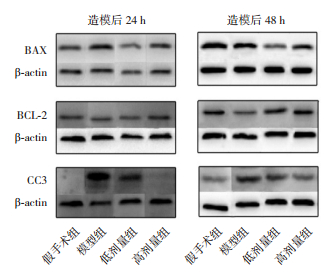
|
图 5 Western blot检测各组蛋白相对表达变化电泳图 |
| 表 3 各组蛋白相对表达水平比较 |
|
|
HIBD目前考虑为两阶段的打击引起细胞死亡。第一次打击为缺氧直接导致的能量耗竭,造成细胞损伤。第二次打击可能与后续的炎症反应、氧化应激反应及兴奋性毒性作用引起的能量耗竭有关[14]。鸢尾素除拥有抗凋亡、抗炎症、抗氧化应激等作用外,还可以保护血管内皮细胞,如:保护血脑屏障、减轻脑组织水肿、促进心脏的血管再生。目前已报道其在肝脏缺血再灌注、成年人脑卒中、心肌缺血再灌注等多种疾病动物模型的治疗中有效[13, 15-16]。本实验首次显示鸢尾素对新生大鼠HIBD模型存在保护作用,并有效减少细胞凋亡。
水迷宫实验中,模型组和低剂量组较假手术组潜伏期更长,高剂量组第6日的潜伏期与假手术组相近,但从第3~6日之间时间变化曲线的趋势来看,假手术组第4日开始表现趋于稳定,高剂量组训练期间表现较假手术组差,但潜伏期逐渐缩短,变化趋势较其余两组明显。高剂量组穿越平台次数较模型组多。提示鸢尾素可以改善HIBD导致的认知功能障碍。
本实验中,HIBD引起新生大鼠广泛性的脑组织损伤,大脑皮层受损更为严重。TTC染色结果可见各组大鼠右侧大脑皮层区存在梗死灶,模型组及低剂量组梗死面积更大,高剂量组梗死面积较小。且苏木精-伊红染色结果显示HIBD后大鼠右侧脑组织可见广泛性损伤、大量细胞死亡及脑组织结构紊乱,高剂量组与模型组相比损伤明显较轻。同时,TUNEL结果显示,大鼠的海马区也受到损伤,但高剂量组海马区细胞凋亡阳性率较低。提示鸢尾素可有效减少HIBD早期的广泛性脑损伤。
新生儿在大脑发生HIBD时,可出现细胞凋亡、坏死及自噬等过程。线粒体外膜透化作用发生后,凋亡复合体被释放,并最终激活下游的caspase-3,执行DNA裂解及细胞凋亡。线粒体膜通透性转换孔的开放则主要引起细胞坏死[17-18]。活化的孔蛋白BAX在其BH3区域被BCL-2包裹时,无法发生寡聚化形成通道,从而阻止线粒体外膜透化作用的发生[19]。由于实验检测的是细胞中BAX蛋白的总量,无法体现其发生寡聚化后形成通道的水平,本实验使用BCL-2与BAX的比值代表线粒体外膜透化作用程度。
已有实验报道鸢尾素可以改善缺氧缺血损伤时心肌细胞、胰岛细胞、肺上皮细胞的细胞凋亡,降低caspase-3及BAX的蛋白水平,提升BCL-2的蛋白水平[1]。本实验中,TUNEL实验显示与模型组相比,高剂量组细胞染色阳性率低。且高剂量组在两个时间点上的CC3表达水平均下降,而BCL-2/BAX升高,提示一定量的鸢尾素可能通过改善线粒体外膜透化作用,改善HIBD导致的新生儿脑组织的细胞凋亡。
总之,本研究表明,鸢尾素可以有效减轻新生大鼠HIBD,其机制可能与减少细胞凋亡相关。
| [1] |
Yıldız EP, Ekici B, Tatlı B. Neonatal hypoxic ischemic encephalopathy:an update on disease pathogenesis and treatment[J]. Expert Rev Neurother, 2017, 17(5): 449-459. DOI:10.1080/14737175.2017.1259567 (  0) 0) |
| [2] |
Wassink G, Davidson JO, Dhillon SK, et al. Therapeutic hypothermia in neonatal hypoxic-ischemic encephalopathy[J]. Curr Neurol Neurosci Rep, 2019, 19(2): 2. (  0) 0) |
| [3] |
Rao R, Trivedi S, Vesoulis Z, et al. Safety and short-term outcomes of therapeutic hypothermia in preterm neonates 34-35 weeks gestational age with hypoxic-ischemic encephalopathy[J]. J Pediatr, 2017, 183: 37-42. DOI:10.1016/j.jpeds.2016.11.019 (  0) 0) |
| [4] |
Boström P, Wu J, Jedrychowski MP, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2012, 481(7382): 463-468. DOI:10.1038/nature10777 (  0) 0) |
| [5] |
Ruan Q, Zhang L, Ruan J, et al. Detection and quantitation of irisin in human cerebrospinal fluid by tandem mass spectrometry[J]. Peptides, 2018, 103: 60-64. DOI:10.1016/j.peptides.2018.03.013 (  0) 0) |
| [6] |
Aydin S, Kuloglu T, Aydin S. Copeptin, adropin and irisin concentrations in breast milk and plasma of healthy women and those with gestational diabetes mellitus[J]. Peptides, 2013, 47: 66-70. DOI:10.1016/j.peptides.2013.07.001 (  0) 0) |
| [7] |
Aydin S, Aydin S, Kuloglu T, et al. Alterations of irisin concentrations in saliva and serum of obese and normal-weight subjects, before and after 45 min of a Turkish bath or running[J]. Peptides, 2013, 50: 13-18. DOI:10.1016/j.peptides.2013.09.011 (  0) 0) |
| [8] |
Yıldız EP, Ekici B, Tatlı B. Neonatal hypoxic ischemic encephalopathy:an update on disease pathogenesis and treatment[J]. Expert Rev Neurother, 2017, 17(5): 449-459. (  0) 0) |
| [9] |
Chen K, Xu Z, Liu Y, et al. Irisin protects mitochondria function during pulmonary ischemia/reperfusion injury[J]. Sci Transl Med, 2017, 9(418): pii:eaao6298. DOI:10.1126/scitranslmed.aao6298 (  0) 0) |
| [10] |
Siddiqui WA, Ahad A, Ahsan H. The mystery of BCL2 family:Bcl-2 proteins and apoptosis:an update[J]. Arch Toxicol, 2015, 89(3): 289-317. DOI:10.1007/s00204-014-1448-7 (  0) 0) |
| [11] |
Charriaut-Marlangue C, Besson VC, Baud O. Sexually dimorphic outcomes after neonatal stroke and hypoxia-ischemia[J]. Int J Mol Sci, 2017, 19(1): pii:E61. DOI:10.3390/ijms19010061 (  0) 0) |
| [12] |
Zheng Z, Zhang L, Qu Y, et al. Mesenchymal stem cells protect against hypoxia-ischemia brain damage by enhancing autophagy through brain derived neurotrophic factor/mammalin target of rapamycin signaling pathway[J]. Stem Cells, 2018, 36(7): 1109-1121. DOI:10.1002/stem.2808 (  0) 0) |
| [13] |
Asadi Y, Gorjipour F, Behrouzifar S, et al. Irisin peptide protects brain against ischemic injury through reducing apoptosis and enhancing BDNF in a rodent model of stroke[J]. Neurochem Res, 2018, 43(8): 1549-1560. DOI:10.1007/s11064-018-2569-9 (  0) 0) |
| [14] |
Gopagondanahalli KR, Li J, Fahey MC, et al. Preterm hypoxic-ischemic encephalopathy[J]. Front Pediatr, 2016, 4: 114. (  0) 0) |
| [15] |
Bi J, Zhang J, Ren Y, et al. Irisin alleviates liver ischemia-reperfusion injury by inhibiting excessive mitochondrial fission, promoting mitochondrial biogenesis and decreasing oxidative stress[J]. Redox Biol, 2019, 20: 296-306. DOI:10.1016/j.redox.2018.10.019 (  0) 0) |
| [16] |
Liao Q, Qu S, Tang LX, et al. Irisin exerts a therapeutic effect against myocardial infarction via promoting angiogenesis[J]. Acta Pharmacol Sin, 2019, 40(10): 1314-1321. DOI:10.1038/s41401-019-0230-z (  0) 0) |
| [17] |
Thornton C, Leaw B, Mallard C, et al. Cell death in the developing brain after hypoxia-ischemia[J]. Front Cell Neurosci, 2017, 11: 248. (  0) 0) |
| [18] |
Thornton C, Hagberg H. Role of mitochondria in apoptotic and necroptotic cell death in the developing brain[J]. Clin Chim Acta, 2015, 451(Pt A): 35-38. (  0) 0) |
| [19] |
Walensky LD. Targeting BAX to drug death directly[J]. Nat Chem Biol, 2019, 15(7): 657-665. DOI:10.1038/s41589-019-0306-6 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


