先天性肌营养不良(congenital muscular dystro-phy, CMD)是一类早发性遗传性肌肉病,主要临床表现为生后早期出现的肌张力低下、运动发育落后、关节挛缩并伴血清肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)等酶学指标升高[1]。根据致病基因性质,该病可分为不同临床类型[2]。而根据层黏连蛋白α2染色结果,可将CMD分为层黏连蛋白α2阴性和阳性两种,其中层黏连蛋白α2阴性CMD又称层黏连蛋白α2缺乏症,或者先天性肌营养不良1A型(congenital muscular dystrophy type 1A, CMD1A)[3]。CMD1A致病基因LAMA2定位于6q22-23,全长260 kb,含有65个外显子,其编码产物层黏连蛋白α2包含3 122个氨基酸残基,由8个结构域组成,位于骨骼肌细胞外基质,通过肌膜蛋白复合物dystroglycan与肌细胞骨架成分dystrophin相互作用,稳定肌膜和保护肌膜免受肌肉收缩过程中产生的压力[4-5]。
国外文献中CMD1A的研究报道已不罕见,尤其是关于欧美国家患者的研究报道[6-7]。近年来国内文献中已有应用遗传学分析确诊本病的报道[8-13],但涉及病例数还比较有限,无论是CMD1A患者临床特征还是LAMA2基因变异特点均需系统分析总结。本研究报道1例CMD1A患儿的临床及遗传学特点,并对国内外报道的经基因分析确诊CMD1A患儿的临床资料进行回顾性分析,旨在加深对CMD1A的临床、实验室、影像学及遗传学特征的科学认识,为本病早期诊断和管理提供依据。
1 资料与方法 1.1 病例介绍患儿,男,19月龄,因发现运动发育落后1年余就诊。患儿出生后运动发育落后,3.7月龄时因不能抬头于某医院查血生化指标示CK、CK-MB、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)均升高(表 1),疑诊CMD,行脊髓性肌萎缩症(SMA)SMN1、SMN2基因检测未发现变异,未予特殊治疗。6月龄时不能坐,9月龄时不能独站,于另一医院查血生化指标,发现CK、CK-MB、ALT、AST仍高(表 1)。1岁时仍不能独立行走,为明确病因来我院就诊。自起病以来,患儿精神反应可,食欲正常,大小便无特殊。
| 表 1 患儿历次实验室检查结果 |
|
|
患儿系第3胎第3产,胎龄39周,自然分娩出生,否认出生窒息史。出生体重3 400 g,身长50 cm。其父母体健,非近亲婚配,否认遗传病家族史。两位哥哥现分别为12岁和4岁,生长发育和智力正常。
体格检查:体重9.0 kg,身高81 cm,头围47.5 cm,前囟0.5 cm×0.5 cm。神志清楚,反应可,全身浅表淋巴结未及肿大。头颅五官无畸形,乳牙8颗,咬合及眼球活动正常。双肺呼吸音清,未闻及干湿啰音。心音有力,律齐,各瓣膜听诊区未闻及病理性杂音。腹软,肝脾肋下未及。双下肢肌张力低,双侧膝腱反射和跟腱反射弱,克氏、布氏和巴氏征均阴性。
辅助检查:血生化检查结果示血清CK、CK-MB、ALT、AST、乳酸脱氢酶(LDH)和α-羟基丁酸脱氢酶(HBDH)水平明显升高(表 1)。
1.2 遗传学分析采集患儿外周血2 mL(EDTA抗凝),用试剂盒(杭州新景生物试剂开发有限公司)提取基因组DNA,建立与神经肌肉病相关基因的基因组文库(包含233个基因)。用液相捕获试剂盒(北京迈基诺基因科技有限公司)捕获目标基因,采用新一代测序仪Illumina HiSeq2000(美国Illumina公司)进行高通量测序。根据二代测序结果,提取患儿及其父母、两个兄长的外周血DNA,对发现的LAMA2基因可能致病性变异进行Sanger测序验证。具体流程和技术细节参照文献[14-16]。患儿无义变异和移码变异PCR扩增所需引物对序列分别为:正向5'-AGGGTATTTCCTGCCCTACAAC-3',反向5'-GTATCACCCATTCTTGGCTGC-3';正向5'-CCGAGGAGACTTCGACCTAAA-3',反向5'-TGG-GCCCATGTGACCTAATA-3'。
1.3 蛋白结构预测使用SWISS-MODEL蛋白质建模服务器(https://swissmodel.expasy.org/)构建野生型与变异后的层黏连蛋白α2蛋白分子,并通过SWISS-Pdb Viewer 4.1.0(http://www.expasy.org/spdbv/)进行比对,根据两者构象差异,判断LAMA2基因变异对层黏连蛋白α2的影响,从而推断新变异的致病性。
1.4 文献复习以“先天性肌营养不良1A型”、“LAMA2基因”及“层黏连蛋白α2”为关键词,在中国知网、万方数据库、中国科技期刊数据库(维普)检索2010年1月至2019年5月于国内发表的基因确诊病例报道;以“congenital muscular dystrophy type 1 A(CMD1A)”“LAMA2 gene”“merosin”为关键词,在PubMed等外文数据库中检索2010年1月至2019年5月于国外发表的文献,筛选出具有完整临床资料并经基因诊断为LAMA2基因变异所致CMD1A的病例。系统总结分析所有检索到的病例的临床和遗传学特征。
本研究经暨南大学附属第一医院医学伦理委员会批准(批件号:KY-2019-048),并由患儿父母签署知情同意书。
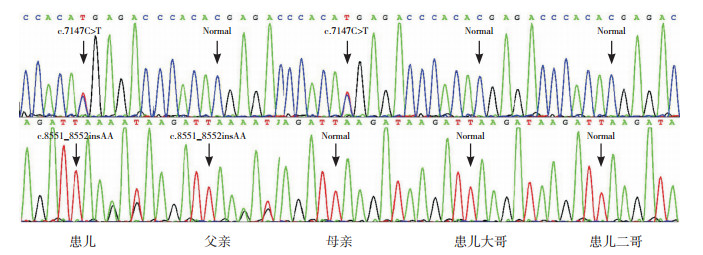
2 结果 2.1 遗传学分析结果二代测序结果显示,本例患儿LAMA2基因检出无义变异c.7147C > T(p.Ala2383Ter)和移码变异c.8551_8552insAA(p.Ile2852ArgfsTer2)。Sanger测序证实,患儿为以上LAMA2基因变异的复合杂合子,前者来自其母亲,而后者来自其父亲(图 1)。无义变异c.7147C > T(p.Ala2383Ter)已于2000年被报道[17]。经检索中国知网、万方数据库、中国科技期刊数据库(维普)和PubMed等文献数据库,以及人类基因突变数据库(http://www.hgmd.cf.ac.uk/ac/index.php)和千人基因组计划人群数据库(https://www.internationalgenome.org/),均未发现与c.8551_8552insAA(p.Ile2852ArgfsTer2)相关的报道,该变异为新变异。
|
图 1 患儿及其家庭成员LAMA2基因Sanger测序结果 患儿为c.8551_8552insAA(p.Ile2852ArgfsTer2)和c.7147C > T(p.Ala2383Ter)的复合杂合子,前1个变异来自父亲,后1个变异来自母亲,两兄长均无变异。箭头所示为变异位点。 |
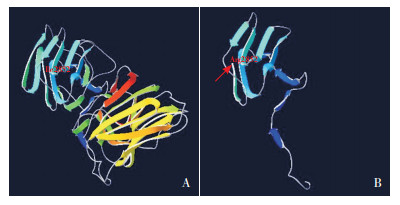
利用SWISS-MODEL构建野生型与LAMA2基因新变异c.8551_8552insAA(p.Ile2852ArgfsTer2)相应的层黏连蛋白α2分子结构飘带图,并通过SWISS-Pdb Viewer 4.1.0对比发现该变异使层黏连蛋白α2第2852位氨基酸由异亮氨酸变为精氨酸,并在第2853位氨基酸提前终止翻译,使变异后的蛋白质的肽链被截断,丢失蛋白结构域G的大部分氨基酸残基,使层黏连蛋白α2不能与肌膜蛋白结合,从而影响该蛋白的功能,见图 2。
|
图 2 野生型和变异后的层黏连蛋白α2三维结构模型 A:野生型层黏连蛋白α2结构模型;B:c.8551_8552insAA(p.Ile2852ArgfsTer2)变异后的蛋白结构模型。第2852位氨基酸由异亮氨酸变成精氨酸且第2853位氨基酸变为终止信号后,层黏连蛋白α2空间结构发生改变。图B中箭头所示为蛋白质空间结构改变起始位置,与野生型(图A)相比,变异型(图B)肽链明显截短。 |
根据2015年美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics, ACMG)标准和指南[18],本例患儿检测出的移码变异属于功能缺失型变异,具有极强的致病性(PVS1);在各大数据库中均未检索到该变异,符合中等致病性证据2(PM2);该患儿为复合杂合变异,另一变异为致病性无义变异,可作为中等致病性证据3(PM3);此外,多种生物信息学工具预测均提示该变异具有致病性(PP3)。该患儿移码变异同时具有PVS1+PM2+PM3+PP3证据,可确定c.8551_8552insAA(p.Ile2852ArgfsTer2)为致病性LAMA2变异。
2.2 治疗与结局本例研究对象因其临床表现、血清酶学特点曾于外院疑诊为CMD;19月龄时,为明确病因就诊于我院。经高通量测序及一代测序验证,最终确诊为LAMA2基因变异引起的CMD1A。确诊后未予特殊治疗,现门诊随访中,运动发育落后未见明显改善,远期预后需继续观察。
2.3 文献复习结果经检索国内外文献,发现临床资料完整且最终通过遗传学分析确诊的CMD1A患儿共46例,其中男26例,女20例;国内报道23例[8-13, 19-21],国外23例[22-27]。患儿多为生后6个月内起病(43/46,93%),主要表现为抬头、独坐、站立、走路等运动发育里程碑落后;43例患儿行血清CK检测,发现所有患儿CK水平呈数倍甚至数十倍的升高(491~6 304 U/L,参考值范围40~175 U/L),但ALT和LDH具体未描述;32例患儿行头颅MRI检查,均发现脑白质异常信号,主要累及侧脑室前后角,多为弥漫性病变;报道中均未提及癫痫史,42例患儿行智力检测,均基本正常;23例患儿行肌肉穿刺活检提示肌营养不良改变,肌肉组织染色后可见肌纤维大小不等,免疫组化染色结果显示层黏连蛋白α2阴性。本研究纳入的46例患儿中,仅14例患儿的临床资料中明确提及其预后情况。这14例患儿的运动发育落后和实验室异常在随访过程中均无明显改善,其中1例患儿于10岁时死于重症肺炎导致的呼吸衰竭,提示本病远期预后不良。
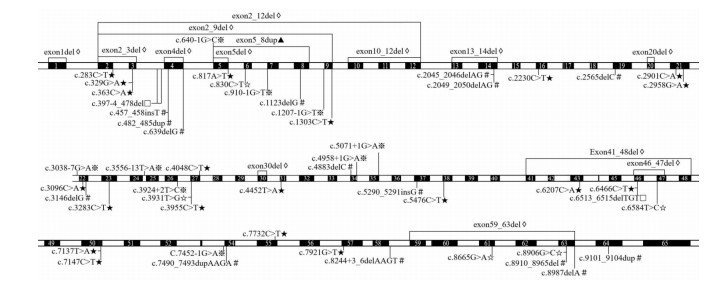
46例患儿中有13例为LAMA2基因纯合变异,其余33例为复合杂合变异。这些患儿共检出LAMA2基因变异65种(图 3)。其中无义变异、移码变异、外显子缺失和剪接位点变异分别占31%(20/65)、22%(14/65)、20%(13/65)和17%(11/65),而错义变异仅占8%(5/65),另外缺失变异及外显子重复各占2%(1/65)。这些变异类型中,无义变异、移码变异、外显子缺失及经典剪接位点变异均属于零效(null)变异,占全部变异类型的89%。
|
图 3 文献报道的LAMA2基因变异和变异类型 其中黑框为外显子,白框为内含子,黑框上的白色数字为对应的外显子排序,其中外显子44和53长度较短,分别为6 bp和12 bp,编号未在图中标记。※剪接位点变异;#移码变异;★无义变异;☆错义变异;◊外显子缺失;▲外显子重复;□缺失变异。 |
该患儿出生后即出现运动发育迟缓,双下肢肌张力低,双侧膝腱反射和跟腱反射弱,且多次生化检查结果提示肌酶明显升高,符合遗传性肌病的临床表现。通过高通量测序及Sanger测序验证,证实患儿为LAMA2基因变异c.7147C > T(p.Ala2383Ter)和c.8551_8552insAA(p.Ile2852ArgfsTer2)的复合杂合子,后者为未见文献报道的移码变异,且根据ACMG指南确认为致病变异,故CMD1A诊断明确。
根据2015版ACMG指南[18],无义变异、移码变异、外显子缺失和剪接位点变异严重影响编码蛋白质功能,属于公认的零效变异。文献回顾发现46名CMDA1患儿存在LAMA2基因变异65种,具有明显的异质性。这65种LAMA2基因变异中,零效变异所占比例为89%,仅有5个错义变异、1个缺失变异及1个外显子重复不属于零效变异类型。由于LAMA2基因零效变异引起层黏连蛋白功能完全缺失,此类CMDA1临床表现严重而容易被发现和诊断,而非零效变异可能保留部分层黏连蛋白功能,致使患者临床表现相对较轻而不容易被发现和确诊,这可能是造成CMD1A患者LAMA2变异以零效变异为主的原因。
CMD1A患儿主要表现为婴儿早期或出生后即出现运动发育落后,血清CK显著升高,这可用本病主要累及骨骼肌来解释,因为CK作为主要存在于骨骼肌中的肌肉特异性酶,是检测肌肉相关性疾病的重要指标[28]。本病患儿颅脑MRI检查存在脑白质弥漫性异常信号,但智力基本正常,无明显的认知功能障碍及癫痫发作病史。此特点可能与层黏连蛋白α2蛋白缺失导致的少突胶质细胞形成髓鞘障碍有关[29],也可能是层黏连蛋白α2缺陷使得血脑屏障功能障碍,从而脑白质内水分分布异常所致[30]。因此,对于存在运动发育落后、CK值显著升高的患儿,若颅脑MRI提示脑白质受损但智力和认知功能无异常,同时无癫痫发作,则高度提示CMD1A诊断[31]。本例患儿除CK升高外,ALT、AST及LDH亦有升高,但该患儿并无肝炎或肝功能损害等临床表现。这可能与ALT、AST和LDH除存在于肝脏外,也存在于骨骼肌等组织有关[32-33]。因此,对于除CK值外,ALT、AST及LDH也明显而持续升高的患者,需要高度警惕遗传性肌病,应及时行遗传学分析等相关检查确诊。
CMD1A需与脊髓性肌萎缩和假性肥大性肌营养不良等神经肌肉病相鉴别。SMA是异质性神经遗传病,以脊髓前角的α运动神经元退化变性为共同特征,表现为进行性、对称性肢体近端和躯干肌肉无力、瘫痪和萎缩[34]。假性肥大性肌营养不良(DMD)作为一种遗传性骨骼肌疾病,表现为进行性无力和肌肉萎缩最终完全丧失运动功能[35]。SMA的血清CK一般正常,且受累肌群腱反射减弱或消失,而DMD和CMD1A的血清CK均显著升高;SMA和CMD1A多在生后早期发病,但DMD在婴儿期罕见;遗传学分析可为三者鉴别提供可靠依据。
目前CMD1A缺乏特异而有效的治疗方案,治疗以对症支持措施为主,如长期随访、加强关节功能锻炼、外科矫形手术矫正脊柱侧凸和给予呼吸支持等来改善症状,延缓病情发展[1]。由于CMD1A会导致周围神经损害及肌肉病理结构改变[22],治疗上可从缓解神经功能障碍及改善肌肉病理结构着手。目前BAX基因调控、强力霉素治疗、层黏连蛋白111的应用及细胞移植等方法均在动物实验中观察到效果[36-37],这为本病的治疗提供了研究方向。根据遗传学分析结果,在受累家庭中开展遗传咨询并对高风险胎儿进行产前诊断,是避免本病患儿出生的有效手段。
总之,本研究确诊了1例CMD1A患儿,发现LAMA2基因新变异c.8551_8552insAA(p.Ileu2852ArgfsTer2),并进一步系统总结了本病患儿的临床、实验室、影像学和遗传学特征。研究发现对于深入认识CMD1A的临床和实验室特征,提高本病患者的早期诊断和临床管理水平具有一定的参考价值。
| [1] |
葛琳, 熊晖. Merosin蛋白缺陷型先天性肌营养不良研究进展[J]. 中华儿科杂志, 2018, 56(3): 234-236. DOI:10.3760/cma.j.issn.0578-1310.2018.03.019 (  0) 0) |
| [2] |
Bönnemann CG, Wang CH, Quijano-Roy S, et al. Diagnostic approach to the congenital muscular dystrophies[J]. Neuromuscul Disord, 2014, 24(4): 289-311. DOI:10.1016/j.nmd.2013.12.011 (  0) 0) |
| [3] |
Falsaperla R, Praticò AD, Ruggieri M, et al. Congenital muscular dystrophy:from muscle to brain[J]. Ital J Pediatr, 2016, 42(1): 78. DOI:10.1186/s13052-016-0289-9 (  0) 0) |
| [4] |
Zhang X, Vuolteenaho R, Tryggvason K. Structure of the human laminin alpha2-chain gene (LAMA2), which is affected in congenital muscular dystrophy[J]. J Biol Chem, 1996, 271(44): 27664-27669. DOI:10.1074/jbc.271.44.27664 (  0) 0) |
| [5] |
Campbell KP. Three muscular dystrophies:loss of cytoskeleton-extracellular matrix linkage[J]. Cell, 1995, 80(5): 675-679. DOI:10.1016/0092-8674(95)90344-5 (  0) 0) |
| [6] |
Muntoni F, Voit T. The congenital muscular dystrophies in 2004:a century of exciting progress[J]. Neuromuscul Disord, 2004, 14(10): 635-649. DOI:10.1016/j.nmd.2004.06.009 (  0) 0) |
| [7] |
Sparks SE, Quijano-Roy S, Harper A, et al. Congenital muscular dystrophy overview-archived chapter, for historical reference only[EB/OL]. GeneReviews®. (2012-08-23)[2020-01-18]. https://www.ncbi.nlm.nih.gov/books/NBK1291/pdf/Bookshelf_NBK1291.pdf.
(  0) 0) |
| [8] |
王硕, 熊晖, 罗静, 等. 一个先天性肌营养不良1A型家系的临床、分子病理及遗传学研究[J]. 中华医学遗传学杂志, 2010, 27(1): 13-17. (  0) 0) |
| [9] |
张晓莉, 牛国辉, 杜开先, 等. 先天性肌营养不良1A型颅脑磁共振成像和基因检测诊断分析:附两例报道及文献复习[J]. 中国全科医学, 2014, 17(24): 2847-2850. DOI:10.3969/j.issn.1007-9572.2014.24.016 (  0) 0) |
| [10] |
杨璐, 王爽, 熊晖, 等. 基因检测诊断LAMA2基因突变所致先天性肌营养不良1例[J]. 中华实用儿科临床杂志, 2015, 30(12): 952-953. DOI:10.3760/cma.j.issn.2095-428X.2015.12.019 (  0) 0) |
| [11] |
范燕彬, 傅晓娜, 葛琳, 等. 先天性肌营养不良的临床表现和产前诊断[J]. 中华围产医学杂志, 2017, 20(9): 669-678. DOI:10.3760/cma.j.issn.1007-9408.2017.09.011 (  0) 0) |
| [12] |
江士远, 向娜. 先天性肌营养不良1A型1例临床与基因分析[J]. 临床儿科杂志, 2017, 35(5): 369-371. DOI:10.3969/j.issn.1000-3606.2017.05.012 (  0) 0) |
| [13] |
朱艳慧, 喻长顺, 王晓春, 等. 层黏连蛋白α2缺失型先天性肌营养不良患儿一例LAMA2基因突变分析[J]. 中华临床医师杂志(电子版), 2013, 7(13): 5871-5874. DOI:10.3969/cma.j.issn.1674-0785.2013.13.100 (  0) 0) |
| [14] |
程映, 梁红, 蔡娜莉, 等. 微绒毛包涵体病一家系临床特点和MYO5B基因突变分析[J]. 中国当代儿科杂志, 2017, 19(9): 968-974. (  0) 0) |
| [15] |
邓梅, 林伟霞, 郭丽, 等. 线粒体DNA耗竭综合征1例临床特点和DGUOK基因突变分析[J]. 中国当代儿科杂志, 2016, 18(6): 545-550. (  0) 0) |
| [16] |
黄大桂, 刘佳佳, 郭丽, 等. 关节挛缩、肾功能不全和胆汁淤积综合征一家系临床特点及VPS33B基因突变分析[J]. 中国当代儿科杂志, 2017, 19(10): 1077-1082. DOI:10.7499/j.issn.1008-8830.2017.10.009 (  0) 0) |
| [17] |
Pegoraro E, Fanin M, Trevisan CP, et al. A novel laminin alpha2 isoform in severe laminin alpha2 deficient congenital muscular dystrophy[J]. Neurology, 2000, 55(8): 1128-1134. DOI:10.1212/WNL.55.8.1128 (  0) 0) |
| [18] |
Richards S, Aziz N, Bale S, et al. Standards and guidelines for the interpretation of sequence variants:a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J]. Genet Med, 2015, 17(5): 405-424. DOI:10.1038/gim.2015.30 (  0) 0) |
| [19] |
He Z, Luo X, Liang L, et al. Merosin-deficient congenital muscular dystrophy type 1A:a case report[J]. Exp Ther Med, 2013, 6(5): 1233-1236. DOI:10.3892/etm.2013.1271 (  0) 0) |
| [20] |
Ge L, Liu A, Gao K, et al. Deletion of exon 4 in LAMA2 is the most frequent mutation in Chinese patients with laminin α2-related muscular dystrophy[J]. Sci Rep, 2018, 8(1): 14989. DOI:10.1038/s41598-018-33098-3 (  0) 0) |
| [21] |
梁晓平, 王爽, 张巍, 等. LAMA2基因突变致先天性肌营养不良的周围神经损害研究[J]. 中华儿科杂志, 2017, 55(2): 95-99. (  0) 0) |
| [22] |
Hashemi-Gorji F, Yassaee VR, Dashti P, et al. Novel LAMA2 gene mutations associated with merosin-deficient congenital muscular dystrophy[J]. Iran Biomed J, 2018, 22(6): 408-414. DOI:10.29252/.22.6.408 (  0) 0) |
| [23] |
Incecik F, Herguner OM, Ceylaner S, et al. Merosin-negative congenital muscular dystrophy:report of five cases[J]. J Pediatr Neurosci, 2015, 10(4): 346-349. DOI:10.4103/1817-1745.174432 (  0) 0) |
| [24] |
Dimova I, Kremensky I. LAMA2 congenital muscle dystrophy:a novel pathogenic mutation in bulgarian patient[J]. Case Rep Genet, 2018, 2018: 3028145. (  0) 0) |
| [25] |
Di Blasi C, Bellafiore E, Salih MA, et al. Variable disease severity in Saudi Arabian and Sudanese families with c.3924+2T > C mutation of LAMA2[J]. BMC Res Notes, 2011, 4: 534. DOI:10.1186/1756-0500-4-534 (  0) 0) |
| [26] |
Andrade RC, Nevado J, de Faria Domingues de Lima MA, et al. Segmental uniparental isodisomy of chromosome 6 causing transient diabetes mellitus and merosin-deficient congenital muscular dystrophy[J]. Am J Med Genet A, 2014, 164A(11): 2908-2913. (  0) 0) |
| [27] |
Beytía Mde L, Dekomien G, Hoffjan S, et al. High creatine kinase levels and white matter changes:clinical and genetic spectrum of congenital muscular dystrophies with laminin alpha-2 deficiency[J]. Mol Cell Probes, 2014, 28(4): 118-122. DOI:10.1016/j.mcp.2013.11.002 (  0) 0) |
| [28] |
Brancaccio P, Lippi G, Maffulli N. Biochemical markers of muscular damage[J]. Clin Chem Lab Med, 2010, 48(6): 757-767. (  0) 0) |
| [29] |
Jones KJ, Morgan G, Johnston H, et al. The expanding phenotype of laminin alpha2 chain (merosin) abnormalities:case series and review[J]. J Med Genet, 2001, 38(10): 649-657. DOI:10.1136/jmg.38.10.649 (  0) 0) |
| [30] |
Taratuto AL, Lubieniecki F, Díaz D, et al. Merosin-deficient congenital muscular dystrophy associated with abnormal cerebral cortical gyration:an autopsy study[J]. Neuromuscul Disord, 1999, 9(2): 86-94. DOI:10.1016/S0960-8966(98)00112-6 (  0) 0) |
| [31] |
Farina L, Morandi L, Milanesi I, et al. Congenital muscular dystrophy with merosin deficiency:MRI findings in five patients[J]. Neuroradiology, 1998, 40(12): 807-811. DOI:10.1007/s002340050689 (  0) 0) |
| [32] |
Korones DN, Brown MR, Palis J. "Liver function tests" are not always tests of liver function[J]. Am J Hematol, 2001, 66(1): 46-48. DOI:10.1002/1096-8652(200101)66:1<46::AID-AJH1007>3.0.CO;2-O (  0) 0) |
| [33] |
常杏芝, 袁云, 秦炯. 以转氨酶升高为主要临床表现的隐匿性肌肉病分析[J]. 中国医刊, 2006, 41(4): 42-44. DOI:10.3969/j.issn.1008-1070.2006.04.016 (  0) 0) |
| [34] |
Farrar MA, Kiernan MC. The genetics of spinal muscular atrophy:progress and challenges[J]. Neurotherapeutics, 2015, 12(2): 290-302. DOI:10.1007/s13311-014-0314-x (  0) 0) |
| [35] |
Suthar R, Sankhyan N. Duchenne muscular dystrophy:a practice update[J]. Indian J Pediatr, 2018, 85(4): 276-281. DOI:10.1007/s12098-017-2397-y (  0) 0) |
| [36] |
Rooney JE, Knapp JR, Hodges BL, et al. Laminin-111 protein therapy reduces muscle pathology and improves viability of a mouse model of merosin-deficient congenital muscular dystrophy[J]. Am J Pathol, 2012, 180(4): 1593-1602. DOI:10.1016/j.ajpath.2011.12.019 (  0) 0) |
| [37] |
Gawlik KI, Durbeej M. Skeletal muscle laminin and MDC1A:pathogenesis and treatment strategies[J]. Skelet Muscle, 2011, 1(1): 9. DOI:10.1186/2044-5040-1-9 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


