2. 中南大学湘雅二医院儿童医学中心儿童心血管专科/中南大学儿科学研究所, 湖南 长沙 410011
川崎病(Kawasaki disease, KD)是一种急性血管炎性疾病,主要侵犯中、小动脉,以冠状动脉病变(coronary artery lesion, CAL)为主。KD多发于婴幼儿和学龄前儿童,男女之比约(1.5~1.8): 1[1]。未经治疗的KD患儿的心脏损害高达25%,约3%~5%接受治疗的患儿仍会发展为CAL[2]。KD在全世界各地区发病率呈逐年上升趋势[3],在发达国家和一些发展中国家已经取代风湿性心脏病,成为儿童获得性心脏病的最常见原因[4]。KD发病机制至今尚不明确,目前认为与感染、免疫功能异常和遗传易感性因素等相关[5]。血清淀粉样蛋白A(serum amyloid A, SAA)是由肝脏产生的炎症性载脂蛋白家族,可引起全身系统性炎症。Alwaili等[6]发现SAA基因多态性与冠状动脉性疾病的发生密切相关,可更有效地预测冠状动脉扩张的发生。目前国内外尚无SAA基因多态性与KD相关性的研究,SAA1基因rs4638289、rs7131332位点多态性在国内外研究较多。Zhang等[7]发现与非肥胖儿童相比,SAA基因rs4638289位点多态性频率在肥胖儿童中显著增加。Xie等[8]发现SAA基因rs4638289位点与非糖尿病患者血浆葡萄糖水平显著相关。Zhang等[9]发现SAA基因rs7131332位点多态性与脑梗死显著相关,rs7131332位点AA基因型可能是脑梗死患者的高危因素。本研究对SAA基因rs4638289、rs7131332位点多态性进行分析,旨在探讨该基因位点多态性与KD发病及其并发CAL之间是否存在关联,进而从分子遗传学角度为探索KD的遗传易感性提供参考。
1 资料与方法 1.1 研究对象随机选取2013~2017年间在中南大学湘雅医学院附属株洲医院治疗的105例汉族KD患儿为KD组,其中男66例,女39例,年龄7个月至6岁,平均年龄30±17个月。所有患儿均符合KD诊断标准[10],入院前均未经丙种球蛋白和阿司匹林治疗。KD组再根据是否合并CAL[10],分为CAL组和无冠状动脉损伤(non-CAL, NCAL)组。CAL组男13例,女10例,平均年龄29±16个月;NCAL组男53例,女29例,平均年龄31±17个月。选取同期在该院体检的汉族儿童100例为对照组,其中男60例,女40例,年龄7个月至6岁,平均年龄33±17个月。对照组儿童均无感染性疾病、风湿性疾病、心血管疾病及既往KD病史。KD组与对照组之间的性别构成(χ2=0.177,P=0.674)及年龄(t=-1.250,P=0.213)比较差异均无统计学意义,CAL组和NCAL组之间的性别构成(χ2=0.506,P=0.626)及年龄(t=0.407,P=0.685)比较差异均无统计学意义。各组SAA1基因rs4638289、rs7131332位点基因型分布符合Hardy-Weinberg遗传平衡定律(P > 0.05),表明选取对象具有群体代表性,样本量符合统计学计算最低要求。本研究已获得该院医学伦理委员会批准,伦理审批号:(2018)伦审(K)第(0324)号。全部入选对象均提前征得患者儿监护人知情同意,并签署知情同意书。
1.2 标本采集患儿于入院第1天在其家长或监护人知情同意下,使用一次性采血管(含抗凝剂5%的EDTA-K2)抽取2 mL静脉血,立即提取DNA或置于-80℃冰箱保存,2个月内提取DNA。
1.3 基因组DNA的提取应用Promega DNA提取试剂盒,按照说明书要求提取血液基因组DNA,并进行浓度和纯度的测定,置于-80℃冰箱保存。
1.4 基因多态性的检测应用聚合酶链-限制性片段长度多态性技术(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)鉴定KD组和对照组SAA1基因rs4638289、rs7131332位点基因型。SAA1基因rs4638289位点上游引物:5'-GGTTGTTGAAGTCTATGTTATGCC-3';下游引物:5'-CTCCTCGTTCATTCTCTTCTCAGT-3',片段长度为399 bp。SAA1基因rs7131332位点上游引物:5'-GTAGGGACTTTGTTGAGAAGCC-3';下游引物:5'-GGCTTGGGCTGTACTCTGAA-3',片段长度为385 bp。引物由上海生工生物工程技术服务有限公司合成。PCR反应体系25 μL:T3 Super PCR Mix 22 μL,上下游引物各1 μL,DNA 1 μL。PCR反应条件均为:98℃预变性2 min;98℃变性10 s,59℃退火10 s,72℃延伸5 s,35个循环;72℃终末延伸2 min,4℃保存。反应在PCR扩增仪(美国Applied Biosystems公司)上进行。扩增产物进行琼脂糖凝胶电泳并于紫外灯下照相,初步鉴定扩增是否成功。扩增产物送测序公司(上海铂尚生物技术有限公司)进行基因测序。测序结果在Chromas软件中进行阅读分析。
1.5 统计学分析采用SPSS 22.0软件对数据进行统计分析,符合正态分布计量资料采用均数±标准差(x±s)表示,基因型和等位基因频率采用百分率(%)表示,两组间比较采用χ2检验。使用优势比(OR)评估相对危险度并计算95%置信区间(95%CI)。P < 0.05为差异有统计学意义。
2 结果 2.1 临床资料KD组临床表现有:发热105例(100%),皮疹73例(69.5%),非化脓性眼结合膜充血82例(78.1%),口腔黏膜充血93例(88.6%),非化脓性淋巴结肿大67例(63.8%),手足硬肿64例(61.0%),指趾端脱皮65例(61.9%),肛周脱皮42例(40.0%)。在KD组中,有冠状动脉扩张者23例(21.9%)。
2.2 SAA1基因PCR扩增结果按PCR反应体系及条件扩增,经1.5%琼脂糖凝胶电泳,以Marker为核酸分子质量参照标准,PCR产物条带位于300~400 bp之间,扩增产物为目标片段,且附近没有其他条带,符合实验要求,见图 1。
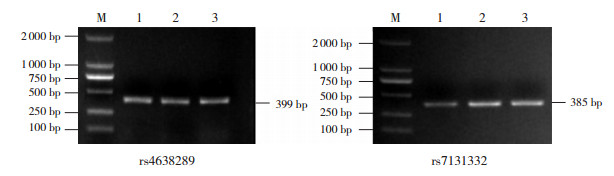
|
图 1 SAA1基因PCR电泳图 M:Marker;1~3泳道:SAA1基因片段的PCR产物。 |
SAA1基因rs4638289位点多态性表现为A突变为T,基因型为AA、AT、TT。rs7131332位点多态性表现为A突变为G,基因型为AA、AG、GG。见图 2~3。
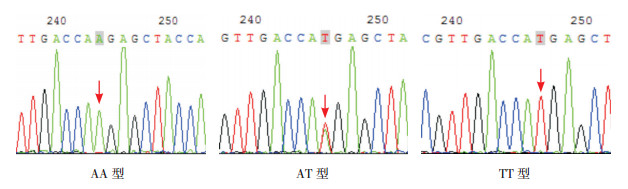
|
图 2 SAA1基因rs4638289位点测序图 箭头所指为多态位点,单峰为纯合子基因型,套峰为杂合子基因型。 |
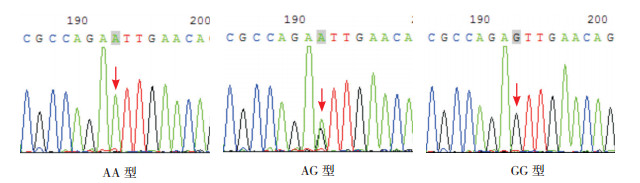
|
图 3 SAA1基因rs7131332位点测序图 箭头所指为多态位点,单峰为纯合子基因型,套峰为杂合子基因型。 |
KD组rs4638289位点AA、AT、TT基因型分布和A、T等位基因分布与对照组比较差异无统计学意义(P > 0.05,表 1)。CAL组rs4638289位点AA、AT、TT基因型分布与NCAL组比较差异有统计学意义(P=0.016);A、T等位基因分布差异无统计学意义(P > 0.05,表 2)。携带AT基因型是KD并发CAL的保护因素(OR=0.276,95%CI:0.099~0.772,P=0.011),见表 3。
| 表 1 KD组及对照组rs4638289位点基因型及等位基因分布比较 |
|
|
| 表 2 CAL组及NCAL组rs4638289位点基因型及等位基因分布比较 |
|
|
| 表 3 CAL组及NCAL组rs4638289位点基因型及等位基因分布风险分析 |
|
|
KD组rs7131332位点AA、AG、GG基因型分布和A、G等位基因分布与对照组比较差异均无统计学意义(P > 0.05,表 4)。CAL组rs7131332位点AA、AG、GG基因型分布和A、G等位基因分布与NCAL组比较差异均无统计学意义(P > 0.05,表 5)。
| 表 4 KD组及对照组rs7131332位点基因型及等位基因分布比较 |
|
|
| 表 5 CAL组及NCAL组rs7131332位点基因型及等位基因分布比较 |
|
|
KD可在全球所有种族中发生,但在亚洲种族中发病率最高[11]。在美国,亚洲婴儿的患病率比黑人高3倍,比白人高6倍[12],显然遗传因素是影响KD发病的重要因素[13]。免疫系统的异常激活被认为是KD的主要特征,细胞因子和炎性介质相互影响,以增强免疫效果;基因多态性影响KD中细胞因子的表达,从而进一步影响KD的发病。目前已经发现多个细胞因子基因多态性与KD易感性有关,如肿瘤坏死因子基因、白细胞介素相关基因、血小板内皮细胞黏附分子-1等一些调节免疫、炎症的单核苷酸多态性位点[14]。多个多态性等位基因会影响KD的易感性,不同种族的人群具有不同的等位基因表达模式。SAA是一个包括SAA1~4同源体的炎症性载脂蛋白,其在炎症的急性反应期中显著上调(> 1 000倍),已被用作各种炎症和自身免疫性疾病的生物标志物[15]。SAA基因簇位于11号染色体的短臂上,位于p15.1处,只有SAA1和SAA2基因分别编码产生的SAA1和SAA2蛋白起主要作用。SAA1基因的多态性可赋予免疫应答灵活性,其基因的变化可影响SAA的表达从而影响相应细胞因子的功能[16]。
脂质代谢紊乱是KD急性期的表现,并最终导致血清总胆固醇降低和三酰甘油增加[2],这种脂质状态改变可能在KD诊断后3年内持续存在。超声显示患有KD病史的年轻成年人的血管弹性降低和颈动脉内膜中层厚度异常[17],并且尸检研究表明KD患者可能患有更严重的动脉粥样硬化病变[18]。Xu等[19]发现SAA1基因与中国人群的血脂水平有关。Carty等[20]发现SAA基因多态性与心血管疾病和高密度脂蛋白(HDL)相关。Xie等[21-22]发现SAA基因多态性与颈动脉内膜中层厚度和冠状动脉疾病有关。Whitin等[23]发现KD患儿急性期的SAA水平明显高于其他疾病,SAA可能在KD病理生理学中起重要作用。
本研究对KD患儿及健康儿童进行病例对照研究,比较SAA1基因型分布情况。临床资料显示,KD患儿中CAL 23例,发生率为21.9%。KD组与对照组比较,SAA1基因rs4638289、rs7131332位点基因型和等位基因分布比较差异均无统计学意义。CAL组与NCAL组比较,rs4638289位点AA、AT、TT基因型分布差异有统计学意义,SAA1基因rs4638289位点多态性可能与KD并发CAL有关,携带AT基因型可能使KD并发CAL风险降低。SAA在脂质代谢中起重要作用,并参与细菌清除、炎症调节和肿瘤发病机制。一方面,SAA作为一种载脂蛋白,与脂质水平相关,例如80%的SAA可与HDL结合,富含SAA的HDL抗氧化作用减弱,可导致动脉粥样硬化的形成[24]。SAA的亲脂性有助于将其与脂质运输和代谢及CAL联系起来。另一方面,SAA作为细胞因子样蛋白的功能已在细胞间通讯及炎症、免疫、肿瘤和保护途径的反馈中得到公认[25]。Sun等[26]发现SAA通过依赖MYD88的机制改变巨噬细胞表型并调节巨噬细胞功能,从而影响炎症反应的程度和持续时间。SAA促进了中性粒细胞的成熟和动员[27],同时上调内皮及单核-巨噬细胞系中IL-1、IL-6、IL-23、TNF-α等众多炎症因子的表达[28],加重机体的炎症水平,同时诱导抗原细胞和单核细胞组织因子释放,启动凝血系统,促使其在动脉血管壁内的沉积增加,影响冠状动脉及血管疾病的发生发展。
综上所述,本研究发现SAA1基因rs4638289位点与KD并发CAL有关,携带AT基因型可能使KD并发CAL风险降低。能否阻断KD患儿体内SAA的表达,从而减轻或抑制KD的发病,为临床诊疗提供了一个新思路。但SAA1基因多态性与血脂水平之间的关系尚不清楚,仍未阐明SAA如何驱动CAL的确切机制。本研究结果尚受到研究对象来源的地区、种族及样本量较小的影响,KD及其CAL与SAA1基因多态性的相关性,还有待进一步深入研究。
| [1] |
Wu MH, Lin MT, Chen HC, et al. Postnatal risk of acquiring Kawasaki disease:a nationwide birth cohort database study[J]. J Pediatr, 2017, 180: 80-86. DOI:10.1016/j.jpeds.2016.09.052 (  0) 0) |
| [2] |
Marchesi A, Tarissi de Jacobis I, Rigante D, et al. Kawasaki disease:guidelines of the Italian Society of Pediatrics, part I-definition, epidemiology, etiopathogenesis, clinical expression and management of the acute phase[J]. Ital J Pediatr, 2018, 44(1): 102. DOI:10.1186/s13052-018-0536-3 (  0) 0) |
| [3] |
Singh S, Vignesh P, Burgner D. The epidemiology of Kawasaki disease:a global update[J]. Arch Dis Child, 2015, 100(11): 1084-1088. DOI:10.1136/archdischild-2014-307536 (  0) 0) |
| [4] |
Martin M, Wrotniak BH, Hicar M. Suppressed plasmablast responses in febrile infants, including children with Kawasaki disease[J]. PLoS One, 2018, 13(3): e0193539. DOI:10.1371/journal.pone.0193539 (  0) 0) |
| [5] |
Del Principe D, Pietraforte D, Gambardella L, et al. Pathogenetic determinants in Kawasaki disease:the haematological point of view[J]. J Cell Mol Med, 2017, 21(4): 632-639. DOI:10.1111/jcmm.12992 (  0) 0) |
| [6] |
Alwaili K, Bailey D, Awan Z, et al. The HDL proteome in acute coronary syndromes shifts to an inflammatory profile[J]. Biochim Biophys Acta, 2012, 1821(3): 405-415. DOI:10.1016/j.bbalip.2011.07.013 (  0) 0) |
| [7] |
Zhang X, Tang QZ, Wan AY, et al. SAA1 gene variants and childhood obesity in China[J]. Lipids Health Dis, 2013, 12: 161. DOI:10.1186/1476-511X-12-161 (  0) 0) |
| [8] |
Xie X, Ma YT, Yang YN, et al. SAA1 genetic polymorphisms are associated with plasma glucose concentration in non-diabetic subjects[J]. Clin Chem Lab Med, 2013, 51(12): 2331-2334. (  0) 0) |
| [9] |
Zhang LJ, Yuan B, Li HH, et al. Associations of genetic polymorphisms of SAA1 with cerebral infarction[J]. Lipids Health Dis, 2013, 12: 130. DOI:10.1186/1476-511X-12-130 (  0) 0) |
| [10] |
江载芳, 申昆玲, 沈颖. 诸福棠实用儿科学[M]. 第8版. 北京: 人民卫生出版社, 2015: 778-789.
(  0) 0) |
| [11] |
Okubo Y, Nochioka K, Sakakibara H, et al. National survey of pediatric hospitalizations due to Kawasaki disease and coronary artery aneurysms in the USA[J]. Clin Rheumatol, 2017, 36(2): 413-419. (  0) 0) |
| [12] |
Rowley AH. Kawasaki disease:novel insights into etiology and genetic susceptibility[J]. Annu Rev Med, 2011, 62: 69-77. DOI:10.1146/annurev-med-042409-151944 (  0) 0) |
| [13] |
Kuo HC, Hsu YW, Wu MS, et al. Intravenous immunoglobulin, pharmacogenomics, and Kawasaki disease[J]. J Microbiol Immunol Infect, 2016, 49(1): 1-7. DOI:10.1016/j.jmii.2014.11.001 (  0) 0) |
| [14] |
Xie X, Shi X, Liu M. The roles of genetic factors in Kawasaki disease:a systematic review and Meta-analysis of genetic association studies[J]. Pediatr Cardiol, 2018, 39(2): 207-225. (  0) 0) |
| [15] |
Burgess EJ, Hoyt LR, Randall MJ, et al. Bacterial lipoproteins constitute the TLR2-stimulating activity of serum amyloid A[J]. J Immunol, 2018, 201(8): 2377-2384. DOI:10.4049/jimmunol.1800503 (  0) 0) |
| [16] |
Kapelski P, Skibinska M, Maciukiewicz M, et al. Association study of functional polymorphisms in interleukins and interleukin receptors genes:IL1A, IL1B, IL1RN, IL6, IL6R, IL10, IL10RA and TGFB1 in schizophrenia in Polish population[J]. Schizophr Res, 2015, 169(1-3): 1-9. DOI:10.1016/j.schres.2015.10.008 (  0) 0) |
| [17] |
McCrindle BW, McIntyre S, Kim C, et al. Are patients after Kawasaki disease at increased risk for accelerated atherosclerosis?[J]. J Pediatr, 2007, 151(3): 244-248. DOI:10.1016/j.jpeds.2007.03.056 (  0) 0) |
| [18] |
Marchesi A, Tarissi de Jacobis I, Rigante D, et al. Kawasaki disease:guidelines of Italian Society of Pediatrics, part II-treatment of resistant forms and cardiovascular complications, follow-up, lifestyle and prevention of cardiovascular risks[J]. Ital J Pediatr, 2018, 44(1): 103. DOI:10.1186/s13052-018-0529-2 (  0) 0) |
| [19] |
Xu XL, Sun XT, Pang L, et al. Rs12218 in SAA1 gene was associated with serum lipid levels[J]. Lipids Health Dis, 2013, 12: 116. DOI:10.1186/1476-511X-12-116 (  0) 0) |
| [20] |
Carty CL, Heagerty P, Heckbert SR, et al. Association of genetic variation in serum amyloid-A with cardiovascular disease and interactions with IL6, IL1RN, IL1beta and TNF gene in the cardiovascular health study[J]. J Atheroscler Thromb, 2009, 16(4): 419-430. DOI:10.5551/jat.No968 (  0) 0) |
| [21] |
Xie X, Ma YT, Yang YN, et al. Polymorphisms in the SAA1/2 gene are associated with carotid intima media thickness in healthy Han Chinese subjects:the cardiovascular risk survey[J]. PLoS One, 2010, 5(11): e13997. DOI:10.1371/journal.pone.0013997 (  0) 0) |
| [22] |
Xie X, Ma YT, Yang YN, et al. Genetic polymorphisms of serum amyloid A1 and coronary artery disease risk[J]. Tissue Antigens, 2015, 85(3): 168-176. DOI:10.1111/tan.12516 (  0) 0) |
| [23] |
Whitin JC, Yu TS, Ling XB, et al. A novel truncated form of serum amyloid A in Kawasaki disease[J]. PLoS One, 2016, 11(6): e0157024. DOI:10.1371/journal.pone.0157024 (  0) 0) |
| [24] |
Xie X, Ma YT, Yang YN, et al. Serum uric acid levels are associated with polymorphism in the SAA1 gene in Chinese subjects[J]. PLoS One, 2012, 7(6): e40263. DOI:10.1371/journal.pone.0040263 (  0) 0) |
| [25] |
Sack GH Jr. Serum amyloid A-a review[J]. Mol Med, 2018, 24(1): 46. (  0) 0) |
| [26] |
Sun L, Zhou H, Zhu Z, et al. Ex vivo and in vitro effect of serum amyloid A in the induction of macrophage M2 markers and efferocytosis of apoptotic neutrophils[J]. J Immunol, 2015, 194(10): 4891-4900. DOI:10.4049/jimmunol.1402164 (  0) 0) |
| [27] |
Murdoch CC, Espenschied ST, Matty MA, et al. Intestinal serum amyloid A suppresses systemic neutrophil activation and bactericidal activity in response to microbiota colonization[J]. PLoS Pathog, 2019, 15(3): e1007381. DOI:10.1371/journal.ppat.1007381 (  0) 0) |
| [28] |
Lucherini OM, Lopalco G, Cantarini L, et al. Critical regulation of Th17 cell differentiation by serum amyloid-A signalling in Behcet's disease[J]. Immunol Lett, 2018, 201: 38-44. DOI:10.1016/j.imlet.2018.10.013 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


