新生儿高胆红素血症(neonatal hyperbiliru-binemia, NH)是新生儿期十分常见的临床表现。严重的高胆红素血症可引起不同程度和不同形式的神经系统损伤,表现为一个或多个系统的功能障碍,称之为胆红素所致的神经功能障碍(bilirubin-induced neurological dysfunction, BIND)。随着医学的不断发展,典型的新生儿胆红素脑病(neonatal bilirubin encephalopathy, NBE)并不多见[1],临床上更多见的是轻型神经功能障碍[2],缺乏NBE的常规磁共振(MRI)特征性改变。
弥散张量成像(diffusion tensor imaging, DTI)通过测量脑感兴趣区(region of interest, ROI)的各向异性分数(fractional anisotropy, FA),定量反映大脑微观结构改变,是弥散加权成像的发展和深化[3]。国内外对脑部缺氧缺血、脑白质损伤、脑发育和脑认知功能障碍等疾病的研究居多[4-5]。近年来,有学者研究NH患儿头部DTI改变,发现脑ROI的FA值与胆红素所致脑损伤密切相关,尤其是苍白球、丘脑底核、脑干核团等神经核团的受损[6-7]。游离胆红素可引起神经元及神经胶质细胞损伤,两者受损时,神经纤维的结构也可发生破坏[8-10]。几乎所有神经核团与大脑皮质联系的神经纤维束走行于内囊,本研究利用DTI定量监测脑白质神经纤维的优势,了解BIND患儿重要神经核团及神经纤维可能的信号改变,对不同程度NH患儿进行头部DTI序列扫描,选取苍白球、内囊前肢、内囊后肢、小脑齿状核4个ROI,测量FA值,探讨DTI对BIND患儿的评估意义。
1 资料与方法 1.1 研究对象选取2017年1月至2018年1月我院新生儿科住院治疗的91例NH足月儿及10例正常健康足月儿(对照组)为研究对象。NH患儿纳入标准:(1)符合NH的诊断标准[11];(2)出生胎龄37~42周;(3)出生体重2 500~4 000 g;(4)年龄≤10 d;(5)血清胆红素以未结合胆红素升高为主;(6)无其他基础疾病,排除合并其他疾病,如脑病、颅内感染、神经系统先天性疾病、遗传代谢性疾病、活动性出血等。对照组纳入标准:同期神经系统正常且血清总胆红素(total serum bilirubin, TSB)峰值未达到干预标准(在Bhutani曲线以下)及TSB < 205 µmol/L的足月新生儿。
根据TSB峰值[6, 12],将NH患儿分3组:轻-中度增高组(TSB 205~341 µmol/L,n=45),重度增高组(TSB 342~427 µmol/L,n=35),极重度增高组(TSB > 427 µmol/L,n=11)。根据有无异常神经神经系统表现,将NH患儿分为非神经功能障碍组(n=71)和神经功能障碍组(n=20)。
本研究获得湖南省人民医院伦理委员会批准(2016074)及家长签署知情同意书。
1.2 资料收集采集所有研究对象的临床信息,主要包括性别、出生胎龄、出生体重、DTI扫描日龄、TSB、有无神经系统异常表现。异常神经系统表现包括易激惹、嗜睡、昏迷、呼吸暂停、抽搐、肌张力异常、哭声异常、原始反射异常等[13]。
1.3 检查方法研究对象入院72 h内完善头部MRI平扫和DTI序列扫描,检查前45 min肌肉注射苯巴比妥5 mg/kg镇静。MRI以苍白球T1WI异常高信号作为急性胆红素脑病的判读依据(结合临床,排除缺氧缺血、遗传代谢、中毒等疾病所致的苍白球信号增高因素)。得到原始弥散图及处理后的彩色伪图。采用德国Siemens公司3.0 T磁共振扫描仪,标准12通道线圈,扫描序列:头部轴位T1WI、T2WI、DTI。DTI扫描采用单次激发自旋回波成像,扫描参数:重复时间(TR)4 900 ms,回波时间(TE)91 ms,扩散敏感梯度20个方向,层厚=4 mm,层间距=1.5 mm。视野(FOV):1 000 mm×1 000 mm,矩阵128 mm×128 mm。运用MRWP工作站的Neuro 3D软件分析,测量FA值。图像处理及数据测量采用工作站自带的图像后处理DTI分析软件。选择4个ROI:(1)苍白球,(2)内囊前肢,(3)内囊后肢,(4)小脑齿状核(图 1)。每个ROI取直径为4 mm的椭圆形,双侧ROI的FA值均测量3次,取其均值。采用单盲法评价研究结果,经过2名经培训的儿科医师测定其FA值,头部MRI平扫由2名放射科医师阅片后报告结果。
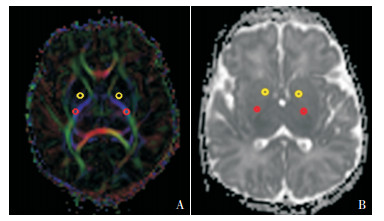
|
图 1 左右侧苍白球(标黄)及内囊后肢(标红)ROI绘制示例 结合各向异性分数(FA)伪彩图(A)和表观弥散系数(ADC)图(B)定位于双侧苍白球和内囊后肢,并分别手动勾画圆圈(直径约4 mm)。 |
采用SPSS 22.0软件进行数据处理。计数资料用例数和构成比(%)表示,组间比较采用χ2检验。正态分布的计量资料采用均数±标准差(x±s)表示,两组间比较采用两样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 临床基本资料比较轻-中度增高组、重度增高组、极重度增高组、对照组患儿性别、出生胎龄、出生体重、DTI扫描日龄差异均无统计学意义(P > 0.05)。神经功能障碍组与非神经功能障碍组患儿性别、出生胎龄、出生体重、DTI扫描日龄差异均无统计学意义(P > 0.05)。见表 1~2。
| 表 1 轻-中度增高组、重度增高组、极重度增高组、对照组患儿基本资料比较 |
|
|
| 表 2 神经功能障碍与非神经功能障碍组患儿基本资料比较 |
|
|
极重度增高组苍白球FA值低于对照组、轻-中度增高组及重度增高组(P < 0.05),重度增高组苍白球FA值低于对照组(P < 0.05)。极重度增高组内囊后肢FA值低于对照组、轻-中度增高组及重度增高组(P < 0.05)。4组内囊前肢、小脑齿状核FA值差异无统计学意义(P > 0.05)。见表 3。
| 表 3 轻-中度增高组、重度增高组、极重度增高组、对照组患儿ROI的FA值比较 |
|
|
20例神经功能障碍组患儿中,胆红素轻-中度增高2例,重度增高10例,极重度增高8例。神经功能障碍组患儿TSB值高于非神经功能障碍组(426±92 vs 320±52 µmol/L,P < 0.05)。神经功能障碍组患儿苍白球、内囊后肢FA值低于非神经功能障碍组(P < 0.01),两组内囊前肢及小脑齿状核的FA值差异无统计学意义(P > 0.05),见表 4。
| 表 4 神经功能障碍组与非神经功能障碍组患儿各ROI的FA值比较 |
|
|
BIND在新生儿期常表现为嗜睡、激惹、哭声异常、肌张力异常及听觉障碍等[13],早期识别及干预可以逆转脑损伤。典型的NBE急性期双侧苍白球区MRI呈T1WI高信号,慢性期呈T2WI高信号,可作为NBE的MRI诊断特征[9],但有学者认为由于新生儿正常髓鞘化等因素可引起假阳性现象[5],同时MRI信号的高低凭裸眼判断主观性太强,常规MRI评估胆红素所致脑损伤存在局限性。
DTI能直观地显示活体脑白质纤维束在空间的走行、分布和病理变化,是基于水分子弥散原理而成像,用来评价脑白质损伤及显示其空间形态的成像技术[14],其FA值可以量化神经纤维的数量和完整性,评估脑白质损伤程度,神经纤维损伤程度重,FA值越低。胆红素对神经系统的损伤机制目前尚不明确。有研究报道胆红素可引起神经元及神经胶质细胞坏死和凋亡[15]。体外研究发现胶质细胞会受到胆红素的影响,如星形胶质细胞、小胶质细胞在高胆红素环境下表现出炎症介质的分泌,推测胆红素脑损伤时可能存在神经炎症反应[16-17]。本研究应用FA值,来探讨DTI与NH神经核团及神经纤维损伤的关系。
胆红素引起神经元和神经胶质细胞受损时,神经纤维可出现一定程度髓鞘化不良或髓鞘磷脂的破坏、丢失[18-19]。Cece等[20]观察30例NH患儿苍白球变化,发现表观弥散系数(ADC)明显高于对照组,而FA值却减小。肖斌等[7]报道NH患儿ROI神经纤维的FA值降低,与胆红素水平呈线性相关。Wisnowski等[21]报道NH患儿除经典神经核团受损外,还有小脑上角和丘脑上辐射的白质纤维受损。本研究与上述研究结果一致,胆红素极重度增高组苍白球及内囊后肢FA值明显下降。轻-中度增高组双侧苍白球、内囊后肢FA值下降,但差异无统计学意义,这一结果证明了重度以上胆红素增高才会出现中枢神经系统影像的改变,本研究通过DTI显示出,在极重度高胆红素组患儿不仅仅有脑神经核团的损伤,同时还存在脑白质神经纤维的信号异常。经典胆红素脑损伤研究中,神经毒性部位有高度的选择性,几乎不会累及到脑白质,我们推测这种活体脑白质神经纤维DTI的改变是微观的,可能不会出现明显的病理变化,DTI能较好地显示脑白质纤维束,或许将来能用于探索BIND的神经病理基础。
本研究中91例NH患儿入组时已排除合并其他疾病,如脑病、颅内感染、神经系统先天性疾病、遗传代谢性疾病、活动性出血等干扰因素,神经功能障碍组与非神经功能障碍组苍白球、内囊后肢FA值均明显下降。FA值的变化与临床胆红素所致神经功能障碍具有一定的关系,而在内囊前肢及小脑齿状核FA值也有变化,但差异无统计学意义。在重度、极重度高胆红素血症患者中,大脑敏感区域FA值下降提示临床出现BIND的潜在风险。
BIND一般发生在重度高胆红素水平患儿,但本研究有2例胆红素轻-中度增高者也出现了症状,总胆红素水平高低不是唯一发生胆红素脑病的条件,它对个体的危害性受机体状态和内环境等多种因素影响[12]。我们需要结合临床表现及其他相关辅助检查对BIND进行全面评估。
研究报道,测量NBE患儿听觉通路上ROI FA值显著下降,严重高胆红素血症的新生儿听力损伤是正常新生儿的10~50倍[2, 22-24]。我们随访到1例日龄为7 d时TSB峰值> 427 μmol/L,DTI ROI FA值下降,出院时脑干诱发电位波峰延迟的患儿,随访3个月,监测脑干诱发电位仍异常,特别对高频声音刺激反应不敏感。复查头部DTI,未发现常规MRI异常信号,而发现内囊后肢、小脑齿状核区域FA值较正常3月龄儿童降低。MRI结合DTI检查是否在远期的脑损伤评估更具有优势,需要更大样本的研究。本研究在后期随访中,绝大部分患儿异常神经系统表现消失,神经损伤得到修复,此时DTI可能会发生变化。出院后家长接受DTI复查的依从性下降,因此缺乏患儿后期DTI的比较。在今后的研究中,动态监测DTI,将是我们工作的重点。
综上所述,DTI的FA值明显异常可能成为新生儿BIND的早期监测指标。本研究由于病例数有限,存在临床随访时间有限、失访等不足之处,但希望能为将来开展大样本多中心的研究提供参考依据。
| [1] |
Stevenson DK, Watchko JF, Maisels MJ, et al. Care of the Jaundiced Neonate[M]. Europe: McGraw-Hill Education, 2012: 12-16.
(  0) 0) |
| [2] |
Bhutani VK, Wong R. Bilirubin-induced neurologic dysfunction (BIND)[J]. Semin Fetal Neonatal Med, 2015, 20(1): 1. (  0) 0) |
| [3] |
Thomalla G, Glauche V, Koch MA, et al. Diffusion tensor imaging detects early Wallerian degeneration of the pyramidal tract after ischemic stroke[J]. Neuroimage, 2004, 22(4): 1767-1774. (  0) 0) |
| [4] |
Baldoli C, Scola E, Della Rosa PA, et al. Maturation of preterm newborn brains:a fMRI-DTI study of auditory processing of linguistic stimuli and white matter development[J]. Brain Struct Funct, 2015, 220(6): 3733-3751. (  0) 0) |
| [5] |
李冰肖, 柳国胜, 凌雪英, 等. MRI和DTI评价早产儿脑白质髓鞘发育[J]. 中国当代儿科杂志, 2016, 18(6): 476-481. (  0) 0) |
| [6] |
Yan R, Han D, Ren J, et al. Diagnostic value of conventional MRI combined with DTI for neonatal hyperbilirubinemia[J]. Pediatr Neonatol, 2018, 59(2): 161-167. (  0) 0) |
| [7] |
肖斌, 谭长连. 基于小脑齿状核的新生儿高胆红素血症脑损伤的DTI研究[J]. 中国医师杂志, 2019, 21(7): 989-992. (  0) 0) |
| [8] |
Razek AAKA, Taman SE, El Regal ME, et al. Diffusion tensor imaging of microstructural changes in the gray and white matter in patients with Crigler-Najjar syndrome type I[J]. J Comput Assist Tomogr, 2020, 44(3): 393-398. (  0) 0) |
| [9] |
Wisnowski JL, Panigrahy A, Painter MJ, et al. Magnetic resonance imaging of bilirubin encephalopathy:current limitations and future promise[J]. Semin Perinatol, 2014, 38(7): 422-428. (  0) 0) |
| [10] |
Watchko JF. Kernicterus and the molecular mechanisms of bilirubin-induced CNS injury in newborns[J]. Neuromolecular Med, 2006, 8(4): 513-529. (  0) 0) |
| [11] |
中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 新生儿高胆红素血症诊断和治疗专家共识[J]. 中华儿科杂志, 2014, 52(10): 745-748. (  0) 0) |
| [12] |
Bhutani VK, Johnson-Hamerman L. The clinical syndrome of bilirubin-induced neurologic dysfunction[J]. Semin Fetal Neonatal Med, 2015, 20(1): 6-13. (  0) 0) |
| [13] |
Johnson L, Brown AK, Bhutani VK. BIND-a clinical score for bilirubin induced neurologic dysfunction in newborns[J]. Pediatrics, 1999, 104: 746-747. (  0) 0) |
| [14] |
靳金岩, 李洪义. MRI及功能成像改变对新生儿高胆红素脑病临床价值分析[J]. 中国CT和MRI杂志, 2019, 17(1): 12-14. (  0) 0) |
| [15] |
Groenendaal F, van der Grond J, de Vries LS. Cerebral metabolism in severe neonatal hyperbilirubinemia[J]. Pediatrics, 2004, 114(1): 291-294. (  0) 0) |
| [16] |
Brites D. The evolving landscape of neurotoxicity by unconjugated bilirubin:role of glial cells and inflammation[J]. Front Pharmacol, 2012, 3: 88. (  0) 0) |
| [17] |
Silva SL, Vaz AR, Barateiro A, et al. Features of bilirubin-induced reactive microglia:from phagocytosis to inflammation[J]. Neurobiol Dis, 2010, 40(3): 663-675. (  0) 0) |
| [18] |
Saksena S, Jain R, Narang J, et al. Predicting survival in glioblastomas using diffusion tensor imaging metrics[J]. J Magn Reson Imaging, 2010, 32(4): 788-795. (  0) 0) |
| [19] |
Fernandes A, Falcão AS, Silva RF, et al. MAPKs are key players in mediating cytokine release and cell death induced by unconjugated bilirubin in cultured rat cortical astrocytes[J]. Eur J Neurosci, 2007, 25(4): 1058-1068. (  0) 0) |
| [20] |
Cece H, Abuhandan M, Cakmak A, et al. Diffusion-weighted imaging of patients with neonatal bilirubin encephalopathy[J]. Jpn J Radiol, 2013, 31(3): 179-185. (  0) 0) |
| [21] |
Wisnowski JL, Panigrahy A, Painter MJ, et al. Magnetic resonance imaging abnormalities in advanced acute bilirubin encephalopathy highlight dentato-thalamo-cortical pathways[J]. J Pediatr, 2016, 174: 260-263. (  0) 0) |
| [22] |
邓敏, 何四平, 伍光春, 等. 胆红素脑病所致听力受损患儿听觉通路纤维束的DTI研究:各向异性分数和其他扩散系数的变化[J]. 临床放射学杂志, 2017, 36(11): 1679-1683. (  0) 0) |
| [23] |
Okumura A, Hayakawa M, Tsuji T, et al. Diffusion tensor imaging in infants with basal ganglia-thalamic lesions[J]. Eur J Paediatr Neurol, 2008, 12(5): 412-416. (  0) 0) |
| [24] |
Boskabadi H, Zakerihamidi M, Moradi A, et al. Risk factors for sensorineural hearing loss in neonatal hyperbilirubinemia[J]. Iran J Otorhinolaryngol, 2018, 30(99): 195-202. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


