无论是成人急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL),还是儿童ALL,初诊高白细胞(WBC)计数(在儿童ALL中一般定义为WBC≥50×109/L)均提示患者预后不良,常作为患者危险度分组的依据之一[1]。如何更加精确地对患者的长期预后进行评估,从而进行有效的精准治疗以期降低药物不良反应、提高疗效,是目前众多临床医师和基础研究者不断努力的方向。CD20是B淋巴细胞特异表面抗原,广泛表达于干细胞、浆细胞以外的正常和恶性分化B细胞的各个阶段。尽管大部分研究提示CD20阳性表达是B-ALL患者预后不良的因素,但CD20表达的预后价值在儿童和成人B-ALL中均未得到一致性的结论[2-14]。本研究纳入单中心接受CCLG-ALL2008方案[15]治疗B-ALL患儿821例,评价初诊时骨髓白血病细胞CD20阳性表达患儿的临床特点,以及CD20表达联合初诊WBC计数对儿童B-ALL的预后价值,为儿童B-ALL靶向治疗的探讨提供理论依据。
1 资料与方法 1.1 研究对象2008年4月至2015年4月在中国医学科学院血液病医院儿童血液病诊疗中心接受CCLG-ALL2008方案[15]治疗的初诊B-ALL患儿834例,其中821例可查阅到初诊时骨髓流式报告。821例患儿中,男492例,女329例,中位年龄4.3岁(范围:0.4~15岁)。回顾性分析821例患儿的临床特征,并随访观察其生存情况,分析CD20表达联合初诊WBC计数的预后价值。ALL诊断、疗效评价标准参照第3版《血液病诊断及疗效标准》[16]。
1.2 随访以患儿末次住院、门诊就诊或电话回访的方式进行随访,随访截止日期为2018年12月31日。中位随访时间59个月(范围2~128个月)。总生存(overall survival, OS)指自诊断到死亡或末次随访日期。无事件生存(event-free survival, EFS)指自诊断到第一次事件发生或末次随访日期。事件指白血病复发、失访、第二肿瘤或任何原因导致的死亡。
1.3 统计学分析采用SPSS 23.0软件进行统计学分析。计量资料以均数±标准差(x±s)表示,组间比较采用两样本t检验。计数资料采用例数和率(%)表示,组间比较采用χ2检验。采用Kaplan-Meier法进行单因素生存分析并绘制生存曲线,组间生存率的比较采用log-rank检验;采用Cox回归模型进行多因素生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 患儿一般资料及临床特征截至末次随访,821例患儿中40例失访,176例复发。821例患儿中,初诊骨髓白血病细胞CD20阴性者547例(66.6%),CD20阳性者274例(33.4%)。CD20阳性和阴性两组患儿性别比例、年龄分布、初诊时血红蛋白、初诊时血小板计数、初诊时WBC≥50×109/L患儿比例、移植患儿比例、诱导化疗第33天骨髓流式微小残留病(minimal residual disease, MRD)转阴率、危险度分组等差异均无统计意义(表 1)。
| 表 1 CD20阳性和阴性患儿临床特征比较 |
|
|
19例MLL基因重排患儿中18例为MLL-AF4,其中15例为CD20阴性患儿(占CD20阴性患儿2.7%),3例为CD20阳性患儿(占CD20阳性患儿1.1%),CD20阳性和阴性两组患儿MLL-AF4阳性率的差异无统计学意义(P=0.204)。融合基因TEL-AML1在CD20阴性、CD20阳性患儿中的阳性率分别为25.2%、16.8%,差异有统计学意义(P=0.007),见表 1。
2.2 生存分析对821例患儿进行单因素生存分析,预后不良因素有:初诊时高WBC计数(WBC≥50× 109/L)、较高的危险度分组(中危组、高危组)、早期泼尼松反应不良(泼尼松治疗第8天外周血白血病细胞≥1 000/μL)、CD20阳性表达(P < 0.05),见表 2。单因素分析后,将上述有统计学意义的预后因素纳入随后的多因素生存分析。
| 表 2 影响患儿预后的单因素分析 |
|
|
文献报道中CD20阳性表达对成人B-ALL预后的不良影响在WBC≥30×109/L或年龄小于30岁的患者中更显著[5-6]。本研究根据儿童白血病的特点,依据初诊WBC计数(WBC≥50×109/L vs WBC < 50×109/L)、年龄(1~ < 10岁vs < 1岁或≥ 10岁)、危险度(标危、中危、高危[15])、诱导化疗第33天骨髓流式MRD结果(异常细胞≥0.01%为阳性vs异常细胞 < 0.01%为阴性),就CD20的长期预后价值进行亚组分析,分析结果见表 3。
| 表 3 亚组分析CD20对患儿预后的影响 |
|
|
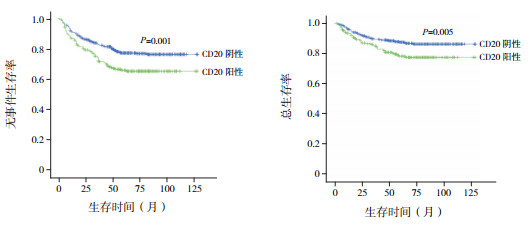
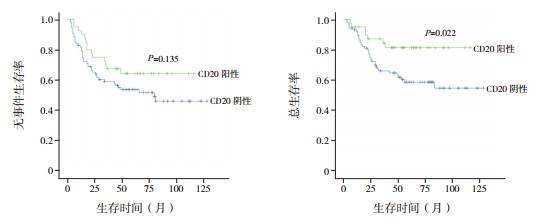
单因素分析显示,在WBC < 50×109/L的患儿中,CD20阳性患儿5年EFS率和5年OS率均显著低于CD20阴性患儿(P < 0.05),见表 3、图 1;进一步行多因素生存分析,显示CD20阳性是EFS率、OS率的独立危险因素(分别HR=1.634,P=0.001;HR=1.761,P=0.005)。而在WBC≥50×109/L的患儿中,CD20阳性和CD20阴性患儿5年EFS率差异无统计学意义(P=0.135);CD20阳性患儿5年OS率显著高于CD20阴性患儿(P=0.022),见表 3和图 2;进一步行多因素生存分析,显示CD20阳性是OS率的独立保护因素(HR=0.367,P=0.016)。
|
图 1 初诊WBC < 50×109/L的患儿中CD20对预后的影响 |
|
图 2 初诊WBC≥50×109/L的患儿中CD20对预后的影响 |
单因素分析显示,在第33天骨髓流式MRD阳性患儿中,CD20阳性患儿5年EFS率和5年OS率均显著低于CD20阴性患儿(P < 0.05),见表 3;进一步行多因素生存分析,显示CD20阳性是EFS率、OS率的独立危险因素(分别HR=1.828,P=0.030;HR=2.013,P=0.030)。
另外,在CD20阴性患儿中,WBC < 50×109/L和WBC≥50×109/L患儿5年EFS率和5年OS率差异均有统计学意义(P < 0.001),见表 4;进一步行多因素生存分析,显示WBC≥50×109/L是EFS率、OS率的独立危险因素(分别HR=1.605,P=0.017;HR=2.084,P=0.002)。而在CD20阳性患儿中,WBC < 50×109/L和WBC≥50×109/L患儿5年EFS率和5年OS率差异均无统计学意义(P > 0.05),见表 4。
| 表 4 WBC计数对CD20阳性、CD20阴性患儿预后的分析 |
|
|
欧洲成人ALL研究组(Group for Research on Adult Acute Lymphoblastic Leukemia, GRAALL)[5]的报道中,仅在WBC≥30×109/L的患者中发现CD20阳性是EFS的不良影响因素,WBC < 30×109/L的患者中CD20表达与否并不影响患者EFS。日本学者Isshiki等[3]通过对96例16岁以上ALL患者的分析发现,接受成人方案化疗的患者,CD20阳性表达是EFS的独立危险因素(HR=2.60,P=0.020),WBC≥30×109/L且CD20阳性表达的患者可以从儿童方案化疗或造血干细胞移植中获益。Chang等[2]有关成人B-ALL患者的研究中,无论WBC < 30×109/L还是≥30×109/L,CD20阳性表达对患者EFS、OS均无显著影响。国内徐皓等[12]有关成人B-ALL的研究发现,无论初诊WBC < 30×109/L或是≥30×109/L,CD20表达均为患者无进展生存的不良因素。
本研究以儿童ALL危险度分组中常用的WBC 50×109/L为界,发现WBC计数相对低的患儿中,CD20阳性表达为EFS、OS的独立危险因素,而WBC计数相对高的患儿中,CD20阳性表达为OS的独立保护因素。既往有关成人B-ALL的研究认为,含门冬酰胺酶的儿童来源的化疗方案或许可改善CD20阳性患者的预后[2-3, 6]。按照CCLG-ALL2008方案,中危、高危患儿门冬酰胺酶的应用剂量明显大于标危患儿[17]。本研究标危、中危、高危患儿中,CD20阳性者预后较CD20阴性者差(差异无统计学意义),随着危险度的增加(也即门冬酰胺酶使用剂量的增加),并未观察到CD20阳性与CD20阴性患儿的生存率差距缩小。CD20分子作为一种跨膜磷酸蛋白,其在细胞周期、细胞分化和凋亡中发挥重要作用[18]。本研究提示,探讨CD20在B-ALL患者中的预后价值时,需要同时考虑患者的初诊WBC计数,其深层次的机制还有待进一步研究。另外,本研究中WBC≥50×109/L的患儿数量偏少,CD20在该群患儿中预后价值的探讨可能需要更多病例的积累。
GRAALL研究显示,CD20阳性表达患者中,WBC≥30×109/L是预后不良的因素;CD20阴性患者中,WBC≥30×109/L并不影响患者预后[5]。本研究发现,在CD20阴性患儿中,高WBC计数是EFS、OS的独立危险因素;而在CD20阳性患儿中,高WBC计数并不影响EFS、OS。这说明CCLG-ALL2008方案一定程度上克服了高WBC计数对CD20阳性B-ALL患儿不良预后的影响。
既往评价CD20表达对B-ALL患者治疗反应影响的研究中,聂述山等[19]报道CD20阳性表达的B-ALL患儿诱导治疗后完全缓解率高。意大利学者Mannelli等[10]的研究中,以RT-PCR进行MRD监测,在不同时间点评估MRD,发现CD20表达并不影响成人B-ALL患者MRD转阴率。本研究中,CD20表达与否不影响患者诱导缓解治疗后MRD转阴率即第33天MRD转阴率。同时本研究发现,诱导治疗后未实现深度缓解的患者,即第33天MRD阳性的患者,CD20阳性可作为其不良预后的指标。这是国内外相关报道中,首次将初诊CD20表达与早期治疗反应相结合,对患者长期生存进行预测的探讨,为临床更精确的预后分组提供了新的思路。
本研究发现,接受CCLG-ALL2008方案治疗的B-ALL患儿,初诊低WBC计数、CD20阳性表达者长期预后差,而初诊高WBC计数、CD20阳性表达者有较好的生存趋势,这为进一步探讨CD20单抗在B-ALL中的治疗价值提供了理论依据。值得一提的是,CD20作为一种细胞表面标志,其在白血病细胞表面的表达并不稳定,有文献报道泼尼松治疗后白血病细胞表面的CD20分子表达增加[20]。进一步的研究发现这一现象并不是白血病细胞发生了克隆演变,而是白血病细胞对糖皮质激素治疗的一种“反应”(modulation)[21]。因此我们在探讨CD20单抗在B-ALL中的治疗价值时,哪些患者获益最大、何时应用、应用次数和剂量、CD20表达强度的不同是否会影响疗效都需要审慎评估。
| [1] |
衣晓丽, 刘晓明, 刘天峰, 等. CCLG-ALL2008方案治疗303例儿童ALL诱导期感染并发症分析[J]. 中国小儿血液与肿瘤杂志, 2017, 22(6): 286-291. DOI:10.3969/j.issn.1673-5323.2017.06.002 (  0) 0) |
| [2] |
Chang H, Jiang A, Brandwein J. Prognostic relevance of CD20 in adult B-cell precursor acute lymphoblastic leukemia[J]. Haematologica, 2010, 95(6): 1040-1042. DOI:10.3324/haematol.2009.021089 (  0) 0) |
| [3] |
Isshiki Y, Ohwada C, Sakaida E, et al. CD20 positivity and white blood cell count predict treatment outcomes in Philadelphia chromosome-negative acute lymphoblastic leukemia patients ineligible for pediatric-inspired chemotherapy[J]. Jpn J Clin Oncol, 2017, 47(11): 1047-1054. DOI:10.1093/jjco/hyx126 (  0) 0) |
| [4] |
Jeha S, Behm F, Pei D, et al. Prognostic significance of CD20 expression in childhood B-cell precursor acute lymphoblastic leukemia[J]. Blood, 2006, 108(10): 3302-3304. DOI:10.1182/blood-2006-04-016709 (  0) 0) |
| [5] |
Maury S, Huguet F, Leguay T, et al. Adverse prognostic significance of CD20 expression in adults with Philadelphia chromosome-negative B-cell precursor acute lymphoblastic leukemia[J]. Haematologica, 2010, 95(2): 324-328. DOI:10.3324/haematol.2009.010306 (  0) 0) |
| [6] |
Thomas DA, O'Brien S, Jorgensen JL, et al. Prognostic significance of CD20 expression in adults with de novo precursor B-lineage acute lymphoblastic leukemia[J]. Blood, 2009, 113(25): 6330-6337. DOI:10.1182/blood-2008-04-151860 (  0) 0) |
| [7] |
Yang S, Wang J, Zhao T, et al. CD20 expression sub-stratifies standard-risk patients with B cell precursor acute lymphoblastic leukemia[J]. Oncotarget, 2017, 8(62): 105397-105406. DOI:10.18632/oncotarget.22207 (  0) 0) |
| [8] |
Borowitz MJ, Shuster J, Carroll AJ, et al. Prognostic significance of fluorescence intensity of surface marker expression in childhood B-precursor acute lymphoblastic leukemia. A Pediatric Oncology Group study[J]. Blood, 1997, 89(11): 3960-3966. DOI:10.1182/blood.V89.11.3960 (  0) 0) |
| [9] |
Esteban RE, Christianne B, Alvaro A, et al. Prognostic effect of CD20 expression in adult B-cell acute lymphoblastic leukemia[J]. Clin Lymphoma Myeloma Leuk, 2018, 18(5): 361-367. DOI:10.1016/j.clml.2018.02.013 (  0) 0) |
| [10] |
Mannelli F, Gianfaldoni G, Intermesoli T, et al. CD20 expression has no prognostic role in Philadelphia-negative B-precursor acute lymphoblastic leukemia:new insights from the molecular study of minimal residual disease[J]. Haematologica, 2012, 97(4): 568-571. DOI:10.3324/haematol.2011.054064 (  0) 0) |
| [11] |
Solano-Genesta M, Tarín-Arzaga L, Velasco-Ruiz I, et al. CD20 expression in B-cell precursor acute lymphoblastic leukemia is common in Mexican patients and lacks a prognostic value[J]. Hematology, 2012, 17(2): 66-70. DOI:10.1179/102453312X13221316477741 (  0) 0) |
| [12] |
徐皓, 魏旭东, 尹青松, 等. CD20阳性成人急性B淋巴细胞白血病患者临床特点及预后相关分析[J]. 中华血液学杂志, 2015, 36(1): 4-9. (  0) 0) |
| [13] |
周进, 王婧, 刘辉, 等. B系急性淋巴细胞白血病中CD20表达及其对预后影响[J]. 中国实验血液学杂志, 2015, 23(3): 619-622. (  0) 0) |
| [14] |
Kim DY, Park HS, Choi EJ, et al. Immunophenotypic markers in adult acute lymphoblastic leukemia:the prognostic significance of CD20 and TdT expression[J]. Blood Res, 2015, 50(4): 227-234. DOI:10.5045/br.2015.50.4.227 (  0) 0) |
| [15] |
兰洋, 陈晓娟, 邹尧, 等. CCLG-ALL2008方案治疗10岁以上儿童及青少年急性淋巴细胞白血病的疗效分析[J]. 中国当代儿科杂志, 2019, 21(5): 405-410. (  0) 0) |
| [16] |
张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3版. 北京: 科学出版社, 2007: 19-23.
(  0) 0) |
| [17] |
陈波, 宪莹, 苏庸春, 等. CCLG-ALL 08方案治疗儿童急性淋巴细胞白血病毒副作用的临床研究[J]. 中国当代儿科杂志, 2013, 15(9): 737-742. (  0) 0) |
| [18] |
Kawabata KC, Ehata S, Komuro A, et al. TGF-β-induced apoptosis of B-cell lymphoma ramos cells through reduction of MS4A1/CD20[J]. Oncogene, 2013, 32(16): 2096-2106. DOI:10.1038/onc.2012.219 (  0) 0) |
| [19] |
聂述山, 赵文理, 季正华, 等. CD20阳性儿童前B急性淋巴细胞白血病临床特点与预后分析[J]. 中华血液学杂志, 2011, 32(4): 275-277. DOI:10.3760/cma.j.issn.0253-2727.2011.04.016 (  0) 0) |
| [20] |
Dworzak MN, Schumich A, Printz D, et al. CD20 up-regulation in pediatric B-cell precursor acute lymphoblastic leukemia during induction treatment:setting the stage for anti-CD20 directed immunotherapy[J]. Blood, 2008, 112(10): 3982-3988. DOI:10.1182/blood-2008-06-164129 (  0) 0) |
| [21] |
Dworzak MN, Gaipa G, Schumich A, et al. Modulation of antigen expression in B-cell precursor acute lymphoblastic leukemia during induction therapy is partly transient:evidence for a drug-induced regulatory phenomenon. Results of the AIEOP-BFM-ALL-FLOW-MRD-Study Group[J]. Cytometry B Clin Cytom, 2010, 78(3): 147-153. (  0) 0) |
 2020, Vol. 22
2020, Vol. 22


