虽然感染性腹泻是一种可以预防的疾病,但其仍然是全世界儿童死亡的一个主要原因。每年5岁以下儿童中有超过180万人因感染性腹泻而死亡,此类死亡大多发生在发展中国家[1-2]。虽然在发达国家急性腹泻的发病率和病死率在近几十年中已得到一定控制,但急性感染性腹泻仍然是儿童住院的一个重要原因[3]。感染性腹泻可由病毒、细菌、寄生虫等多种病原体引起,临床上针对不同病原体所引起的感染性腹泻治疗方案有较大的差别,因此急需快速有效鉴别感染性腹泻类型的指标以指导用药[4]。在急性相反应期,血液中的许多蛋白质,如C反应蛋白(C-reactive protein, CRP)和降钙素原(procalcitonin, PCT)等均可显著升高,在区分细菌感染和病毒感染方面均表现出比白细胞计数等传统标记物更好的性能[5]。微生物学检查作为金标准其检查往往需要48 h或更长的时间,PCT、CRP检测时间短[6]。虽然PCT相对于CRP而言对细菌感染的鉴别效能更高,但PCT并不是最理想的标记物,因其水平可在无菌性炎症中明显上升,此外PCT的使用因不同年龄范围的变化而变得复杂。可溶性髓样细胞触发受体-1(soluble triggering receptor expressed on myeloid cell 1, STREM-1)为近年新提出的细菌感染标志物,在细菌和真菌存在的情况下,STREM-1在吞噬细胞上的表达上调,触发促炎细胞因子的分泌,从而放大宿主对微生物的反应[7]。PCT及STREM-1均被认为可辅助鉴别细菌性感染疾病,但关于两者联合检测能否提高儿童细菌感染性腹泻的鉴别价值目前尚无定论。本研究旨在探讨PCT联合STREM-1对儿童急性腹泻和病毒性腹泻的鉴别诊断价值,以期为二者的鉴别诊断提供新的思路。
1 资料与方法 1.1 研究对象回顾性纳入2018年2月至2019年5月在我院接受治疗的细菌感染性腹泻患儿73例(细菌组)和病毒感染性腹泻患儿68例(病毒组)作为研究对象。本研究已获我院医学伦理委员会审核通过。
纳入标准:(1)年龄6个月至6岁。(2)符合《诸福棠实用儿科学》中病毒性或细菌性腹泻的诊断标准[8]。细菌感染性腹泻:腹痛、发热,大便有黏液或脓血,粪便镜检可有脓细胞、白细胞或红细胞,血常规检测结果显示白细胞计数 > 10×109/L,粪便培养发现致病菌。病毒感染性腹泻:大便呈黄色水样或蛋花样并有少量黏液,血常规检查结果显示白细胞计数正常,部分淋巴细胞百分比升高,病毒检测显示轮状病毒或腺病毒抗原阳性。(3)检查前14 d内未使用过抗生素。(4)病例资料完整。(5)发病2 d内就诊并进行相关检查。(6)已获患儿家属知情同意。
排除标准:(1)慢性腹泻、营养不良;(2)合并全身感染性疾病;(3)消化道畸形或肿瘤;(4)长期使用糖皮质激素、免疫抑制剂。
1.2 方法(1)人口学及临床资料收集:收集两组患儿性别、年龄、临床症状、体征及入院时血常规检测结果。
(2)粪便检测:入院后收集患儿的粪便标本,置显微镜下对寄生虫卵、黏液、白细胞、潜血、脓细胞、脂肪滴等进行检测。
(3)血清PCT和STREM-1检测:于治疗前抽取患儿外周静脉血5 mL,采用酶联免疫吸附法对血清PCT和STREM-1水平进行检测。PCT检测试剂盒购于上海艾美捷科技有限公司,STREM-1试剂盒购于上海丰寿实业有限公司,PW-960型酶标仪由深圳市汇松科技发展有限公司生产,均由专业人员严格按试剂盒说明进行操作。
1.3 统计学分析采用SPSS 22.0统计学软件进行数据分析。计数资料以例数和百分率(%)表示,组间比较采用χ2检验。计量资料以均数±标准差(
病毒组和细菌组两组患儿年龄、性别、入院体温及呕吐、腹痛、脱水症状发生率的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组患儿人口学及临床症状比较 |
|
|
病毒组和细菌组两组患儿粪便黏液检出率差异无统计学意义(P > 0.05);细菌组患儿粪便红细胞及脓液检出率均高于病毒组,差异有统计学意义(P < 0.05),见表 2。
| 表 2 两组患儿粪便特征的比较[n(%)] |
|
|
细菌组患儿血清PCT和STREM-1水平均显著高于病毒组(P < 0.05),见表 3。
|
表 3 两组患儿血清PCT和STREM-1的比较( |
|
|
ROC分析结果显示:血清PCT、STREM-1对儿童细菌性腹泻与病毒性腹泻鉴别的截断值分别为0.97 ng/mL、15.66 ng/mL;AUC分别为0.792、0.889。二者联合诊断(指血清PCT和STREM-1联合检测,其中1个指标高于截断值即判断为细菌性腹泻)的AUC为0.955,其诊断效能高于单独
PCT或STREM-1(分别Z=3.815、4.277,P=0.002、< 0.001)。见图 1、表 4。
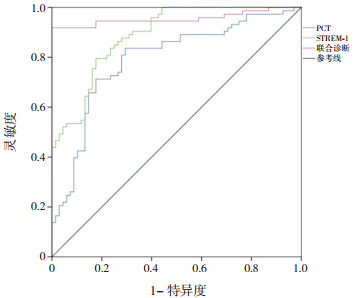
|
图 1 ROC分析图 |
| 表 4 ROC分析结果 |
|
|
感染性腹泻为儿科常见病、多发病,该病主要以大便次数增多、性状改变为临床表现,因感染性腹泻发病急、传播快,严重者可引起电解质紊乱、代谢性酸中毒甚至可致患儿死亡而对儿童健康造成严重的威胁[9-11]。目前已知的可引起感染性腹泻的病原微生物主要有细菌、病毒、原虫及真菌等,国内以细菌及病毒所引起的感染性腹泻较为常见[12]。本研究结果显示:两组患儿年龄、性别、入院体温及呕吐、腹痛、脱水症状发生率比较差异均无统计学意义,提示细菌和病毒感染所引起的儿童感染性腹泻均可有腹痛、呕吐、发热等表现,仅通过临床表现难以鉴别病毒感染与细菌感染所引起的感染性腹泻,而临床上对不同的病原体所引起的感染性腹泻的治疗方案有较大的差别,因而需借助粪便检查及血液相关检查以辅助鉴别[13]。
《中国儿童急性感染性腹泻病临床实践指南》[14]指出,对于疑似细菌感染性腹泻不受限推荐使用抗生素;因大多数病原菌所引起的急性腹泻均具有自限性,而对于病毒感性腹泻目前尚无针对性的抗病毒药物,仅使用补液盐治疗可治愈。国外有研究认为,若出现黏液、脓血便则多可能是因侵袭性细菌感染所引起,对于此类患者,应使用抗菌药物治疗,48 h后病情仍无好转者,可考虑更换抗菌药物[15]。本研究中两组患儿粪便黏液检出率差异无统计学意义,但细菌组患儿粪便红细胞及脓液检出率显著高于病毒组。虽然通过粪便检查可指导经验性用药,但其特异性较差,加上镜检受取样及检测人员经验等多方面因素的影响,有必要寻求客观性更强的量化指标以提高诊断的准确性[16]。CRP为先天防御系统的重要组成部分,其可识别多种细菌表面的磷胆碱并激活经典的补体途径,促进中性粒细胞吞噬。虽然有研究认为CRP可有助于儿童细菌性与病毒性感染的鉴别,但CRP缺乏特异性,在多种无菌性炎症中均可出现CRP水平升高,若采用CRP对细菌性腹泻与病毒性腹泻进行鉴别,多需要与白细胞计数、中性粒细胞比值和蛋白质水平等指标结合,方可有助于临床医生缩小鉴别诊断范围,不利于临床的快速鉴别[17]。PCT在甲状腺C细胞中合成并由外周血白细胞分泌,研究证实在细菌感染中PCT的分泌呈几何级增加,但在非传染性的病毒感染和炎症反应中仍保持正常或略有增加。血清PCT水平在感染后2~3 h内升高,在6~12 h达到峰值,2 d内恢复正常,而CRP则在细菌感染后12~18 h内升高,与CRP相比,PCT在血浆中更为稳定,其血浆半衰期约为22 h,同时PCT与其他大多数细胞因子的区别在于其在体外稳定较高,可为早期敏感地鉴别细菌感染提供可能[18]。但PCT同样可在无菌性感染中升高,而使其对于细菌感染的鉴别效能下降。本研究ROC分析结果显示,PCT对儿童细菌性腹泻与病毒性腹泻鉴别的灵敏度为83.6%,而特异度仅为70.6%,与上述观点[18]相符。因此本研究在PCT基础上选择STREM-1,其为一种跨膜糖蛋白,属于细胞表面受体免疫球蛋白超家族的一员。研究显示,细菌和真菌感染可引起STREM-1在吞噬细胞上的表达上调,触发促炎细胞因子的分泌,从而放大宿主对微生物的反应,细菌感染过程中中性粒细胞和单核/巨噬细胞膜结合STREM-1的表达明显改变,并在6 h达到高峰,因而该指标常被用于细菌感染性疾病的诊断[19]。本研究ROC分析结果显示,STREM-1诊断的灵敏度不及PCT,但特异度明显高于PCT,与既往研究结果一致[20]。该研究[20]分析STREM-1、CRP及PCT对脓毒症的诊断价值,发现STREM-1的特异度高于CRP及PCT,但其灵敏度却不及PCT。本研究结果显示,PCT和STREM-1联合诊断的灵敏度高于STREM-1和PCT单独诊断,因此两种指标联合检测既保留了PCT检测的高敏感性,可在早期敏感地对细菌感染进行鉴别,又可提高诊断的特异性,提高诊断效能。
综上所述,细菌性腹泻患儿血清PCT和STREM-1水平显著高于病毒性腹泻患儿,血清PCT和STREM-1均可作为儿童细菌性腹泻与病毒性腹泻的鉴别指标,二者联合检测可提高鉴别诊断效能。但因本研究为单中心研究,样本量较小,因此,本研究结论有待在大样本、多中心研究中进一步证实。
| [1] |
刘晓玲, 陈青山, 吴泰顺. 2010-2014年深圳市宝安区其他感染性腹泻流行病学特征[J]. 实用预防医学, 2017, 24(1): 120-123. DOI:10.3969/j.issn.1006-3110.2017.01.038 (  0) 0) |
| [2] |
张平, 张静. 我国2014-2015年其他感染性腹泻监测现状分析[J]. 中华流行病学杂志, 2017, 38(4): 424-430. DOI:10.3760/cma.j.issn.0254-6450.2017.04.003 (  0) 0) |
| [3] |
Shane AL, Mody RK, Crump JA, et al. 2017 Infectious Diseases Society of America clinical practice guidelines for the diagnosis and management of infectious diarrhea[J]. Clin Infect Dis, 2017, 65(12): e45-e80. DOI:10.1093/cid/cix669 (  0) 0) |
| [4] |
The HC, Florez de Sessions P, Jie S, et al. Assessing gut microbiota perturbations during the early phase of infectious diarrhea in Vietnamese children[J]. Gut Microbes, 2018, 9(1): 38-54. DOI:10.1080/19490976.2017.1361093 (  0) 0) |
| [5] |
Li A, Tran S, Wang H, et al. Multiplex polymerase chain reaction test to diagnose infectious diarrhea in the emergency department[J]. Am J Emerg Med, 2019, 37(7): 1368-1370. (  0) 0) |
| [6] |
Das R, Ahmed T, Saha H, et al. Clinical risk factors, bacterial aetiology, and outcome of urinary tract infection in children hospitalized with diarrhoea in Bangladesh[J]. Epidemiol Infect, 2017, 145(5): 1018-1024. (  0) 0) |
| [7] |
Riddle MS, DuPont HL, Connor BA. ACG clinical guideline:diagnosis, treatment, and prevention of acute diarrheal infections in adults[J]. Am J Gastroenterol, 2016, 111(5): 602-622. DOI:10.1038/ajg.2016.126 (  0) 0) |
| [8] |
胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7版. 北京: 人民卫生出版社, 2002: 102-104.
(  0) 0) |
| [9] |
Tarr GAM, Chui L, Lee BE, et al. Performance of stool-testing recommendations for acute gastroenteritis when used to identify children with 9 potential bacterial enteropathogens[J]. Clin Infect Dis, 2019, 69(7): 1173-1182. DOI:10.1093/cid/ciy1021 (  0) 0) |
| [10] |
Larcombe S, Hutton ML, Lyras D. Involvement of bacteria other than clostridium difficile in antibiotic-associated diarrhoea[J]. Trends Microbiol, 2016, 24(6): 463-476. (  0) 0) |
| [11] |
Yang S, Li M, Cheng J, et al. Diagnostic determination of Norovirus infection as one of the major causes of infectious diarrhea in HIV patients using a multiplex polymerase chain reaction assay[J]. Int J STD AIDS, 2019, 30(6): 550-556. DOI:10.1177/0956462418824912 (  0) 0) |
| [12] |
Qi XL, Wang HX, Bu SR, et al. Incidence rates and clinical symptoms of Salmonella, Vibrio parahaemolyticus, and Shigella infections in China, 1998-2013[J]. J Infect Dev Ctries, 2016, 10(2): 127-133. DOI:10.3855/jidc.6835 (  0) 0) |
| [13] |
Tickell KD, Brander RL, Atlas HE, et al. Identification and management of Shigella infection in children with diarrhoea:a systematic review and meta-analysis[J]. Lancet Glob Health, 2017, 5(12): e1235-e1248. (  0) 0) |
| [14] |
中华医学会儿科学分会消化学组, 《中华儿科杂志》编辑委员会. 中国儿童急性感染性腹泻病临床实践指南[J]. 中华儿科杂志, 2016, 54(7): 483-488. DOI:10.3760/cma.j.issn.0578-1310.2016.07.002 (  0) 0) |
| [15] |
Misic AM, Miedel EL, Brice AK, et al. Culture-independent profiling of the fecal microbiome to identify microbial species associated with a diarrheal outbreak in immunocompromised mice[J]. Comp Med, 2018, 68(4): 261-268. (  0) 0) |
| [16] |
Gaensbauer JT, Lamb M, Calvimontes DM, et al. Identification of enteropathogens by multiplex PCR among rural and urban guatemalan children with acute diarrhea[J]. Am J Trop Med Hyg, 2019, 101(3): 534-540. DOI:10.4269/ajtmh.18-0962 (  0) 0) |
| [17] |
Pavlinac PB, Denno DM, John-Stewart GC, et al. Failure of syndrome-based diarrhea management guidelines to detect Shigella infections in Kenyan children[J]. J Pediatric Infect Dis Soc, 2016, 5(4): 366-374. (  0) 0) |
| [18] |
Barral-Arca R, Pardo-Seco J, Martinón-Torres F, et al. A 2-transcript host cell signature distinguishes viral from bacterial diarrhea and it is influenced by the severity of symptoms[J]. Sci Rep, 2018, 8: 8043. DOI:10.1038/s41598-018-26239-1 (  0) 0) |
| [19] |
Zaman S, Ahad A, Sarker MS. Isolation and identification of buccal and intestinal bacteria in goats in Chittagong, Bangladesh[J]. Int J Adv Res Biol Sci, 2018, 5(4): 64-71. (  0) 0) |
| [20] |
Maldonado NC, Chiaraviglio J, Bru E, et al. Effect of milk fermented with lactic acid bacteria on diarrheal incidence, growth performance and microbiological and blood profiles of newborn dairy calves[J]. Probiotics Antimicrob Proteins, 2018, 10(4): 668-676. DOI:10.1007/s12602-017-9308-4 (  0) 0) |
 2020, Vol. 22
2020, Vol. 22

