2. 泉州市妇幼保健院·儿童医院新生儿科, 福建泉州 362000
支气管肺发育不良(bronchopulmonary dysplasia, BPD)是影响早产儿近、远期预后甚至可导致死亡的肺部疾病。随着新生儿重症监护技术的进步,早产儿尤其是极低出生体重儿和超低出生体重儿的存活率大大提高。产前类固醇激素、肺表面活性物质及机械通气策略的改进减少了BPD的发生,但在22~28周胎龄婴儿中,BPD的发生率并未下降,仍保持在42%左右[1]。半个多世纪来,早产儿流行病学、临床表现、产前产后处理方式的改变,BPD的发病机制也发生了重大变化。与“原始BPD”的由高气道压力和氧中毒引起的肺损伤不同,今天所见的“新BPD”是肺泡和血管发育改变、产前和产后致病因素损伤及肺修复过程之间复杂相互作用的结果。流行病学和实验证据表明,炎症和感染、过量输液和持续性动脉导管未闭引起的肺水肿、产前未使用糖皮质激素、宫内发育迟缓、高浓度吸氧等均为BPD的危险因素[2]。最近有研究发现,患有BPD的超低出生体重儿生后第1周的热卡、碳水化合物、蛋白质和脂肪摄入量均显著低于非BPD患儿,且低热卡摄入与BPD的严重程度有关[3]。营养在肺发育、肺损伤和修复中起着重要作用[4],但生后营养不足作为BPD发生的危险因素还没有得到很好的阐明。本研究旨在通过Meta分析方法对早期营养摄入和BPD的相关性进行系统分析,为BPD的预测和营养管理提供循证医学依据。
1 资料与方法 1.1 检索策略检索Embase、PubMed、Cochrane Library、中国知网、万方数据库和维普数据库,检索时限为建库至2020年10月27日,检索语种为英文和中文,且将纳入文献的参考文献也一并检索。英文检索词为“bronchopulmonary dysplasia”“nutrition”“energy intake”“caloric intake”;中文检索词为“支气管肺发育不良”“营养”“热卡”“能量”“热量”。结合自由词和各数据库的主题词,运用逻辑符、通配符和范围运算符等编写检索式。
1.2 文献纳入和排除标准纳入标准:(1)研究对象为极低出生体重儿(出生体重 < 1 500 g)或极早产儿(出生胎龄 < 32周);(2)研究类型为观察性研究,包括队列研究、病例对照研究和横断面研究;(3)暴露因素为早期营养摄入,需具有明确的热卡摄入值,包括总营养、肠内营养、肠外营养或三大营养素(蛋白质、脂肪、糖类)的摄入;(4)文献报道的数据为独立研究结果,若检索到2篇以上针对相同时间研究对象和数据来源的相似文献,以最新发表的文献为准。
排除标准:原始数据资料不全或无法进一步获取相关信息,如营养摄入的数据无法提取或转化为平均每日热卡摄入。
1.3 文献筛选和数据提取文献筛选:由2名研究者根据纳入与排除标准独立筛选文献、提取资料并交叉核对,如遇分歧,与第3名研究员进行讨论决定,缺乏的资料尽量与作者联系予以补充。筛选文献时首先阅读标题和摘要,在排除明显不相关文献后进一步阅读全文,以确定最终是否纳入。资料提取的主要内容:(1)纳入研究的基本信息,包括第一作者和发表时间等;(2)研究对象的基线特征和重要结局指标,包括研究时间、研究地点、样本量、热卡摄入(平均每日热卡摄入、每日肠内营养摄入、每日肠外营养摄入)、肠外营养时间、三大营养素每日摄入等(根据《Cochrane干预措施系统评价手册》对计量资料进行转换[5])。
1.4 文献偏倚风险评价采用纽卡斯尔-渥太华量表(NOS)对纳入的文献进行评价[6]。该量表包括研究对象的选择、组间可比性、暴露或结果评价3个栏目,共8个条目,满分9分,大于6分为高质量研究。文献评价过程中若出现分歧,与第3名研究员讨论解决。
1.5 统计学分析采用RevMan 5.3软件进行Meta分析。热卡摄入、肠外营养时间为计量资料,采用加权均数差(WMD)及其95%可信区间(CI)为效应指标。各独立研究的异质性采用χ2检验。若P≥0.1且I2 < 50%,则各研究间异质性较小,采用固定效应模型进行Meta分析。若P < 0.1或I2≥50%,各研究间异质性过大,使用随机效应模型进行Meta分析。P < 0.05为差异有统计学意义。如各研究间有明显的异质性,条件允许下采用亚组分析或敏感性分析等方法进行处理。
2 结果 2.1 文献检索和基本特征共检索到文献1 203篇,去除重复文献226篇。根据文献纳入与排除标准阅读文献标题和摘要去除951篇,阅读全文后最终纳入8篇文献[3, 7-13]。8篇文献中,包括548例BPD患儿,522例非BPD患儿。纳入的研究均为队列研究,除了Wilson等[13]这项研究,各研究对BPD的诊断标准没有差异;BPD组和非BPD组的性别构成差异无统计学意义(P < 0.05)。文献筛选流程见图 1,纳入文献的基本特征见表 1。
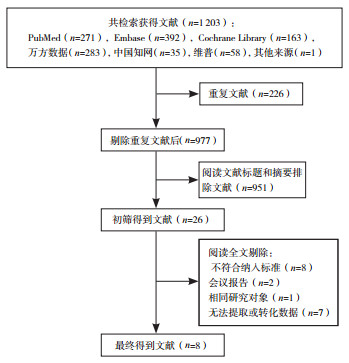
|
图 1 文献筛选流程 |
| 表 1 纳入文献的基本特征 |
|
|
采用NOS量表评价文献质量[6]。所纳入的8项研究均有明确的研究人群和足够、充分的随访,所有研究均控制了最重要的混杂因素;3项研究比较结局评价指标充分。所纳入的8项研究总分均 > 6分,为高质量文献。所纳入研究的质量具体评分见表 2。
| 表 2 纳入研究的NOS评分 |
|
|
(1)生后第1周热卡的摄入:共纳入6篇文献[3, 7-10, 13]进行分析。各研究间异质性较低(I2=33%,P=0.19),采用固定效应模型进行分析,显示BPD组生后第1周热卡摄入显著低于非BPD组(WMD=-8.88,95%CI:-10.89~-6.87,P < 0.01)。根据出生体重进行分层,分为体重 < 1 000 g和 < 1 500 g亚组。其中 < 1 000 g亚组仅1篇文献[3],显示BPD组热卡摄入低于非BPD组(P < 0.01)。< 1 500 g亚组纳入的研究[7-10, 13]间异质性较低(I2=39%,P=0.16),采用固定效应模型进行分析,亦显示BPD组生后第1周热卡摄入显著低于非BPD组(P < 0.01)。见图 2。
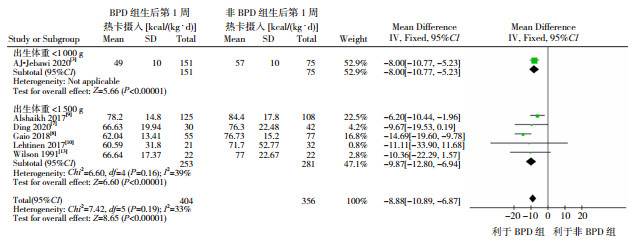
|
图 2 BPD组和非BPD组生后第1周热卡摄入差异的森林图 |
(2)生后前2周热卡的摄入:共纳入4篇文献[7, 11-13]进行分析。纳入的研究间存在同质性(I2=0%,P=0.86),采用固定效应模型进行分析,显示BPD组生后前2周热卡摄入低于非BPD组(P < 0.01),见图 3。
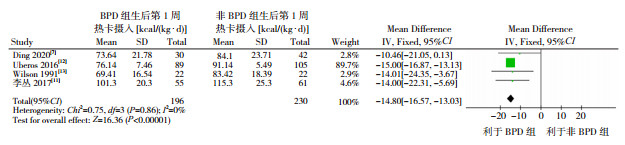
|
图 3 BPD组和非BPD组生后前2周热卡摄入差异的森林图 |
由于各研究效应指标不充分,仅有2篇文献[7, 12]描述了生后前2周的肠内营养和肠外营养摄入。这两项研究间存在较大的异质性,均采用随机效应模型进行分析。分析显示,BPD组的肠内营养摄入显著低于非BPD组(P < 0.01),而肠外营养摄入在两组间比较差异无统计学意义(P=0.20)。见表 3。
| 表 3 BPD和非BPD组生后前2周肠内和肠外营养摄入的比较 |
|
|
共有5篇文献[8-10, 12-13]报道了BPD组和非BPD组肠外营养时间。各研究间异质性较低(I2=31%,P=0.22),采用固定效应模型进行分析,显示BPD组肠外营养时间长于非BPD组(P < 0.01),见图 4。
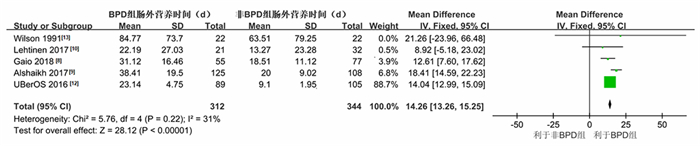
|
图 4 BPD组和非BPD组肠外营养时间差异的森林图 |
2篇文献[3, 12]报道了生后第1周糖类和脂肪的摄入。关于糖类摄入的研究异质性较低,采用固定效应模型进行分析,显示BPD组糖类的摄入显著低于非BPD组(P < 0.01)。而关于脂肪摄入的研究异质性较大,采用随机效应模型分析,显示BPD组脂肪的摄入也低于非BPD组(P=0.01)。3篇文献[3, 8, 12]报道了蛋白质的摄入,各研究间异质性较大,采用随机效应模型,显示两组蛋白质的摄入差异无统计学意义(P=0.10)。其中2篇文献[3, 8]报道的是第1周蛋白质的摄入,而Uberos等[12]的研究报道的是前2周蛋白质的摄入,可能为异质性来源。剔除Uberos等[12]这项研究后,各研究间存在同质性(I2=0%,P=0.81),采用固定效应模型进行分析,显示BPD组蛋白质摄入低于非BPD组(P < 0.01)。见表 4。
| 表 4 生后营养素摄入 |
|
|
虽然围生医学水平不断发展,BPD仍然是极低出生体重儿最常见的一种并发症,是多种因素共同作用引起的慢性肺部疾病,既往相关病因的研究多集中在损伤因素上,如氧中毒、气压伤、炎症反应等,但是近年来发现早产儿尤其是极低出生体重儿生后早期营养摄入不足会影响肺部发育,这可能是BPD发病的一个触发因素[3]。本文运用Meta分析方法探索早期营养摄入和BPD风险的相关性,共纳入8篇高质量文献。Meta分析结果表明,生后第1周、前2周BPD组的热卡摄入显著低于非BPD组,以肠内营养不足为主,三大营养素的摄入在BPD组均存在不足,而肠外营养时间明显长于非BPD组。这些结果提示早期营养摄入不足可能为BPD发生的高危因素。
肺发育包括生化功能、解剖结构发育等诸多方面,主要历经胚胎期、假腺体期、小管期(胎龄16~24周)、囊泡期(胚胎24~35周)和肺泡化期(36周至出生后)[16]。在最后的肺泡化期,囊泡状的肺通过形成肺泡间隔,极大地增加了肺的表面积,该时期可以一直延续到儿童甚至少年时期。因此极低出生体重儿生后早期的营养摄入在促进呼吸系统发育成熟方面扮演着重要角色。早期动物试验和流行病学研究已证实营养会影响肺发育,并对呼吸系统产生重大影响[17]。在大鼠模型中,热量限制可使肺泡数量减少55%,肺泡表面积减少25%[18]。在无创通气支持的早产羊羔中,限制营养后肺泡形成的形态、生理和生化指标均受损,间充质细胞的凋亡和增殖减少[19]。
营养不良使早产儿缺乏对高氧、气压伤和感染的抵抗能力,并影响机体对肺损伤的修复,最终导致BPD的发生。Ehrenkranz等[20]的研究发现,生后早期,特别是生后第1周营养支持和BPD发生率呈负相关,其总能量每增加1 kcal/(kg·d),BPD的发生率下降2%。如果对能量摄入进行累积[21],当第1周累积能量摄入 < 425 kal/kg时,BPD的患病风险显著增加(OR=2.63,95%CI:1.30~5.34)。而Klevebro等[22]的前瞻性研究发现,在生后第7~27天,能量摄入每增加10 kcal/(kg·d),BPD风险降低9%(P=0.029)。
本研究显示BPD组较非BPD组营养摄入不足、肠外营养时间延长。一项针对116名胎龄 < 29周的早产儿前瞻性队列研究显示,肠外营养持续时间每增加1 d,BPD的风险增加1.17倍[23]。因此,根据不同个体的疾病严重程度和生长状况,优化肠内营养支持策略,是BPD患儿临床管理的重点。
目前我国专家共识推荐BPD高危儿早期能量需求应达到每日120~150 kcal/kg;确诊BPD后,由于呼吸需求的增加和慢性肺损伤的发生,能量消耗增高,能量需求比一般早产儿高出15%~25%,达到每日140~150 kcal/kg[24]。Poindexter等[25]建议,极低胎龄早产儿出生后应尽快静脉注射至少2 g/(kg·d)的氨基酸;在48~72 h内,目标氨基酸3.5~4.0 g/(kg·d)。为了满足推荐的能量摄入,应提供静脉注射脂质。没有证据支持逐步增加脂肪摄入量的必要性;建议至少2 g/(kg·d),此后不久增加至3.0~4.0 g/(kg·d)。
本研究存在一定的局限性:(1)纳入的文献来自不同的国家,存在地域和民族差异,时间跨度也大;(2)研究效应指标不充分,部分效应指标并非直观存在,需要经过统计学转换;(3)纳入的文献数量较少,部分指标无法进行亚组分析及敏感性分析。这些不足可能对结果产生影响。
综上所述,早期营养摄入减少(主要是肠内营养摄入不足)、肠外营养时间延长可能是增加BPD风险的高危因素。虽然BPD发病涉及多种病理生理因素,但营养失衡是其中重要的环节之一,积极的营养支持可能是降低BPD风险的一项重要措施,应加强高危BPD患儿的肠内喂养,尽早达到全肠内喂养。
| [1] |
Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network[J]. Pediatrics, 2010, 126(3): 443-456. DOI:10.1542/peds.2009-2959 (  0) 0) |
| [2] |
左敬叶, 王艺睿, 杨宇婷, 等. 早产儿支气管肺发育不良的发病机制研究进展[J]. 国际儿科学杂志, 2019, 46(11): 831-834. DOI:10.3760/cma.j.issn.1673-4408.2019.11.014 (  0) 0) |
| [3] |
Al-Jebawi Y, Agarwal N, Groh Wargo S, et al. Low caloric intake and high fluid intake during the first week of life are associated with the severity of bronchopulmonary dysplasia in extremely low birth weight infants[J]. J Neonatal Perinatal Med, 2020, 13(2): 207-214. DOI:10.3233/NPM-190267 (  0) 0) |
| [4] |
吴怡玲, 芦惠, 张志群. 营养与支气管肺发育不良关系研究进展[J]. 中华新生儿科杂志, 2020, 35(2): 148-152. DOI:10.3760/cma.j.issn.2096-2932.2020.02.019 (  0) 0) |
| [5] |
Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0[EB/OL]. [2020-10-31]. https://training.cochrane.org/handbook/archive/v5.1.
(  0) 0) |
| [6] |
曾宪涛, 刘慧, 陈曦, 等. Meta分析系列之四: 观察性研究的质量评价工具[J]. 中国循证心血管医学杂志, 2012, 4(4): 297-299. DOI:10.3969/j.1674-4055.2012.04.004 (  0) 0) |
| [7] |
Ding L, Wang HW, Geng HF, et al. Prediction of bronchopulmonary dysplasia in preterm infants using postnatal risk factors[J]. Front Pediatr, 2020, 8: 349. DOI:10.3389/fped.2020.00349 (  0) 0) |
| [8] |
Gaio P, Verlato G, Daverio M, et al. Incidence of metabolic bone disease in preterm infants of birth weight < 1250 g and in those suffering from bronchopulmonary dysplasia[J]. Clin Nutr ESPEN, 2018, 23: 234-239. DOI:10.1016/j.clnesp.2017.09.008 (  0) 0) |
| [9] |
Alshaikh B, Buddhavarapu S, Akierman A, et al. Impact of calorie intakes on the risk of bronchopulmonary dysplasia in extremely preterm infants[J]. Arch Pulmonol Respir Care, 2017, 3(1): 20-24. DOI:10.17352/aprc.000019 (  0) 0) |
| [10] |
Lehtinen A, Korhonen P, Hyödynmaa E, et al. Adipokines played a limited role in predicting temporary growth differences between very low birthweight infants with and without bronchopulmonary dysplasia[J]. Acta Paediatr, 2017, 106(10): 1583-1588. DOI:10.1111/apa.13942 (  0) 0) |
| [11] |
李丛, 申青华, 梁莹莹, 等. 新生儿重症监护病房极低出生体重儿支气管肺发育不良危险因素分析[J]. 中华新生儿科杂志, 2017, 32(1): 48-50. (  0) 0) |
| [12] |
Uberos J, Lardón-Fernández M, Machado-Casas I, et al. Nutrition in extremely low birth weight infants: impact on bronchopulmonary dysplasia[J]. Minerva Pediatr, 2016, 68(6): 419-426. (  0) 0) |
| [13] |
Wilson DC, McClure G, Halliday HL, et al. Nutrition and bronchopulmonary dysplasia[J]. Arch Dis Child, 1991, 66(1 Spec No): 37-38. DOI:10.1136/adc.66.1_Spec_No.37 (  0) 0) |
| [14] |
Jobe AH, Bancalari E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. DOI:10.1164/ajrccm.163.7.2011060 (  0) 0) |
| [15] |
Bancalari E, Abdenour GE, Feller R, et al. Bronchopulmonary dysplasia: clinical presentation[J]. J Pediatr, 1979, 95(5 Pt 2): 819-823. (  0) 0) |
| [16] |
常立文, 李文斌. 胎儿和新生儿肺发育[J]. 实用儿科临床杂志, 2011, 26(14): 1065-1067. DOI:10.3969/j.issn.1003-515X.2011.14.001 (  0) 0) |
| [17] |
Lelijveld N, Kerac M, Seal A, et al. Long-term effects of severe acute malnutrition on lung function in Malawian children: a cohort study[J]. Eur Respir J, 2017, 49(4): 1601301. DOI:10.1183/13993003.01301-2016 (  0) 0) |
| [18] |
Massaro GD, Radaeva S, Clerch LB, et al. Lung alveoli: endogenous programmed destruction and regeneration[J]. Am J Physiol Lung Cell Mol Physiol, 2002, 283(2): L305-L309. DOI:10.1152/ajplung.00035.2002 (  0) 0) |
| [19] |
Joss-Moore LA, Hagen-Lillevik SJ, Yost C, et al. Alveolar formation is dysregulated by restricted nutrition but not excess sedation in preterm lambs managed by noninvasive support[J]. Pediatr Res, 2016, 80(5): 719-728. DOI:10.1038/pr.2016.143 (  0) 0) |
| [20] |
Ehrenkranz RA, Das A, Wrage LA, et al. Early nutrition mediates the influence of severity of illness on extremely LBW infants[J]. Pediatr Res, 2011, 69(6): 522-529. DOI:10.1203/PDR.0b013e318217f4f1 (  0) 0) |
| [21] |
Uberos J, Jimenez-Montilla S, Molina-Oya M, et al. Early energy restriction in premature infants and bronchopulmonary dysplasia: a cohort study[J]. Br J Nutr, 2020, 123(9): 1024-1031. DOI:10.1017/S0007114520000240 (  0) 0) |
| [22] |
Klevebro S, Westin V, Stoltz Sjöström E, et al. Early energy and protein intakes and associations with growth, BPD, and ROP in extremely preterm infants[J]. Clin Nutr, 2019, 38(3): 1289-1295. DOI:10.1016/j.clnu.2018.05.012 (  0) 0) |
| [23] |
Mohamed I, Elremaly W, Rouleau T, et al. Oxygen and parenteral nutrition two main oxidants for extremely preterm infants: 'it all adds up'[J]. J Neonatal Perinatal Med, 2015, 8(3): 189-197. DOI:10.3233/NPM-15814091 (  0) 0) |
| [24] |
张蓉, 林新祝, 常艳美, 等. 早产儿支气管肺发育不良营养管理专家共识[J]. 中国当代儿科杂志, 2020, 22(8): 805-814. (  0) 0) |
| [25] |
Poindexter BB, Camilia RM. Impact of nutrition on bronchopulmonary dysplasia[J]. Clin Perinatol, 2015, 42(4): 797-806. DOI:10.1016/j.clp.2015.08.007 (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


