肺炎支原体(Mycoplasma pneumoniae, MP)是导致儿童呼吸道感染最常见的病原体之一,常见的易感人群为4岁以上的儿童,但近年来报道婴幼儿肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)发病率有增高趋势[1]。由于大环内酯类药物的广泛应用,MP耐药率居高不下,尤其以亚洲地区明显[2]。难治性肺炎支原体肺炎(refractory Mycoplasma pneumoniae pneumonia, RMPP)可继发坏死性肺炎、闭塞性细支气管炎、自发性气胸、肺纤维化等,预后差[3-4]。目前临床上尚无可靠的分子标记可预测RMPP的发生。几丁质酶样蛋白YKL-40是近年来婴幼儿气道高反应性疾病相关研究较多的细胞因子,其属于18家族糖类水解酶之一,可结合真菌细胞壁的几丁质,但无法将其水解[5-7]。本课题组前期研究发现支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中YKL-40水平与MPP患儿气道损害相关[8]。本研究将探讨BALF中YKL-40在普通型MPP和RMPP患儿中表达的差异及其对RMPP的预测价值。
1 资料与方法 1.1 研究对象纳入标准:2019年1~12月我院诊治的符合MPP诊断标准的患儿,即临床及影像学上有肺炎表现,结合病原学检查提示MP感染,具体为血清MP-IgM滴度≥1 : 160,或急性感染,双份血清(间隔2周)恢复期抗体滴度上升4倍或下降至原来的1/4,或BALF MP-DNA阳性[9]。RMPP的诊断标准[10]:大环内酯类抗生素治疗7 d以上,以发热持续不退和肺部影像学表现仍无好转且排除其他病原体所致。共收集72例患儿,其中50例普通型MPP,22例RMPP。
排除标准:(1)排除其他病原体,如细菌、真菌、病毒、衣原体、寄生虫等感染所致肺炎;(2)排除有支气管肺发育不良、肺纤维化、免疫性疾病、先天性心脏病、长期使用激素或免疫抑制剂的患儿。
1.2 资料收集收集患儿的一般资料(性别、年龄)、临床表现(发热、喘息、气促)、实验室检查结果[血常规、C-反应蛋白(C-reactive protein, CRP)、乳酸脱氢酶(lactate dehydrogenase, LDH)等],以及肺部影像学检查结果等。
1.3 BALF标本采集参照本课题组前期研究方法进行BALF标本采集[8]:患儿人院后3 d内完善胸部影像学及纤维支气管镜检查并进行支气管肺泡灌洗。两组均选取右肺中叶或左肺舌叶或病变严重部位作为灌洗部位以获取BALF。将BALF进行离心后加入抑肽酶储存于-80℃的冰箱备用。
1.4 BALF中YKL-40含量的检测BALF解冻后摇匀,具体操作严格按照YKL-40 ELISA试剂盒说明书(Human Chitinase 3-like 1 Quantikine ELISA Kit, R & D公司)进行检测。
1.5 统计学分析应用SPSS 22.0统计软件进行数据分析。不符合正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验;计数资料以例数和百分率(%)表示,两组比较采用χ2检验。应用受试者工作特征(receiver operating characteristic, ROC)曲线法评估YKL-40、CRP及LDH对RMPP的预测价值。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况50例普通型MPP和22例RMPP患儿均治愈出院。RMPP组和普通型MPP组性别构成及年龄的比较差异无统计学意义(P > 0.05)。RMPP组发热和气促发生率明显高于普通型MPP组,差异有统计学意义(P < 0.05);喘息发生率在两组中的差异无统计学意义(P > 0.05)。RMPP组血清CRP和LDH水平明显高于普通型MPP组,差异有统计学意义(P < 0.05),而两组白细胞计数的差异无统计学意义(P > 0.05)。见表 1。
| 表 1 两组患儿临床指标的比较 |
|
|
RMPP组肺实变和胸腔积液发生率明显高于普通型MPP组,差异有统计学意义(P < 0.05),而两组磨玻璃样变发生率的比较差异无统计学意义(P > 0.05),见表 1。
2.3 BALF中YKL-40的表达RMPP组BALF中YKL-40水平明显高于普通型MPP组,差异有统计学意义(P < 0.05),见表 1。
2.4 ROC曲线分析为探讨YKL-40、CRP及LDH预测RMPP的价值,应用SPSS 22.0软件绘制ROC曲线,根据约登指数确定具有预测RMPP最大灵敏度和特异度的临界值。ROC曲线分析显示,YKL-40预测RMPP的曲线下面积为0.750(95%CI:0.631~0.869),YKL-40在6 013.33 pg/mL时,其预测RMPP的灵敏度为72.7%,特异度为64.0%。CRP预测RMPP的曲线下面积为0.489,没有预测价值。LDH预测RMPP的曲线下面积为0.659(95%CI:0.529~0.788),其在364.5 U/L时,预测RMPP的灵敏度为68.2%,特异度为62.0%。见图 1。
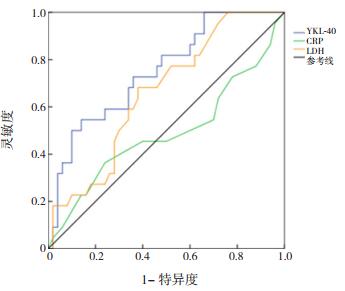
|
图 1 YKL-40、CRP及LDH预测难治性肺炎支原体肺炎的ROC曲线 |
RMPP发病机制目前认为与过度的细胞免疫及其过高促炎细胞因子相关[11]。在本研究中,RMPP组患儿无论是发热、气促等临床表现的发生率,还是肺实变及胸腔积液的发生率均明显高于普通型MPP组;而RMPP组患儿的炎症反应指标CRP及细胞坏死指标LDH水平均明显高于MPP组。这与既往临床观察性研究结果相一致[12-13],提示RMPP患儿肺部损伤严重,需早期识别。已有许多研究致力于发现可早期预测RMPP的生物标记物,如有文献报道LDH可作为RMPP的肺部组织炎症损伤标志,并可依据其水平高低来决定是否使用激素治疗[14-15]。本研究亦发现RMPP组的LDH水平较普通型MPP组高,且对RMPP有一定的预测价值。但亦有研究指出,CRP和LDH预测RMPP的曲线下面积均小于0.5,而CD3+、CD4+、CD19+绝对计数对RMPP的预测价值较高[16]。近年来关于辅助性T细胞(helper T cell, Th)1、Th17及M1巨噬细胞相关促炎细胞因子等的研究逐渐增多,如白细胞介素(interleukin, IL)-6、IL-17、IL-18、CXCL10等,但迄今为止尚无明确定论[17-18]。YKL-40是调节适应性Th2免疫反应重要的细胞因子。有研究发现YKL-40是IL-18通路在组织炎症、气道纤维化、肺泡重塑和细胞毒性反应中重要的炎症介质。IL-18可通过干扰素-γ、IL-13和IL-17A诱导YKL-40分泌,而YKL-40可以抑制肺部细胞毒性炎症介质、抑制肺泡损伤和肺气肿的形成,减轻炎症反应和气道纤维化重塑,血清或BALF中YKL-40水平可预测疾病进展[19]。在关于支气管哮喘的气道损伤研究中亦发现YKL-40与气道重塑密切相关,可作为支气管哮喘的诊断和疾病严重程度评估的分子标记[7]。本课题组前期的研究发现YKL-40水平在MPP患儿气道损害严重时升高,与病情严重程度呈正相关[8]。在本研究中,RMPP患儿BALF中的YKL-40表达水平高于MPP患儿,提示YKL-40可能与RMPP严重气道损害相关。ROC曲线分析结果显示,YKL-40对RMPP具有一定的预测价值。但本研究有一定局限性:第一,本研究未对疾病转归过程中的YKL-40水平进行动态监测。第二,本研究中入组病例所处的病程不一致,由此获取的BALF的YKL-40的水平可能存在差异,需在未来的研究中按疾病进程进一步分亚组进行分析。第三,本研究中RMPP病例数较少,YKL-40预测RMPP的曲线下面积、灵敏度及特异度略低,故需在未来研究中扩大样本量进一步证实其临床价值。
综上所述,本研究显示,相对于普通型MPP患儿,RMPP患儿肺部损伤更严重,BALF中YKL-40表达水平更高;YKL-40作为重要的细胞因子,对RMPP具有一定的预测价值。
| [1] |
Xing Y, Wang D, Sheng K, et al. Dynamic change of Mycoplasma pneumoniae pneumonia in hospitalized children in a general hospital: a 3-year retrospective analysis[J]. Transl Pediatr, 2020, 9(4): 522-531. DOI:10.21037/tp-20-149 (  0) 0) |
| [2] |
Lee H, Yun KW, Lee HJ, et al. Antimicrobial therapy of macrolide-resistant Mycoplasma pneumoniae pneumonia in children[J]. Expert Rev Anti Infect Ther, 2018, 16(1): 23-34. DOI:10.1080/14787210.2018.1414599 (  0) 0) |
| [3] |
Lee E, Young Lee Y. Risk factors for the development of postinfectious bronchiolitis obliterans after Mycoplasma pneumoniae pneumonia in the era of increasing macrolide resistance[J]. Respir Med, 2020, 175: 106209. DOI:10.1016/j.rmed.2020.106209 (  0) 0) |
| [4] |
Zheng BY, Zhao J, Cao L. The clinical characteristics and risk factors for necrotizing pneumonia caused by Mycoplasma pneumoniae in children[J]. BMC Infect Dis, 2020, 20(1): 391. DOI:10.1186/s12879-020-05110-7 (  0) 0) |
| [5] |
James A, Stenberg Hammar K, Reinius L, et al. A longitudinal assessment of circulating YKL-40 levels in preschool children with wheeze[J]. Pediatr Allergy Immunol, 2017, 28(1): 79-85. DOI:10.1111/pai.12669 (  0) 0) |
| [6] |
Lai TW, Wu D, Chen M, et al. YKL-40 expression in chronic obstructive pulmonary disease: relation to acute exacerbations and airway remodeling[J]. Respir Res, 2016, 17: 31. DOI:10.1186/s12931-016-0338-3 (  0) 0) |
| [7] |
Yildiz H, Alp HH, Sünnetçioğlu A, et al. Evaluation serum levels of YKL-40, periostin, and some inflammatory cytokines together with IL-37, a new anti-inflammatory cytokine, in patients with stable and exacerbated asthma[J]. Heart Lung, 2021, 50(1): 177-183. DOI:10.1016/j.hrtlng.2020.04.017 (  0) 0) |
| [8] |
黄丽林, 李容汉, 黎静, 等. 支气管肺泡灌洗液YKL-40与肺炎支原体肺炎患儿气道损害的相关性[J]. 中国当代儿科杂志, 2019, 21(12): 1188-1192. DOI:10.7499/j.issn.1008-8830.2019.12.007 (  0) 0) |
| [9] |
中华人民共和国国家健康委员会, 国家中医药局. 儿童社区获得性肺炎诊疗规范(2019年版)[J]. 中华临床感染病杂志, 2019, 12(1): 6-13. DOI:10.3760/cma.j.issn.1674-2397.2019.01.002 (  0) 0) |
| [10] |
华军. 儿童难治性肺炎支原体肺炎发生塑型性支气管炎的危险因素分析[J]. 中华实用儿科临床杂志, 2019, 34(16): 1219-1222. DOI:10.3760/cma.j.issn.2095-428X.2019.16.006 (  0) 0) |
| [11] |
Tanaka H. Correlation between radiological and pathological findings in patients with Mycoplasma pneumoniae pneumonia[J]. Front Microbiol, 2016, 7: 695. (  0) 0) |
| [12] |
Cheng SY, Lin JL, Zheng XX, et al. Development and validation of a simple-to-use nomogram for predicting refractory Mycoplasma pneumoniae pneumonia in children[J]. Pediatr Pulmonol, 2020, 55(4): 968-974. DOI:10.1002/ppul.24684 (  0) 0) |
| [13] |
Zhang YY, Zhou YL, Li SX, et al. The clinical characteristics and predictors of refractory Mycoplasma pneumoniae pneumonia in children[J]. PLoS One, 2016, 11(5): e0156465. DOI:10.1371/journal.pone.0156465 (  0) 0) |
| [14] |
Liu TY, Lee WJ, Tsai CM, et al. Serum lactate dehydrogenase isoenzymes 4 plus 5 is a better biomarker than total lactate dehydrogenase for refractory Mycoplasma pneumoniae pneumonia in children[J]. Pediatr Neonatol, 2018, 59(5): 501-506. DOI:10.1016/j.pedneo.2017.12.008 (  0) 0) |
| [15] |
Kusubae R, Nomura Y, Hirabayashi M, et al. β2 microglobulin and lactate dehydrogenase are indices of different features of Mycoplasma pneumoniae-associated community-acquired lower respiratory tract infection for severity evaluation in children[J]. J Infect Chemother, 2019, 25(12): 1007-1011. DOI:10.1016/j.jiac.2019.05.029 (  0) 0) |
| [16] |
李娜, 穆亚平, 陈静, 等. 淋巴细胞亚群绝对计数对儿童难治性肺炎支原体肺炎的早期预测作用[J]. 中国当代儿科杂志, 2019, 21(6): 511-516. (  0) 0) |
| [17] |
Lee YC, Chang CH, Lee WJ, et al. Altered chemokine profile in refractory Mycoplasma pneumoniae pneumonia infected children[J]. J Microbiol Immunol Infect, 2020. DOI:10.1016/j.jmii.2020.03.030.Epubaheadofprint (  0) 0) |
| [18] |
Choi YJ, Jeon JH, Oh JW. Critical combination of initial markers for predicting refractory Mycoplasma pneumoniae pneumonia in children: a case control study[J]. Respir Res, 2019, 20(1): 193. DOI:10.1186/s12931-019-1152-5 (  0) 0) |
| [19] |
Kang MJ, Yoon CM, Nam M, et al. Role of chitinase 3-like-1 in interleukin-18-induced pulmonary type 1, type 2, and type 17 inflammation; alveolar destruction; and airway fibrosis in the murine lung[J]. Am J Respir Cell Mol Biol, 2015, 53(6): 863-871. DOI:10.1165/rcmb.2014-0366OC (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


