新生儿高胆红素血症是一种常见的疾病[1]。早期诊断和干预对防止可能引起的严重并发症如胆红素脑病等具有重要的临床意义[2]。据估计,肠道菌群包含大约15 000~36 000个菌种[3],参与了多种不同的肠道相关生理功能调控,这些细菌在维护肠壁的运动及其灌注和通透性、保持微生态屏障、调节免疫反应等方面有显著的效果[4-5]。肠道微生态是一个代谢系统,可以作为潜在药物治疗靶点,在人体各种生理过程中起重要作用,是人体的有机组成部分[6]。既往研究表明[7],人类胃肠道内超过400种细菌随着环境及个体性差异表现出极大不同,共同作用调节人类胃肠道系统,进而调控多种生物体酶催化反应。早期新生儿阶段的肠道富含氧气,最先定植的是需氧菌和兼性厌氧菌,随着时间的推移,婴儿肠道内菌群种类由需氧菌和兼性厌氧菌向厌氧菌转变。肠道菌群经历了从无到有、从简单到复杂、从不稳定到稳定的过程。高胆红素血症的发病机制中肠道内β-葡萄糖醛酸苷酶(β-glucuronidase,β-GD)的活性是一个重要因素,β-GD参与胆红素肠肝循环,在肠道内可将结合胆红素水解脱下葡萄糖醛酸转变成未结合胆红素,由肠黏膜吸收,重新回到肝脏[8]。新生儿早期阶段,由于胃肠道微生物群的延迟定居和非结合胆红素在肠道内累计经历了持续的肠肝循环和肠内循环,胆红素诱导的微生物群在早期新生儿阶段是缺少的,肠道微生物对于新生儿胆红素的代谢具有非常大的影响[9]。有学者提出,应该针对这个“窗口期”干预婴儿的肠道微生态以使其更好地适应未来环境[10]。16S rRNA基因很早就应用在微生物菌种鉴定的工作当中,目前已经有效地应用于肠道微生物领域[11]。目前尚未有探讨高胆红素血症新生儿胆红素水平、肠道菌群和β-GD活性相关性的研究。
本研究通过16S rRNA高通量测序方法系统分析高胆红素血症新生儿肠道菌群分布特点,采用酚酞-葡萄糖醛酸底物法,用紫外分光光度计测定置换出的酚酞浓度来代表β-GD活性,比较高胆红素血症新生儿治疗前后肠道内β-GD活性,探讨肠道菌群差异分布对β-GD活性的影响及其与高未结合胆红素血症发生的相关性。
1 资料与方法 1.1 研究对象选取2018年1~12月入住江苏大学附属医院新生儿科的高胆红素血症新生儿作为研究对象进行前瞻性研究。本研究已通过江苏大学附属医院伦理审查(审查号:SWYXLL20200429-4),并签署家属知情同意书。
参考《新生儿高胆红素血症诊断和治疗专家共识》中光疗指征确定纳入标准[12]:(1)新生儿母亲为初产妇,年龄20~35岁,无妊娠高血压综合征、肾病、贫血及糖尿病等妊娠合并症;(2)胎儿经阴道分娩,出生时无产伤窒息,Apgar评分正常,出生体重2 500~4 000 g,胎龄37~42周,生后半小时开奶,纯母乳喂养;(3)生后3~5 d皮肤出现黄染,血清总胆红素超过Bhutani曲线第95百分位数,以非结合胆红素增高为主。出生时或生后伴有呼吸窘迫、头颅血肿、颅内出血、溶血、咽下综合征、感染性疾病等新生儿疾病者予以排除。最终有50例新生儿纳入高胆红素血症组。选择同期我院产科母婴同室新生儿作为对照组。纳入标准:胎龄37~42周,日龄5~7 d,血清总胆红素不超过Bhutani曲线第95百分位数。排除标准:出生时或生后伴有呼吸窘迫、头颅血肿、颅内出血、溶血、咽下综合征及感染性疾病等新生儿疾病。对照组最终纳入了30例新生儿。
1.2 标本采集、保存和处理高胆红素血症组新生儿入院后给予光疗,采集其入组第1天(治疗前)及入组第3天(治疗后)粪便标本,-80℃保存备用,用于肠道菌群分析和β-GD活性测定;同时在各时间点抽取静脉血3 mL用于测定肝功能和β-GD活性。采集对照组入组第1天及入组第3天的粪便标本,-80℃保存备用,用于肠道菌群分析;同时抽取静脉血3 mL用于测定肝功能。
1.3 肠道菌群检测(1)16S rRNA高通量测序:提取所有纳入研究新生儿粪便标本基因组DNA(genomic DNA,gDNA),通过Onedrop仪器和2%琼脂糖凝胶电泳对DNA浓度和纯度进行检测;合格后进行PCR扩增,采用琼脂糖凝胶电泳检测PCR产物的浓度和质量,MD酶标仪检测产物浓度,QIAquick PCR Purification Kit回收产物,Aglient 2200 Bioanalyzer进行质控;合格后予Illumina MiSeq高通量测序仪测序。
(2)生物信息学分析:首先对原始数据进行拼滤,得到有效数据。然后基于有效数据进行Operational Taxonomic Units(OTUs)聚类和物种分类分析,并将OTUs和物种注释结合,从而得到每个样品的OTUs和分类谱系的基本分析结果。再对OTUs进行丰度分析。菌群属水平相对丰度=该菌的基因拷贝数/总拷贝数。
1.4 β-GD活性的测定酶活性单位为在实验规定条件下,每分钟催化1 μmol底物所需的酶量。β-GD活性通常用每分钟稀释出的酚酞量来表示,即U/L。取标本瓶中标本0.1 mL加磷酸盐缓冲液0.8 mL,分别置于正常对照管、高胆红素血症治疗前管和高胆红素血症治疗后管中。高胆红素血症治疗前管和高胆红素血症治疗后管中加基质液0.1 mL;混匀后置37℃水浴18 h,取出后用流水冷却5 min,在正常对照管加入基质液0.1 mL;三管中分别加入甘氨酸-氢氧化钠缓冲液3 mL及75%乙醇1 mL;以正常对照管进行调零,波长为550 nm,用723分光光度计读取测定管光密度,查标准曲线即得0.1 mL标本中β-GD浓度,再将此值换算成每升标本中该酶的浓度。
1.5 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析。非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,两独立样本组间比较采用Mann-Whitney U检验,治疗前后样本的比较采用Wilcoxon符号秩检验。组间所有样本菌群差异比较采用主成分分析(principal component analysis,PCA)。正态分布的计量资料用均数±标准差(x±s)表示,两独立样本的比较采用成组t检验,治疗前后的比较采用配对t检验。计数资料用例数或百分率(%)表示,组间比较采用卡方检验。应用Spearman相关分析法评估粪便β-GD活性与相关菌群之间的关系。P < 0.05为差异有统计学意义。
2 结果 2.1 两组一般资料的比较高胆红素血症组50例新生儿中,男22例,女28例;胎龄(39.2±2.6)周,日龄(4.3±0.2)d,出生体重(3.3±0.5)kg。对照组30例新生儿中,男16例,女14例;胎龄(39.1±2.0)周,日龄(4.2±0.7)d,出生体重(3.2±0.3)kg。两组性别(=0.028,P=0.87)、胎龄(t=0.76,P=0.45)、日龄(t=1.09,P=0.28)和出生体重(t=1.47,P=0.16)的比较差异均无统计学意义。
2.2 新生儿肠道菌群PCA分析基于所有菌属,对高胆红素血症组和对照组肠道菌群进行PCA分析,显示入组第1天高胆红素血症组和对照组肠道菌群构成存在差异(P < 0.05);入组第3天高胆红素血症组和对照组肠道菌群构成也存在差异(P < 0.05);高胆红素血症组入组第1天和入组第3天(治疗前后)肠道菌群构成的差异也有统计学意义(P < 0.05)。见图 1。
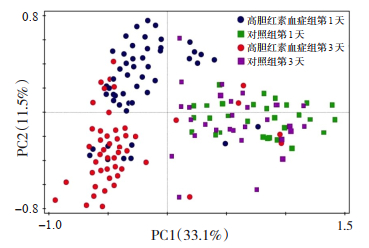
|
图 1 高胆红素血症组和对照组肠道菌群的PCA分析 图中每个点代表一个样本,点间距离越小,肠道菌群越相似,点间距离越大,肠道菌群构成差异越明显。PC1表示第一主成分,33.1%表示第一主成分对样品差异的贡献值;PC2表示第二主成分,11.5%表示第二主成分对样品差异的贡献值 |
选取入组第1天高胆红素血症组肠道菌群属水平相对丰度前96%的菌属,与对照组进行肠道菌属之间的比较,结果显示,两组间共检出52种差异具有统计学意义的细菌,其中肠球菌属、埃希氏菌属、未分类的肠杆菌属等细菌在高胆红素血症组肠道内的丰度明显高于对照组(P < 0.05);拟杆菌属、普雷沃氏菌属、未分类的毛螺旋菌属等细菌在对照组肠道内的丰度明显高于高胆红素血症组(P < 0.05)。两组差异较明显的前20位细菌的肠道菌群属水平的比较见表 1和图 2。
| 表 1 入组第1天高胆红素血症组和对照组肠道菌群属水平相对丰度的比较[M(P25,P75)] |
|
|
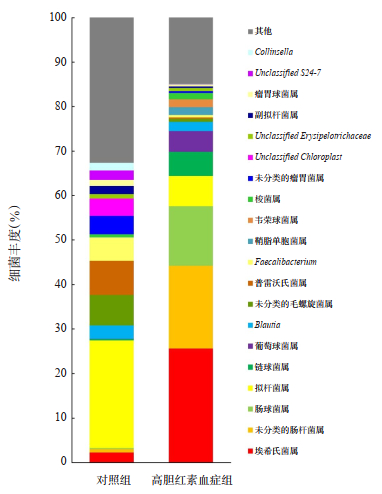
|
图 2 入组第1天高胆红素血症组和对照组肠道菌群分析 |
选取入组后第3天高胆红素血症组属水平丰度前96%的菌属,与对照组进行肠道菌属的比较,结果显示,两组间共检出42种差异具有统计学意义的细菌,其中肠球菌属、未分类的肠杆菌属、链球菌属等细菌在高胆红素血症组肠道内的丰度明显高于对照组(P < 0.05),而拟杆菌属、未分类的毛螺旋菌属、Faecalibacterium等细菌在高胆红素血症组的含量明显低于对照组(P < 0.05)。两组差异较明显的前20位细菌的肠道菌群属水平的比较见表 2和图 3。
| 表 2 入组第3天高胆红素血症组和对照组肠道菌群属水平相对丰度的比较[M(P25,P75)] |
|
|
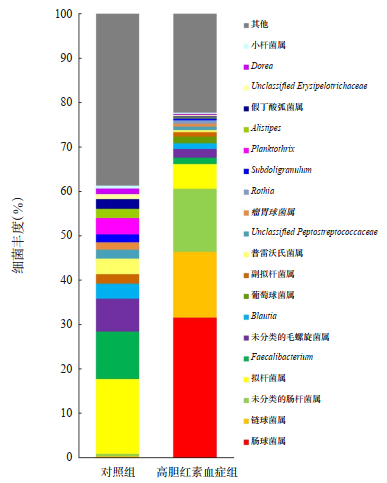
|
图 3 入组第3天高胆红素血症组和对照组肠道菌群分析 |
高胆红素血症新生儿治疗前(入组第1天)和治疗后(入组第3天)肠道菌群分析显示,共检出2种差异具有统计学意义的细菌,即埃希氏菌属和葡萄球菌属在高胆红素血症组治疗后肠道内含量明显低于治疗前(P < 0.05),见表 3。
| 表 3 高胆红素血症新生儿治疗前后肠道菌群属水平相对丰度的比较[M(P25,P75)] |
|
|
高胆红素血症组新生儿治疗后粪便中β-GD活性较治疗前明显降低,差异有统计学意义(P < 0.05),而治疗前后血清β-GD活性差异无统计学意义(P > 0.05),见表 4。
| 表 4 高胆红素血症新生儿治疗前后β-GD活性的变化(x±s,U/L) |
|
|
高胆红素血症新生儿治疗前粪便β-GD活性与葡萄球菌属和埃希氏菌属丰度呈显著正相关(分别rs=0.6385、0.5948,均P < 0.01);治疗后粪便β-GD活性与葡萄球菌属和埃希氏菌属丰度亦呈显著正相关(分别rs=0.7245、0.6087,P < 0.01)。
3 讨论本研究发现高胆红素血症组和对照组肠道菌群构成存在明显差异,其中肠球菌属、埃希氏菌属、未分类的肠杆菌属等细菌在高胆红素血症组肠道内含量明显高于对照组;拟杆菌属、普雷沃氏菌属、未分类的毛螺旋菌属等细菌在对照组肠道内含量明显高于高胆红素血症组。高胆红素血症组治疗后肠球菌属、未分类的肠杆菌属、链球菌属等细菌的含量明显高于对照组;拟杆菌属、未分类的毛螺旋菌属、Faecalibacterium等细菌则明显低于对照组;高胆红素血症组治疗后肠道内埃希氏菌属、葡萄球菌属含量明显低于治疗前。Vítek等[13]发现大鼠口服抗生素后血清胆红素水平显著升高。此外,Tuzun等[14]和Thongaram等[15]指出,双歧杆菌属成员,如两歧双歧杆菌和长齿杆菌的下调与血清胆红素水平升高有关,这些研究结果提供了肠道微生物群可能参与胆红素代谢的证据。
近年来,新生儿高胆红素血症的发病率呈逐年上升趋势,高胆红素血症占新生儿住院病因的首位[16]。若诊断和治疗不及时,过高的血清胆红素可以引起患儿全身多器官功能损害,胆红素还可通过血脑屏障干扰神经细胞的正常代谢[17],造成神经系统功能的紊乱,出现致残甚至致死的情况[18]。肠道菌群在胆红素的代谢过程中起到了至关重要的作用。此外,肠道菌群又能参与机体代谢,完成数种宿主细胞不能催化进行的酶反应,肠道菌群及其代谢产物影响宿主的代谢稳态[19],机体代谢功能的障碍与肠道菌群的变化密切相关。另外,肠道菌群还可通过改变肝功能调节胆红素的代谢,完善免疫系统,提高肝酶活性,促进胆红素的结合和排泄。肠道的微生物及其代谢产物对于维持血清胆红素水平有很大的作用[20-21],肠道微生物对于新生儿胆红素代谢有影响,加强肠道代谢则可能降低血清胆红素水平[22]。
本研究还发现高胆红素血症组新生儿治疗前后粪便β-GD活性与葡萄球菌属和埃希氏菌属丰度均呈正相关。有研究表明,梭状芽孢杆菌、葡萄球菌、大肠埃希菌、肠球菌等可产生β-GD,经体内外培养后测定均表现为阳性,而双歧杆菌、乳酸杆菌等在体内外均不产生β-GD[23-24]。胆红素进入肠道后,其进行肠肝循环还是排出体外,肠道菌群起着非常重要的作用。微生物组编码的β-GD在人类胃肠道中扮演了重要的角色。由于新生儿胃肠道微生物定植不充分和延迟,参与胆红素代谢的微生物群相对较少,积累在肠道腔内的未结合胆红素可经历大量的肝肠循环和肠道循环,使得新生儿血清胆红素水平升高。当新生儿肠道菌群中与β-GD增高相关的菌种增加,β-GD在肠道内含量增高,它可能导致新生儿非结合胆红素水平增高。新生儿肠道菌群在门水平上由厚壁菌门、变形菌门、拟杆菌门、放线菌门、疣微菌门等构成。肠道菌群在体内产生的β-GD根据有无完整的细菌环分为两种类型:L-β-GD(有完整的细菌环)和NL-β-GD(无完整的细菌环)。厚壁菌门、变形菌门产生的β-GD属于L-β-GD,而拟杆菌门产生的β-GD属于NL-β-GD。葡萄球菌属在门水平上属于厚壁菌门,埃希氏菌属在门水平上属于变形菌门,这两种高未结合胆红素血症新生儿肠道内的优势菌在体内产生L-β-GD。L-β-GD具有完整的细菌环,能够发挥酶的作用,分解胆红素-葡萄糖醛酸酯之间连接的酯链,使肠道内的结合胆红素转化为未结合胆红素,而未结合胆红素是一种脂溶性的非极性物质,易于在小肠部位重新吸收进入肠肝循环,使得血清中胆红素水平增高[25]。β-GD的数量和结构的差异影响了肠肝循环和血清胆红素水平。
综上,本研究显示了高胆红素血症新生儿和非高胆红素血症新生儿肠道菌群存在差异,粪便中与胆红素肠肝循环关系密切的β-GD活性与差异菌葡萄球菌属和埃希氏菌属丰度呈正相关性。肠道菌群可能通过调节β-GD活性影响新生儿高胆红素血症的发生,通过对新生儿肠道菌群、β-GD活性进行测定和分析,对早期评估新生儿高胆红素血症的发生有一定的临床意义。这些研究结果是目前证明人体肠道菌群可以影响血清胆红素水平的有力证据。后期将通过宏基因组测序和代谢组学等方法进一步分析肠道微生态对新生儿血清胆红素水平影响的具体作用机制。
| [1] |
Bhutani VK, Vilms RJ, Hamerman-Johnson L. Universal bilirubin screening for severe neonatal hyperbilirubinemia[J]. J Perinatol, 2010, 30(Suppl): S6-S15. DOI:10.1038/jp.2010.98 PMID: 20877410. (  0) 0) |
| [2] |
Mir SE, van der Geest BAM, Been JV. Management of neonatal jaundice in low- and lower-middle-income countries[J]. BMJ Paediatr Open, 2019, 3(1): e000408. DOI:10.1136/bmjpo-2018-000408 PMID: 30957028. PMCID: PMC6422246. (  0) 0) |
| [3] |
Clemente JC, Ursell LK, Parfrey LW, et al. The impact of the gut microbiota on human health: an integrative view[J]. Cell, 2012, 148(6): 1258-1270. DOI:10.1016/j.cell.2012.01.035 PMID: 22424233. PMCID: PMC5050011. (  0) 0) |
| [4] |
Lata J, Jurankova J, Kopacova M, et al. Probiotics in hepatology[J]. World J Gastroenterol, 2011, 17(24): 2890-2896. DOI:10.3748/wjg.v17.i24.2890 PMID: 21734800. PMCID: PMC3129503. (  0) 0) |
| [5] |
Sommer F, Bäckhed F. The gut microbiota: masters of host development and physiology[J]. Nat Rev Microbiol, 2013, 11(4): 227-238. DOI:10.1038/nrmicro2974 PMID: 23435359. (  0) 0) |
| [6] |
Friedrich MJ. Genomes of microbes inhabiting the body offer clues to human health and disease[J]. JAMA, 2013, 309(14): 1447-1449. DOI:10.1001/jama.2013.2824 PMID: 23571560. (  0) 0) |
| [7] |
Palmer C, Bik EM, Digiulio DB, et al. Development of the human infant intestinal microbiota[J]. PLoS Biol, 2007, 5(7): e177. DOI:10.1371/journal.pbio.0050177 PMID: 17594176. PMCID: PMC1896187. (  0) 0) |
| [8] |
Mirghafourvand M, Seyedi R, Dost AJ, et al. Relationship between neonatal skin bilirubin level and severe jaundice with maternal, childbirth, and neonatal characteristics[J]. Iran J Neonatol, 2019, 10(2): 61-67. DOI:10.22038/ijn.2019.33282.1478 (  0) 0) |
| [9] |
Zubaida B, Cheema HA, Hashmi MA, et al. Spectrum of UGT1A1 variants in Pakistani children affected with inherited unconjugated hyperbilirubinemias[J]. Clin Biochem, 2019, 69: 30-35. DOI:10.1016/j.clinbiochem.2019.05.012 PMID: 31145902. (  0) 0) |
| [10] |
Agans R, Rigsbee L, Kenche H, et al. Distal gut microbiota of adolescent children is different from that of adults[J]. FEMS Microbiol Ecol, 2011, 77(2): 404-412. DOI:10.1111/j.1574-6941.2011.01120.x.4 PMID: 21539582. PMCID: PMC4502954. (  0) 0) |
| [11] |
Yatsunenko T, Rey FE, Manary MJ, et al. Human gut microbiome viewed across age and geography[J]. Nature, 2012, 486(7402): 222-227. DOI:10.1038/nature11053 PMID: 22699611. PMCID: PMC3376388. (  0) 0) |
| [12] |
中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 新生儿高胆红素血症诊断和治疗专家共识[J]. 中华儿科杂志, 2014, 52(10): 745-748. DOI:10.3760/cma.j.issn.0578-1310.2014.10.006 (  0) 0) |
| [13] |
Vítek L, Zelenka J, Zadinová M, et al. The impact of intestinal microflora on serum bilirubin levels[J]. J Hepatol, 2005, 42(2): 238-243. DOI:10.1016/j.jhep.2004.10.012 PMID: 15664250. (  0) 0) |
| [14] |
Tuzun F, Kumral A, Duman N, et al. Breast milk jaundice: effect of bacteria present in breast milk and infant feces[J]. J Pediatr Gastroenterol Nutr, 2013, 56(3): 328-332. DOI:10.1097/MPG.0b013e31827a964b PMID: 23132163. (  0) 0) |
| [15] |
Thongaram T, Hoeflinger JL, Chow J, et al. Prebiotic galactooligosaccharide metabolism by probiotic lactobacilli and bifidobacteria[J]. J Agric Food Chem, 2017, 65(20): 4184-4192. DOI:10.1021/acs.jafc.7b00851 PMID: 28466641. (  0) 0) |
| [16] |
Slusher TM, Zamora TG, Appiah D, et al. Burden of severe neonatal jaundice: a systematic review and meta-analysis[J]. BMJ Paediatr Open, 2017, 1(1): e000105. DOI:10.1136/bmjpo-2017-000105 PMID: 29637134. PMCID: PMC5862199. (  0) 0) |
| [17] |
Najati N, Gharebaghi MM, Mortazavi F. Underlying etiologies of prolonged icterus in neonates[J]. Pak J Biol Sci, 2010, 13(14): 711-714. DOI:10.3923/pjbs.2010.711.714 PMID: 21848064. (  0) 0) |
| [18] |
Henny-Harry C, Trotman H. Epidemiology of neonatal jaundice at the University Hospital of the West Indies[J]. West Indian Med J, 2012, 61(1): 37-42. PMID: 22808564. (  0) 0) |
| [19] |
Wen CC, Cai JZ, Lin CL, et al. Gradient elution liquid chromatography mass spectrometry determination of acetylcorynoline in rat plasma and its application to a pharmacokinetic study[J]. Xenobiotica, 2014, 44(8): 743-748. DOI:10.3109/00498254.2014.887802 PMID: 24512634. (  0) 0) |
| [20] |
Ahlfors CE, Parker AE. Bilirubin binding contributes to the increase in total bilirubin concentration in newborns with jaundice[J]. Pediatrics, 2010, 126(3): e639-e643. DOI:10.1542/peds.2010-0614 PMID: 20679308. (  0) 0) |
| [21] |
Henao-Mejia J, Elinav E, Thaiss CA, et al. Role of the intestinal microbiome in liver disease[J]. J Autoimmun, 2013, 46: 66-73. DOI:10.1016/j.jaut.2013.07.001 PMID: 24075647. (  0) 0) |
| [22] |
Redinbo MR. The microbiota, chemical symbiosis, and human disease[J]. J Mol Biol, 2014, 426(23): 3877-3891. DOI:10.1016/j.jmb.2014.09.011 PMID: 25305474. PMCID: PMC4252811. (  0) 0) |
| [23] |
Gmeiner M, Kneifel W, Kulbe KD, et al. Influence of a synbiotic mixture consisting of Lactobacillus acidophilus 74-2 and a fructooligosaccharide preparation on the microbial ecology sustained in a simulation of the human intestinal microbial ecosystem (SHIME reactor)[J]. Appl Microbiol Biotechnol, 2000, 53(2): 219-223. DOI:10.1007/s002530050011 PMID: 10709985. (  0) 0) |
| [24] |
Matamoros S, Gras-Leguen C, Le Vacon F, et al. Development of intestinal microbiota in infants and its impact on health[J]. Trends Microbiol, 2013, 21(4): 167-173. DOI:10.1016/j.tim.2012.12.001 PMID: 23332725. (  0) 0) |
| [25] |
Pollet RM, D'Agostino EH, Walton WG, et al. An atlas of β-glucuronidases in the human intestinal microbiome[J]. Structure, 2017, 25(7): 967-977.e5. DOI:10.1016/j.str.2017.05.003 PMID: 28578872. PMCID: PMC5533298. (  0) 0) |
 2021, Vol. 23
2021, Vol. 23


